Содержание
- 2. Генетика человека Френсис Гальтон 1822 - 1911
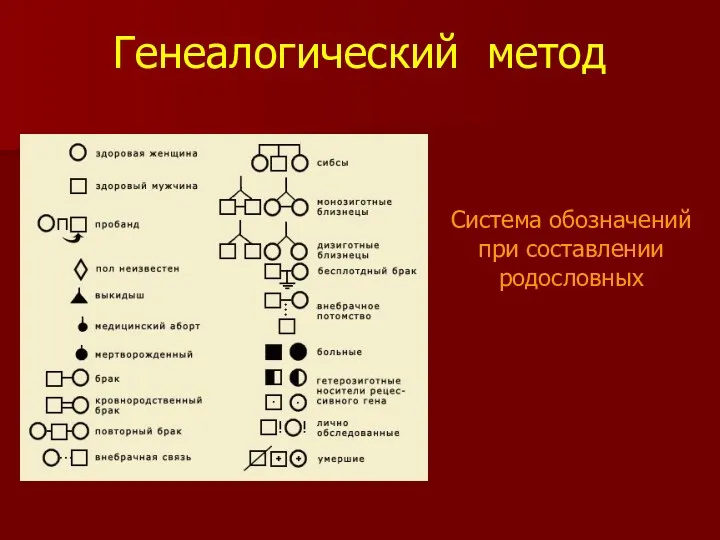
- 3. Генеалогический метод Система обозначений при составлении родословных
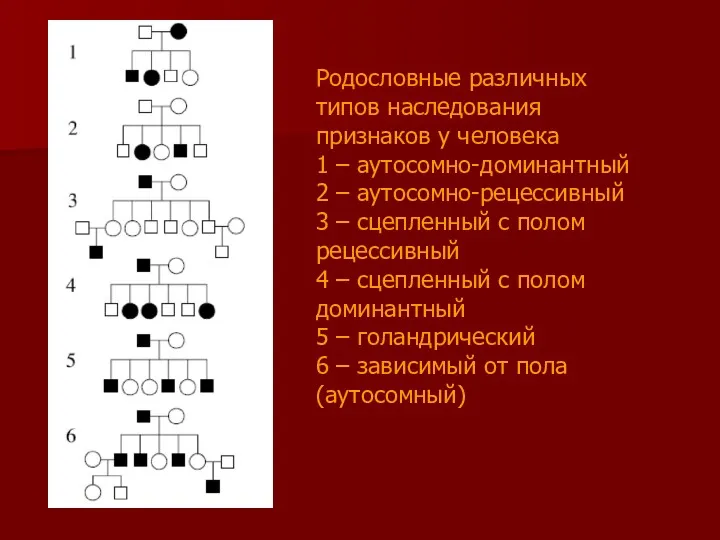
- 4. Родословные различных типов наследования признаков у человека 1 – аутосомно-доминантный 2 – аутосомно-рецессивный 3 – сцепленный
- 5. Наследование гемофилии в царских домах Европы
- 6. Габсбургская губа Леопольд IX Чарльз V
- 7. Цитогенетический метод Группы хромосом человека по размеру и положению центромеры: 1. Группа А (1 – 3)
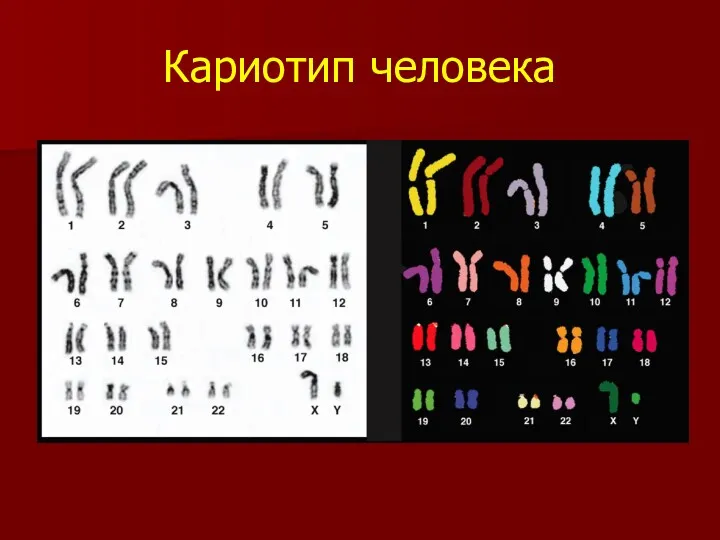
- 8. Кариотип человека
- 9. Цитогенетический метод G-окраска Многоцветная FISH
- 10. Гены заболеваний, картированные в первой хромосоме человека
- 11. Близнецовый метод Мэри-Кейт и Эшли Фуллер Олсен Людовик XIV
- 12. Близнецовый метод Сестры Дионн, Канада, Онтарио, 1934
- 13. Близнецовый метод Хван Сеул (Hwang Seul), Хван Сеол (Hwang Seol), Хван Сол (Hwang Sol) и Хван
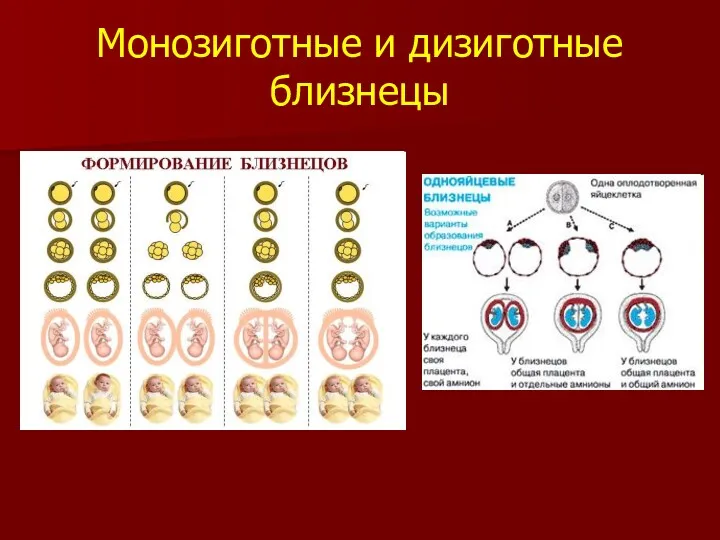
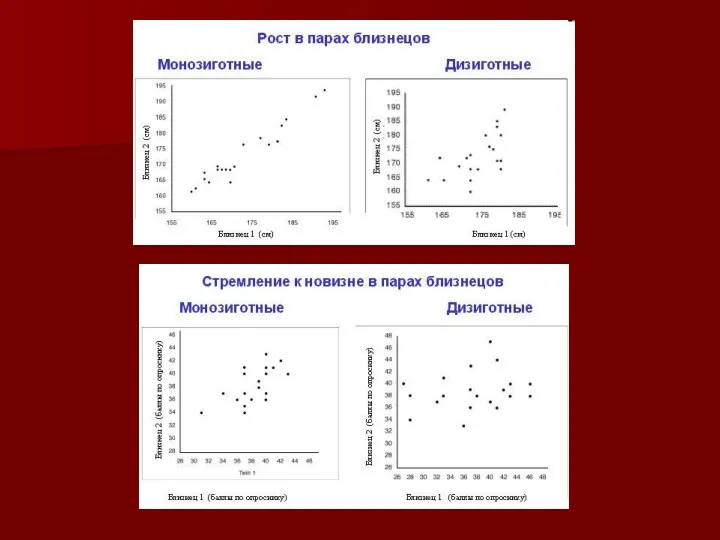
- 14. Монозиготные и дизиготные близнецы
- 15. Сиамские близнецы Абигейл и Бриттани Хенсел, США, 1990 Чанг и Энг, Сиам (Таиланд), 1811 Маша и
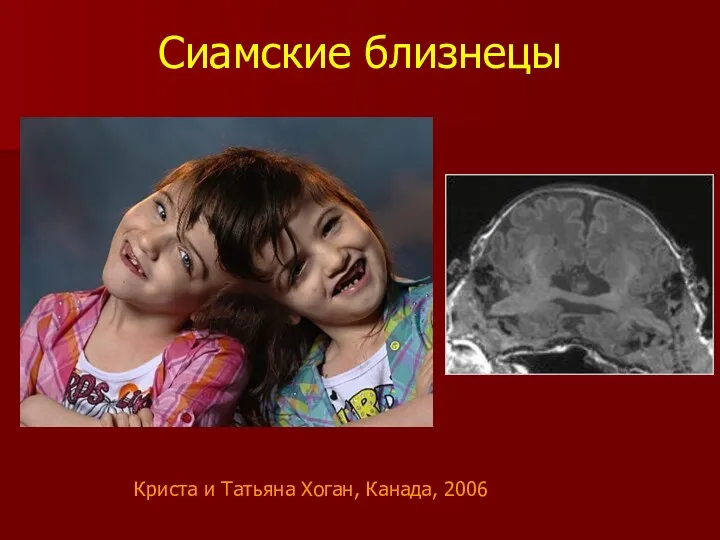
- 16. Сиамские близнецы Криста и Татьяна Хоган, Канада, 2006
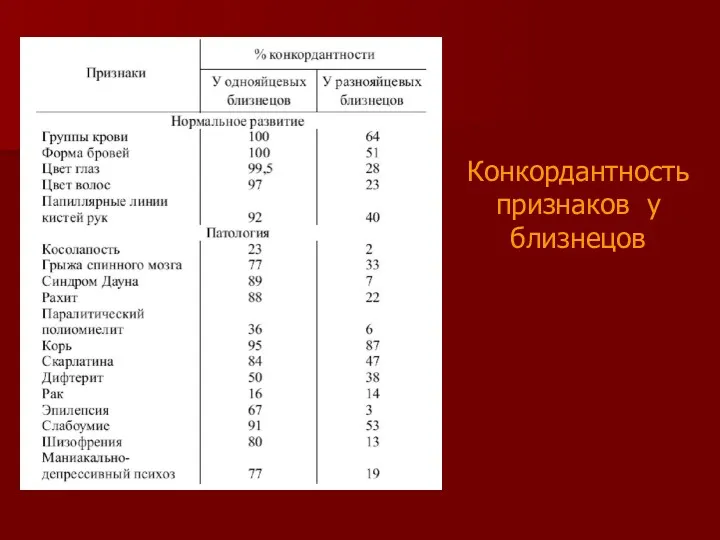
- 17. Конкордантность признаков у близнецов
- 19. Соотношение наследственности и среды Степень количественной оценки влияния наследственности (h) и среды (Е) оценивается по формуле
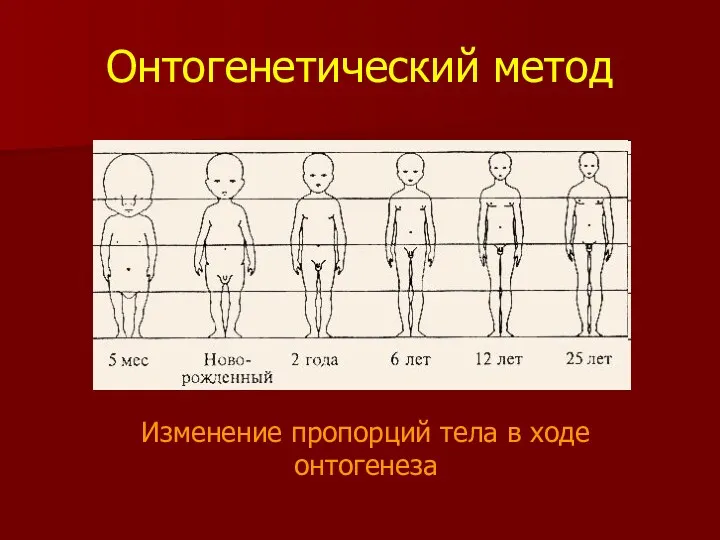
- 20. Онтогенетический метод Изменение пропорций тела в ходе онтогенеза
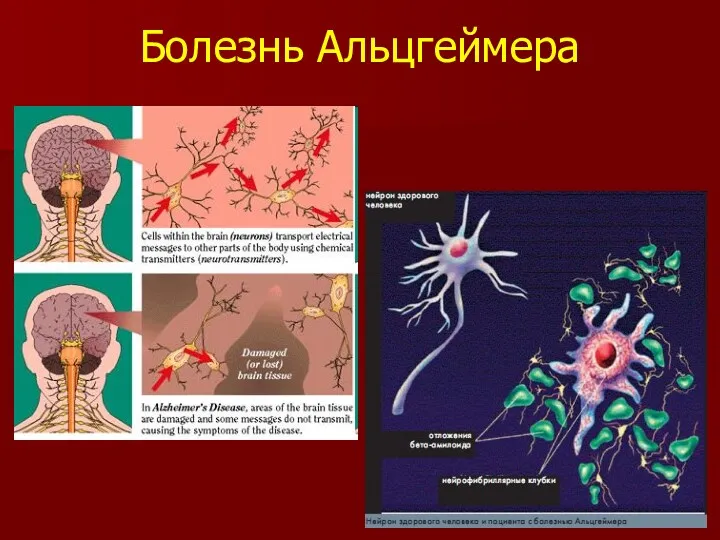
- 21. Болезнь Альцгеймера
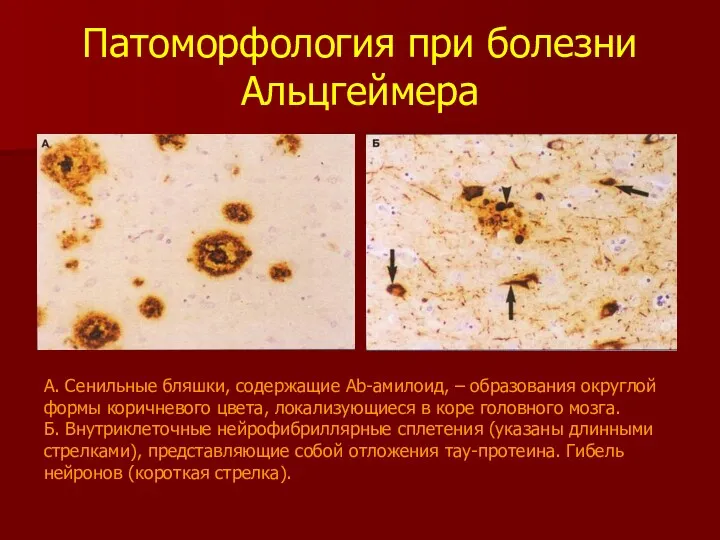
- 22. Патоморфология при болезни Альцгеймера А. Сенильные бляшки, содержащие Аb-амилоид, – образования округлой формы коричневого цвета, локализующиеся
- 23. Болезнь Альцгеймера
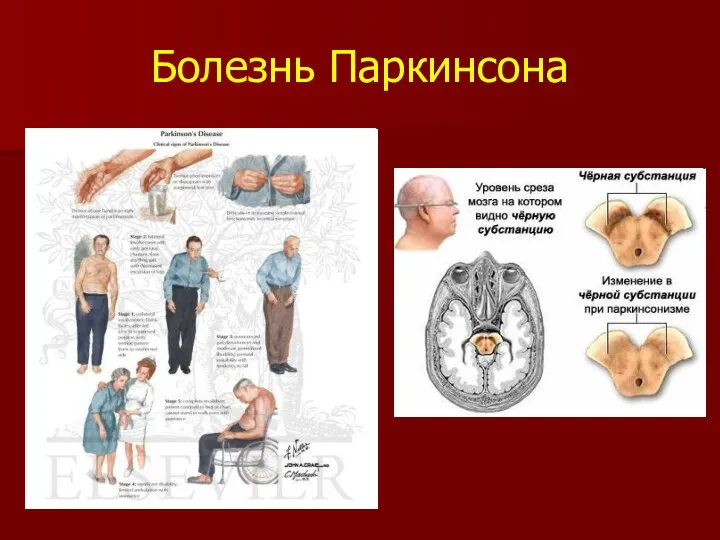
- 24. Болезнь Паркинсона Мохаммед Али Иоанн Павел II Ясир Арафат
- 25. Болезнь Паркинсона
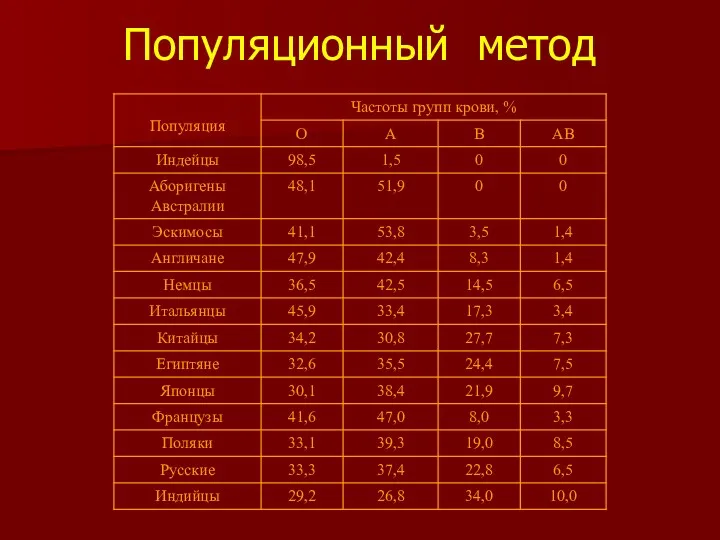
- 26. Популяционный метод
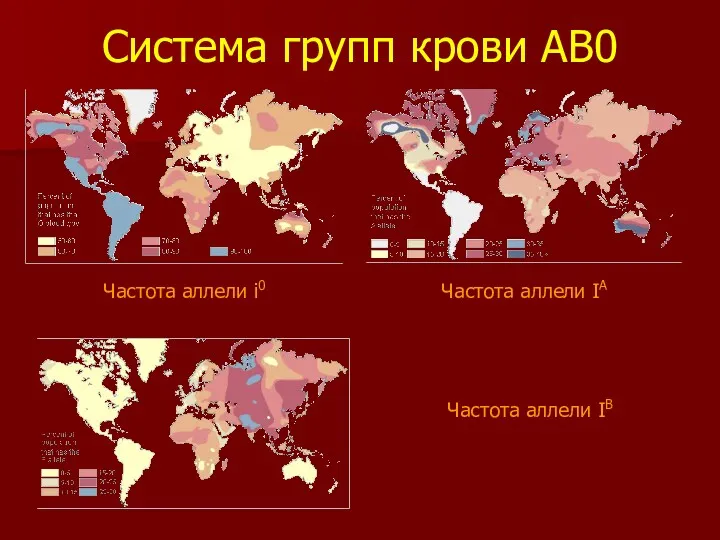
- 27. Система групп крови АВ0 Частота аллели i0 Частота аллели IA Частота аллели IВ
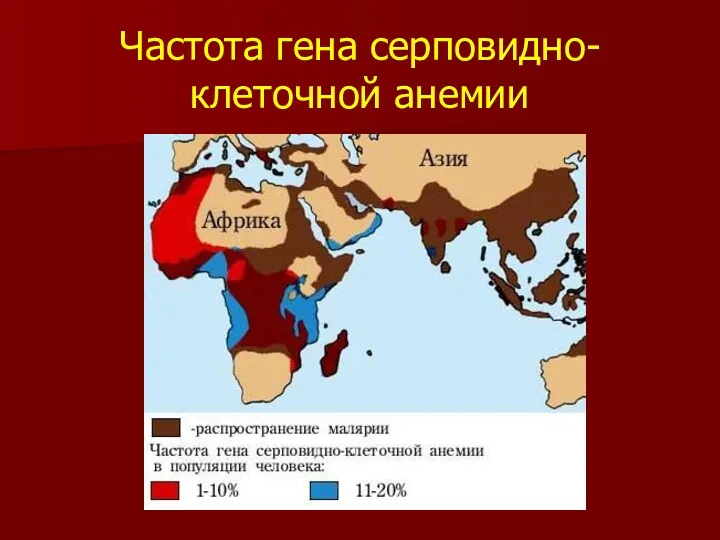
- 28. Частота гена серповидно-клеточной анемии
- 29. Биохимические методы Направлены на выявление биохимического фенотипа организма. Уровни, на которых оценивается фенотип: от первичного продукта
- 30. Биохимические методы Методы подтверждающей диагностики.
- 31. Молекулярно-генетические методы Получение образцов ДНК (РНК) – первый этап всех методов. Он включает выделение всей геномной
- 32. Полимеразная цепная реакция Схематическое изображение первого цикла ПЦР. 1. Денатурация ДНК при 94—96°C. 2. Отжиг праймеров
- 33. ПДРФ (RFLP, полиморфизм длины рестрикционных фрагментов) Исторически один из самых первых методов генотипирования. Суть заключается в
- 34. ПДАФ (AFLP, полиморфизм длины амплификационных фрагментов) Аналогичен RFLP, но применяется для повторов и полиморфизмов типа insertion/deletion.
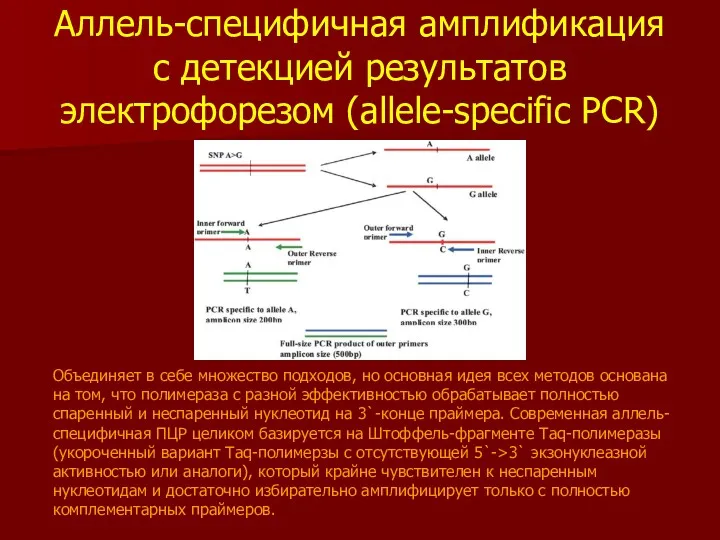
- 35. Аллель-специфичная амплификация с детекцией результатов электрофорезом (allele-specific PCR) Объединяет в себе множество подходов, но основная идея
- 36. Аллель-специфичная амплификация с детекцией результатов амплификатором в реальном времени (allele-specific real-time PCR, RT-ARMS PCR) Преимуществом использования
- 37. Аллель-специфичные зонды (allele-specific hybridization), наборы ABI TaqMan, наборы с FLASH-детекцией Основаны на способности полимеразы разрушать встречающиеся
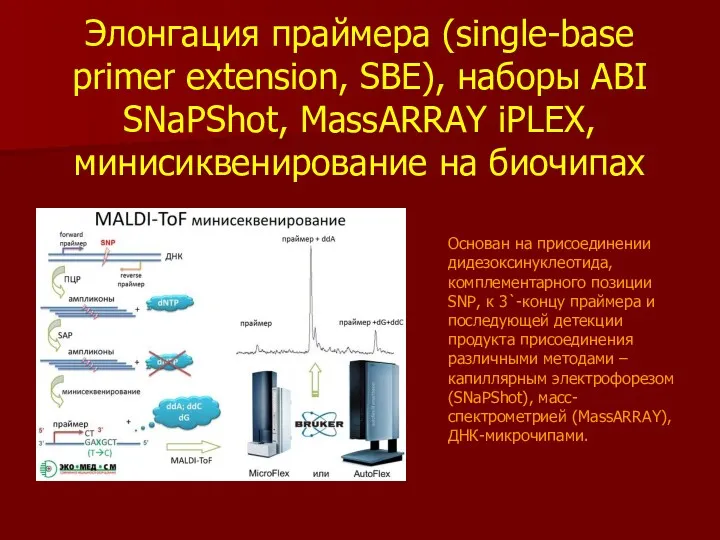
- 38. Элонгация праймера (single-base primer extension, SBE), наборы ABI SNaPShot, MassARRAY iPLEX, минисиквенирование на биочипах Основан на
- 39. Лигирование олигонуклеотидных зондов (oligonucleotide ligation assay), наборы ABI SNPlex Специфические ДНК-последовательности исследуют путем использования их в
- 40. Гибридизация олигонуклеотидных зондов (Hyb Probes) Основан на тримолекулярном взаимодействии ДНК и двух зондов в области нуклеотидной
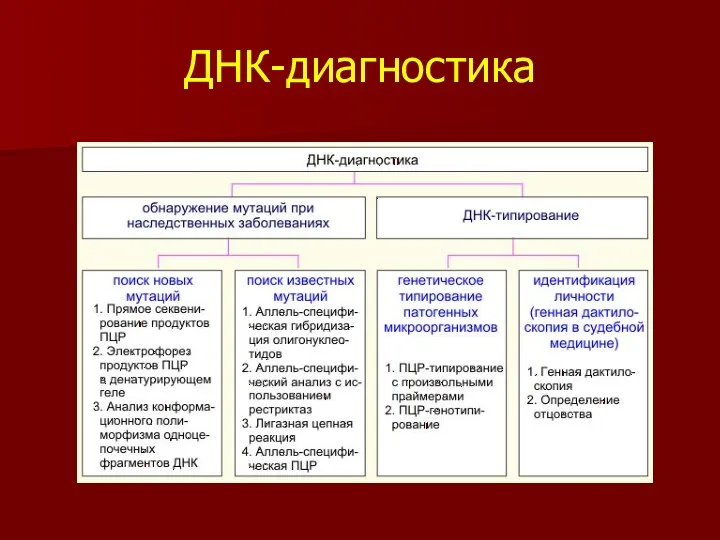
- 41. ДНК-диагностика
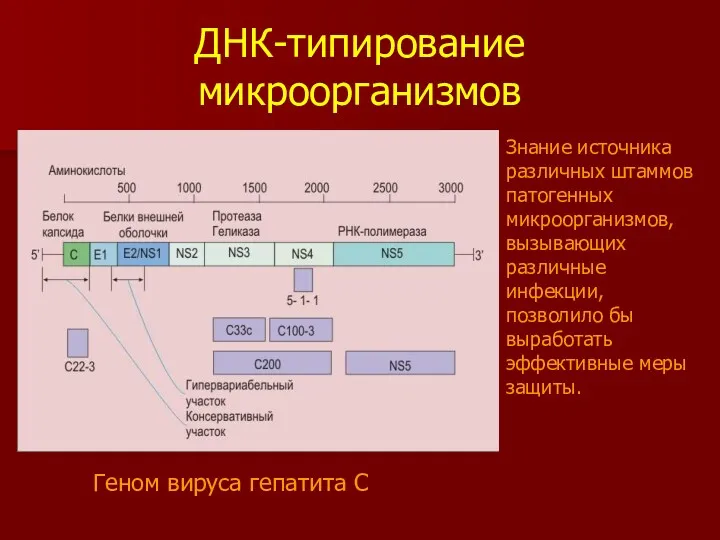
- 42. ДНК-типирование микроорганизмов Знание источника различных штаммов патогенных микроорганизмов, вызывающих различные инфекции, позволило бы выработать эффективные меры
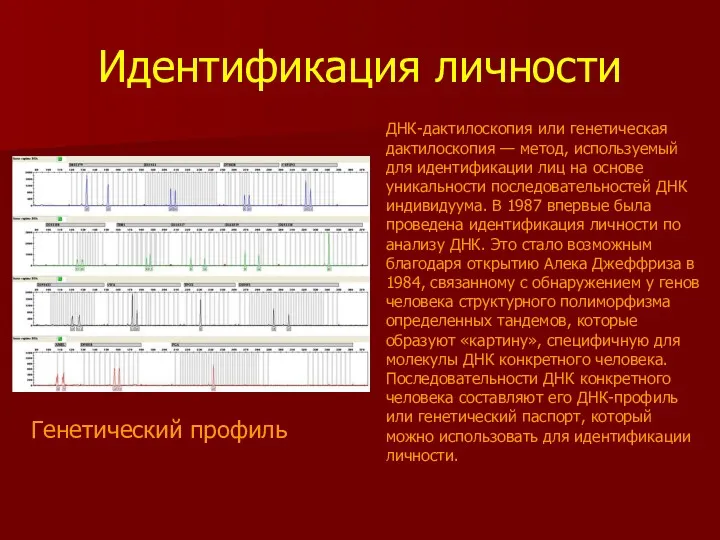
- 43. Идентификация личности Генетический профиль ДНК-дактилоскопия или генетическая дактилоскопия — метод, используемый для идентификации лиц на основе
- 44. Фамилия: Иванов Имя: Иван Отчество: Иванович Год рождения: 1931 Домашний адрес: г.Уфа, ул. 50 лет СССР,
- 45. Генная дактилоскопия Процесс ДНК-дактилоскопии начинается с подготовки образца ДНК индивидуума (обычно называемого «контрольным образцом»). Контрольный образец
- 46. Базы данных ДНК-профилей Метод ДНК-анализа применяется в экспертно-криминалистической практике. Самый большой банк данных ДНК в мире
- 48. Скачать презентацию


























 Презентация по теме Витамины
Презентация по теме Витамины Протеиновое питание
Протеиновое питание Слух. Среднее и внутреннее ухо. Функции среднего уха. Строение улитки
Слух. Среднее и внутреннее ухо. Функции среднего уха. Строение улитки Молекулярная биология
Молекулярная биология Презентация Выделение у растений
Презентация Выделение у растений История эволюционных идей
История эволюционных идей Законы раздражения. Нервно-мышечный синапс. Парабиоз, его фазы
Законы раздражения. Нервно-мышечный синапс. Парабиоз, его фазы урок презентация Многообразие покрытосеменных растений
урок презентация Многообразие покрытосеменных растений ЕГЭ по биологии. Работа с рисунками
ЕГЭ по биологии. Работа с рисунками Представители парнокопытных
Представители парнокопытных Тип хордовые
Тип хордовые Опасные животные
Опасные животные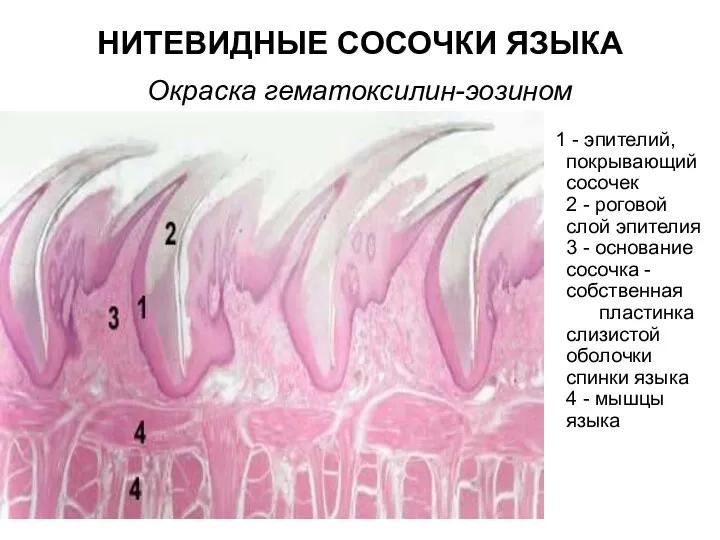 Нитевидные сосочки языка. Окраска гематоксилин-эозином
Нитевидные сосочки языка. Окраска гематоксилин-эозином ОПРЕДЕЛЕНИЕ ХРОНОБИОТИПА УЧАЩИХСЯ
ОПРЕДЕЛЕНИЕ ХРОНОБИОТИПА УЧАЩИХСЯ Общая характеристика и многообразие моллюсков
Общая характеристика и многообразие моллюсков Ч. Дарвин эволюциялық теорияның негізін салушы
Ч. Дарвин эволюциялық теорияның негізін салушы Мутационная изменчивость
Мутационная изменчивость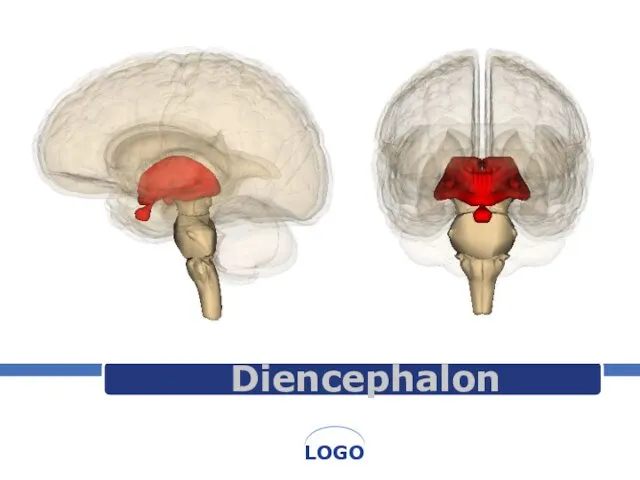 Diencephalon. Структуры промежуточного мозга
Diencephalon. Структуры промежуточного мозга Физиология высшей нервной деятельности. Формирование поведения в онтогенезе
Физиология высшей нервной деятельности. Формирование поведения в онтогенезе Презентация к уроку биологии 8 класс на тему: Общая характеристика млекопитающих
Презентация к уроку биологии 8 класс на тему: Общая характеристика млекопитающих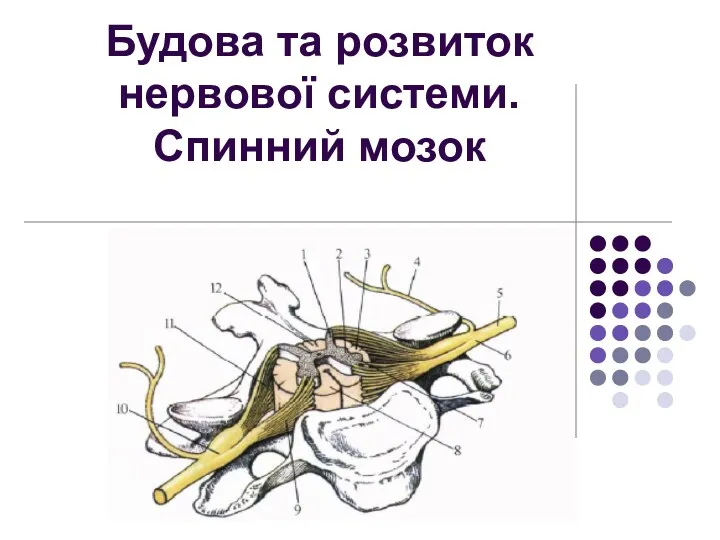 Будова та розвиток нервової системи. Спинний мозок
Будова та розвиток нервової системи. Спинний мозок Ядовитые и опасные растения
Ядовитые и опасные растения Микробы в доме
Микробы в доме Физиология микроорганизмов. (Лекция 3)
Физиология микроорганизмов. (Лекция 3) Особенности метаболизма микроорганизмов, используемые при биодеградации
Особенности метаболизма микроорганизмов, используемые при биодеградации Строение центральной нервной системы человека
Строение центральной нервной системы человека Тестирование по теме Цветок. Соцветие
Тестирование по теме Цветок. Соцветие Бионика. Виды бионики
Бионика. Виды бионики