Содержание
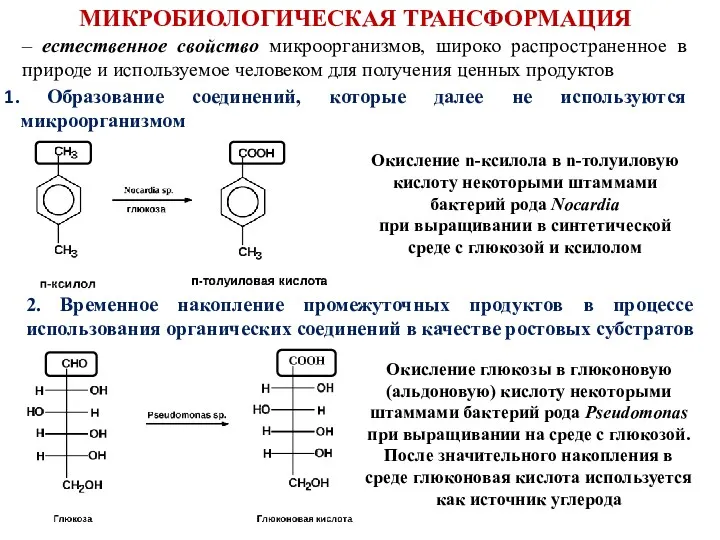
- 2. МИКРОБИОЛОГИЧЕСКАЯ ТРАНСФОРМАЦИЯ Образование соединений, которые далее не используются микроорганизмом – естественное свойство микроорганизмов, широко распространенное в
- 3. ПРЕИМУЩЕСТВА микробиологической трансформации: высокая специфичность действия микробных ферментов позволяет осуществлять тонкие перестройки молекул разной химической структуры
- 4. МИКРОБИОЛОГИЧЕСКАЯ ТРАНСФОРМАЦИЯ И ХИМИЧЕСКИЙ СИНТЕЗ Критерии выбора: рентабельность; особенности технологии; безопасность для здоровья человека и окружающей
- 5. В практической деятельности человека используются не только процессы трансформации, осуществляемые микроорганизмами в природе или стандартных условиях
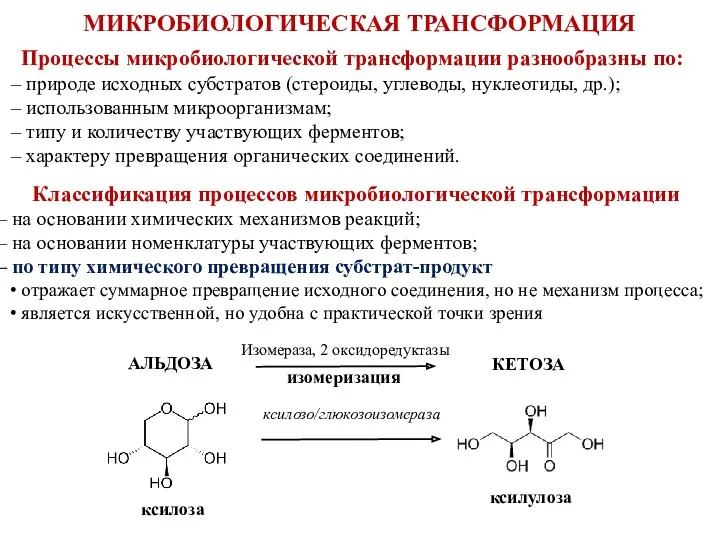
- 6. Процессы микробиологической трансформации разнообразны по: природе исходных субстратов (стероиды, углеводы, нуклеотиды, др.); использованным микроорганизмам; типу и
- 7. ТИПЫ ПРОЦЕССОВ МИКРОБИОЛОГИЧЕСКОЙ ТРАНСФОРМАЦИИ окисление, 2) восстановление, 3) декарбоксилирование, 4) дезаминирование, 5) образование гликозидов, 6) гидролиз,
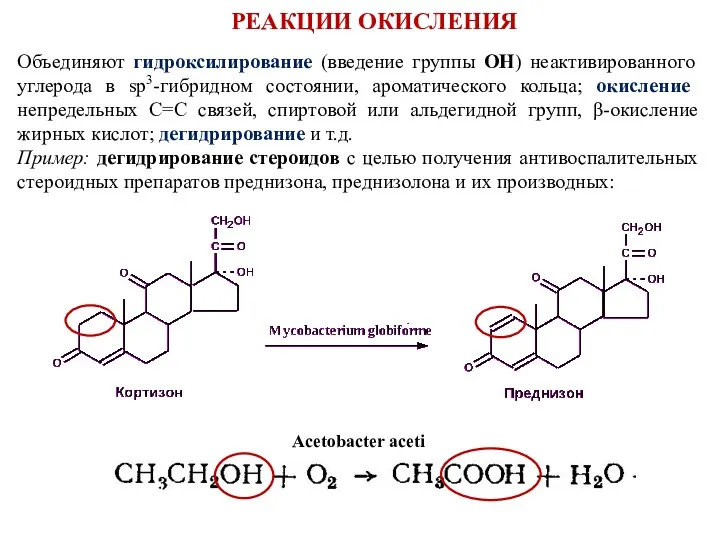
- 8. Объединяют гидроксилирование (введение группы ОН) неактивированного углерода в sp3-гибридном состоянии, ароматического кольца; окисление непредельных С=С связей,
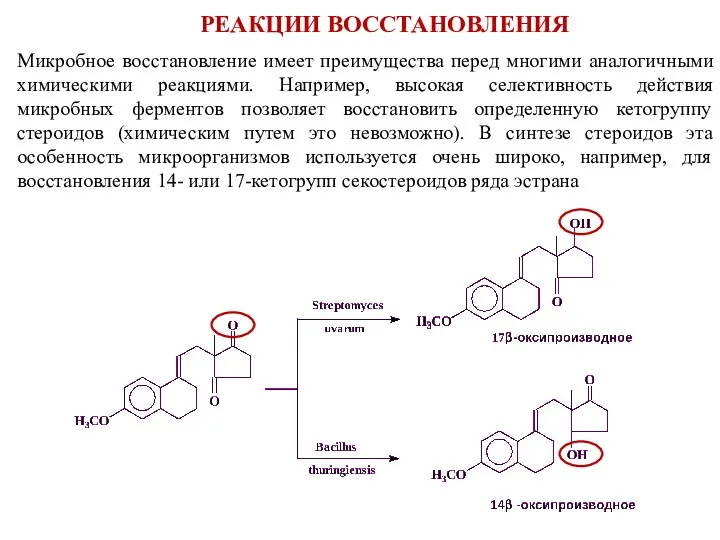
- 9. Микробное восстановление имеет преимущества перед многими аналогичными химическими реакциями. Например, высокая селективность действия микробных ферментов позволяет
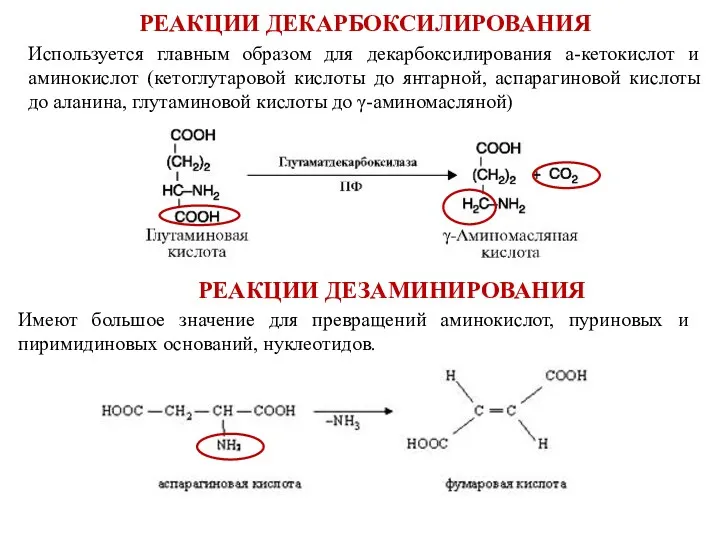
- 10. Используется главным образом для декарбоксилирования а-кетокислот и аминокислот (кетоглутаровой кислоты до янтарной, аспарагиновой кислоты до аланина,
- 11. Реакции аминирования играют ключевую роль в клеточном синтезе аминокислот. Особенно большое значение имеет процесс аминирования фумаровой
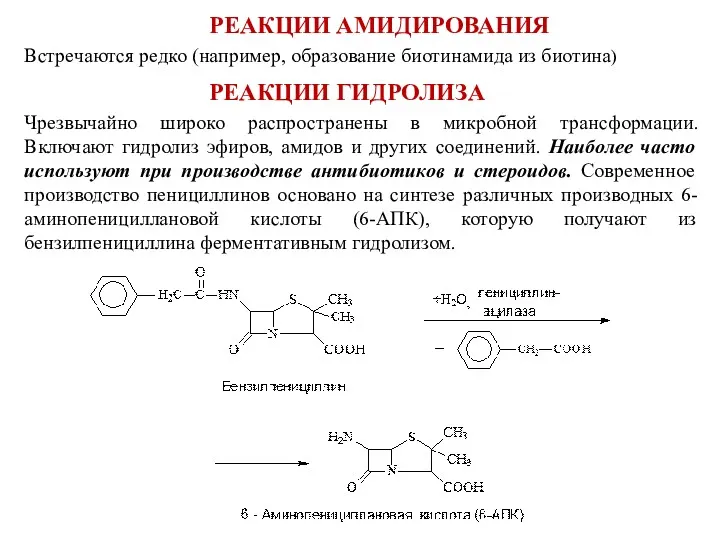
- 12. РЕАКЦИИ АМИДИРОВАНИЯ Встречаются редко (например, образование биотинамида из биотина) РЕАКЦИИ ГИДРОЛИЗА Чрезвычайно широко распространены в микробной
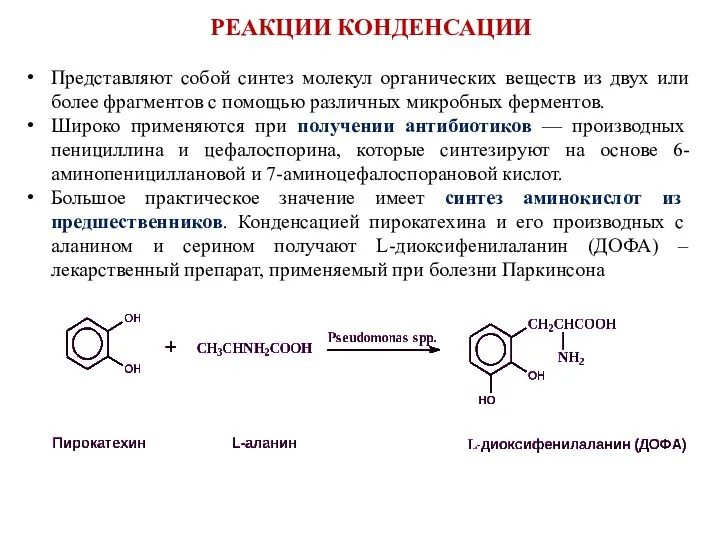
- 13. Представляют собой синтез молекул органических веществ из двух или более фрагментов с помощью различных микробных ферментов.
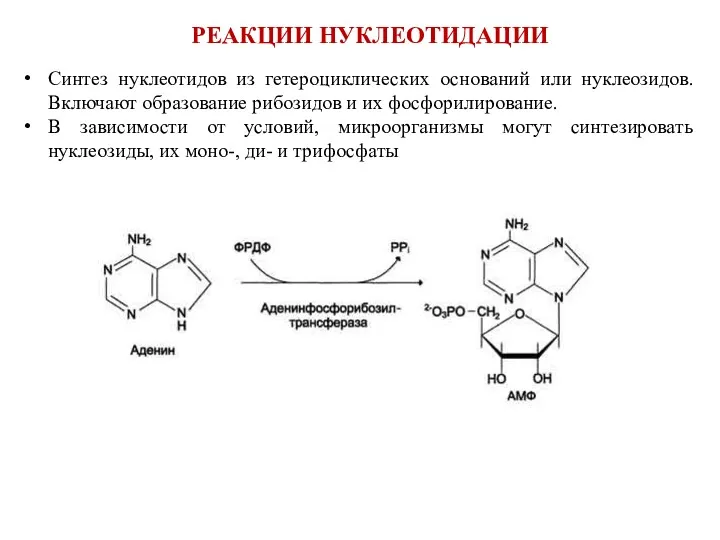
- 14. РЕАКЦИИ НУКЛЕОТИДАЦИИ Синтез нуклеотидов из гетероциклических оснований или нуклеозидов. Включают образование рибозидов и их фосфорилирование. В
- 15. Имеют большое практическое значение. На их использовании основан, например, промышленный процесс получения фруктозы из глюкозы РЕАКЦИИ
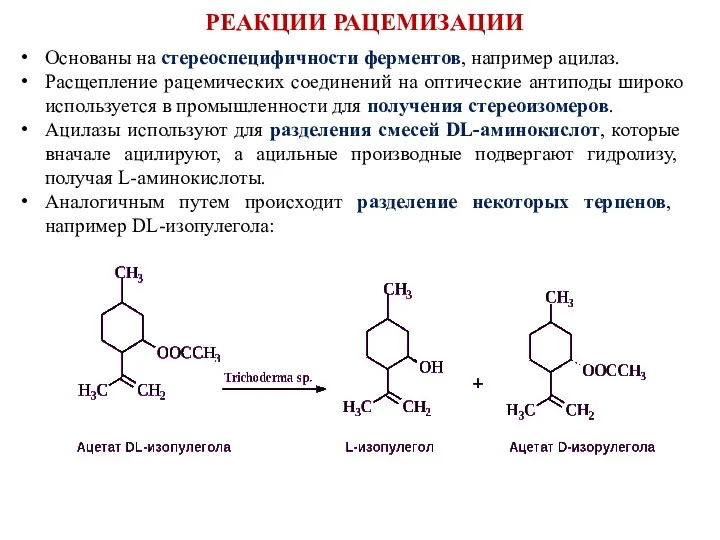
- 16. Основаны на стереоспецифичности ферментов, например ацилаз. Расщепление рацемических соединений на оптические антиподы широко используется в промышленности
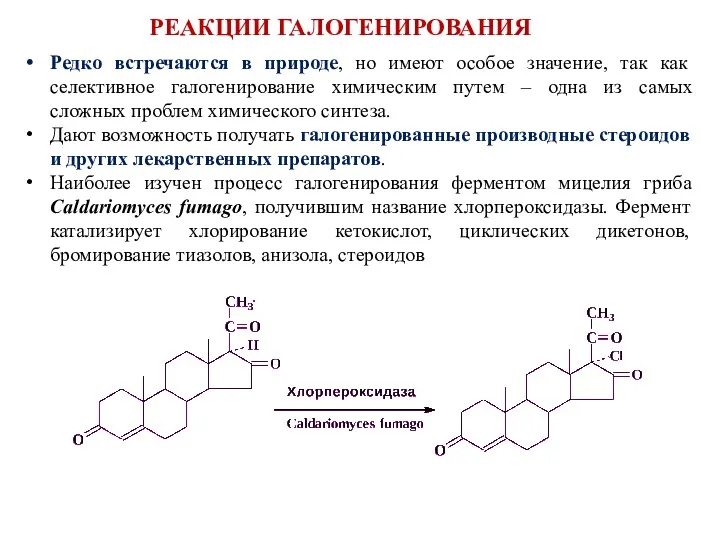
- 17. Редко встречаются в природе, но имеют особое значение, так как селективное галогенирование химическим путем – одна
- 18. Размножение культуры микроорганизма-трансформатора до количества, равного 5–10 % объема трансформируемого раствора. Приготовление раствора для трансформации: должен
- 19. Требования к микроорганизмам, трансформирующим органические соединения Современная методология микробной трансформации позволяет использовать для осуществления того или
- 20. Для микробной трансформации органических соединений используются обычно сапрофитные микроорганизмы, способные расти на обычных питательных средах и
- 21. I. Использование ферментативных свойств интактных клеток: 1) трансформация растущей культурой в периодических условиях; 2) использование ферментативной
- 22. Наиболее простой метод, применяемый в случаях, когда продукты трансформации не используются микроорганизмом-трансформатором. Трансформируемый субстрат может вноситься
- 23. Метод широко применяется в тех случаях, когда максимальная активность трансформации приурочена к определенной фазе развития культуры
- 24. Трансформация спорами грибов и актиномицетов Трансформация органических веществ спорами имеет ряд особенностей: обычно осуществляется в простых
- 25. Преимущество непрерывного культивирования по сравнению с периодическим при получении биомассы клеток стимулировали его применение для синтеза
- 26. Кометаболизм — процессы трансформации или полного разложения органических соединений, осуществляемые микроорганизмами сопряженно с метаболизмом других субстратов
- 27. Возможные пути интенсификация микробной трансформации косубстратом: использовании в процессе трансформации метаболитов, образующихся во процессе метаболизма косубстрата,
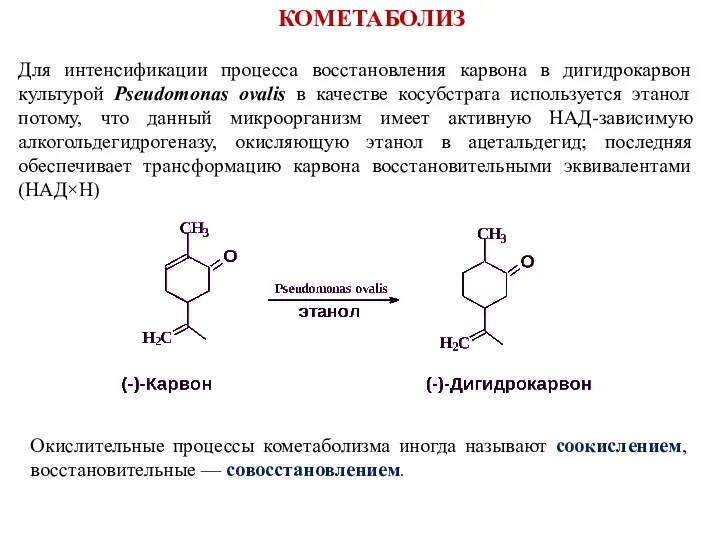
- 28. Для интенсификации процесса восстановления карвона в дигидрокарвон культурой Pseudomonas ovalis в качестве косубстрата используется этанол потому,
- 29. Применение поврежденных и дезинтегрированных клеток Применение: получение метаболитов, не накапливающихся в среде в обычных условиях в
- 30. Ингибирование определенных участков метаболических путей Применение: если известен фермент, ответственный за микробную трансформацию целевого соединения, есть
- 31. Применение мутантов с блокированным синтезом определенных ферментов Метод аналогичен ингибированию определенных участков метаболических путей, только вместо
- 32. Конструирование штаммов с повышенной способностью к трансформации Изучение нехромосомных элементов наследственности, контролирующих катаболизм у микроорганизмов многих
- 33. Использование иммобилизованных клеток микроорганизмов Эффективность процессов, осуществляемых иммобилизованными клетками микроорганизмов-продуцентов, зачастую выше эффективности использования интактных клеток.
- 34. Пример: получение L-яблочной кислоты из фумаровой кислоты с помощью иммобилизованных в каррагенан клеток Brevibacterium. Пример: трансформация
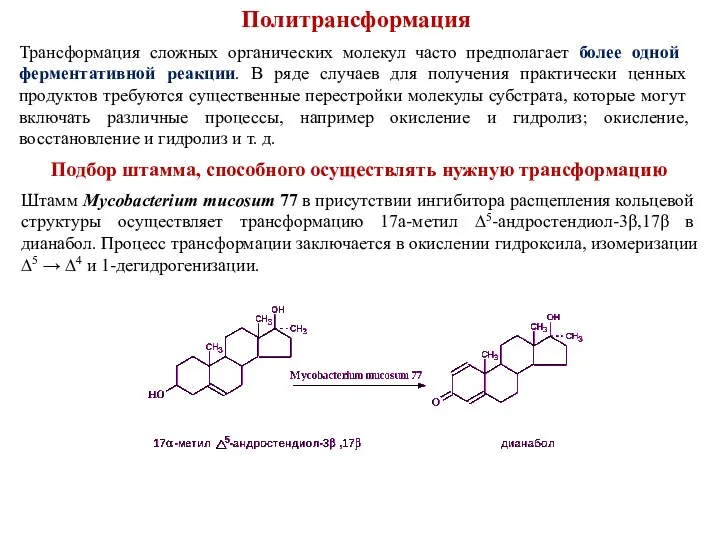
- 35. Политрансформация Трансформация сложных органических молекул часто предполагает более одной ферментативной реакции. В ряде случаев для получения
- 37. Скачать презентацию






















 Онтогенез. Типы онтогенеза
Онтогенез. Типы онтогенеза Видообразование. Основные направления эволюционного процесса
Видообразование. Основные направления эволюционного процесса Физиология синапсов
Физиология синапсов Генная инженерия
Генная инженерия Системы, которые создают корневое давление и ответственны за поднятие корневого водного раствора вверх по сосудам ксилемы
Системы, которые создают корневое давление и ответственны за поднятие корневого водного раствора вверх по сосудам ксилемы Презентация. Разработка раздела по биологии, 8 класс
Презентация. Разработка раздела по биологии, 8 класс Видообразование. Результаты микроэволюции
Видообразование. Результаты микроэволюции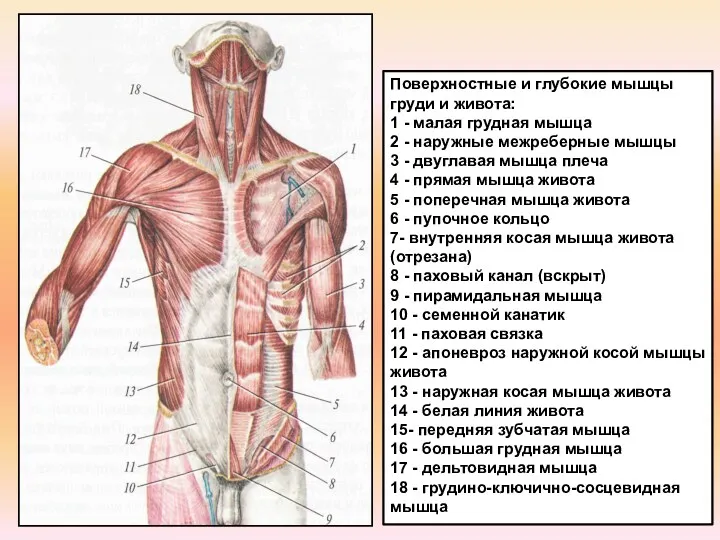 Поверхностные и глубокие мышцы груди и живота
Поверхностные и глубокие мышцы груди и живота Анатомия человека
Анатомия человека Плоды: значение и разнообразие. Типы семян
Плоды: значение и разнообразие. Типы семян Многообразие рыб
Многообразие рыб Эргастические вещества растительной клетки
Эргастические вещества растительной клетки Проектирование агротехнологий. Формирование структуры посевных площадей и севооборотов в современных агротехнологих
Проектирование агротехнологий. Формирование структуры посевных площадей и севооборотов в современных агротехнологих Імунна система людини, особливості її функціонування
Імунна система людини, особливості її функціонування Ягоды. Кроссворд
Ягоды. Кроссворд Паразитология как наука
Паразитология как наука Презентация по теме ''Лесные пожары''
Презентация по теме ''Лесные пожары'' Презентация к уроку биологии Дыхание животных
Презентация к уроку биологии Дыхание животных Клетка. Структура клетки. Органоиды клетки
Клетка. Структура клетки. Органоиды клетки Детоксикация ксенобиотиков
Детоксикация ксенобиотиков Млекопитающие отряда приматы
Млекопитающие отряда приматы Соотношение врожденного и приобретенного в поведении
Соотношение врожденного и приобретенного в поведении Тканевый обмен веществ
Тканевый обмен веществ Анализаторы. Литература
Анализаторы. Литература Марфуға Айтхожина
Марфуға Айтхожина Влияние талой воды на рост и развитие растений. 5 класс
Влияние талой воды на рост и развитие растений. 5 класс Органы дыхания
Органы дыхания Своя игра про животных
Своя игра про животных