Молекулярная биология гена. Введение. Успехи молекулярной биологии гена и геномики вчера, сегодня и завтра презентация
Содержание
- 2. Лекция 1 Введение. Успехи молекулярной биологии гена и геномики вчера, сегодня и завтра.
- 3. Список литературы: 1. Коничев А.С., Севастьянова Г.А. Молекулярная биология. М., 2005, 397 с. 2. Люин Б.
- 4. 1. В.А.Гвоздев. Механизмы регуляции активности генов в процессе транскрипции. СОЖ .1996. №1 2. Ратнер В.А. Генетика,
- 5. Интернет-источники Колесникова Т.Д. Подборка литературы для самостоятельного чтения и выполнения домашних заданий: http://engrailed.narod.ru/molbiol/ http://www.biotechnolog.ru – молекулярная
- 6. Молекулярная биология – это комплексная наука, изучающая свойства и проявления жизни на молекулярном уровне Термин молекулярная
- 7. Генетический аппарат вирусов – это совокупность входящих в состав вирусной частицы молекул ДНК или РНК, обеспечивающих
- 8. Что мы знали вчера о своем геноме?
- 9. Геном человека У взрослого человека примерно 1014 клеток, так что общая длина молекул ДНК в организме
- 11. фосфат Азотистое основание ОН-группа в положении С3’ служит для образования фосфодиэфирной связи с другим нуклеотидом пентоза
- 12. Нуклеиновые кислоты – ДНК и РНК (состоят из нуклеотидов, соединенных фосфодиэфирными связями) Фосфат Пентоза Азотистое основание
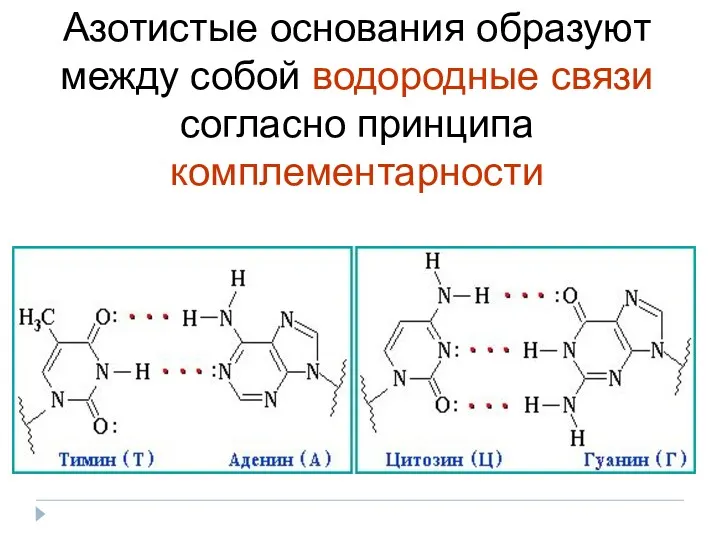
- 13. Азотистые основания образуют между собой водородные связи согласно принципа комплементарности
- 15. Особенности химического строения ДНК сделали возможным протекание ряда процессов с ее участием. Это: Репликация (самоудвоение ДНК)
- 16. Что мы узнали сегодня о свем геноме:
- 17. Исследователи надеются, что дальнейшее изучение этой структуры может рано или поздно привести к созданию лекарств или
- 18. Ученые выявили новый тип клеточной ДНК Обычно ДНК в клетках организована в хромосомы. Для обнаружения нехромосомной
- 19. Началось детальное исследование "мусорной ДНК" Большая часть человеческого генома представлена так называемым "мусорным ДНК" - свободными
- 20. Ученые обнаружили смысл в "мусорной" ДНК человека Ученым удалось выяснить, что «некодирующая часть генома», считавшаяся «мусором»,
- 21. Хотя функции микроРНК весьма разнообразны, основная их роль состоит в участии в процессах РНК-интерференции, благодаря которым
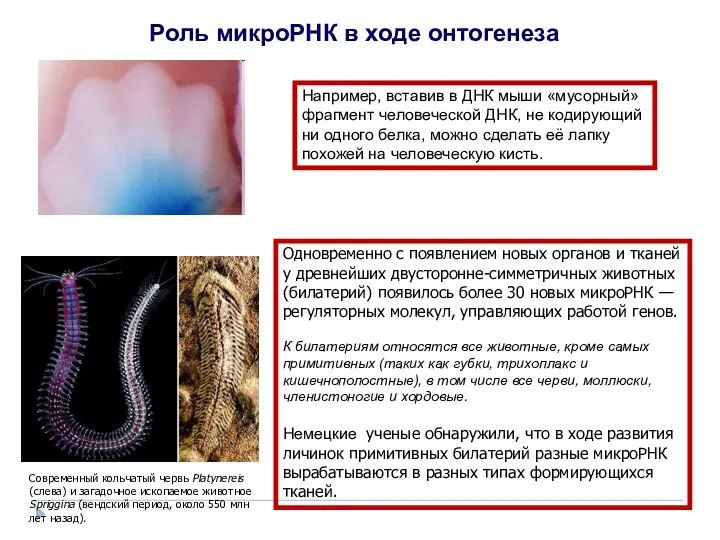
- 22. Роль микроРНК в ходе онтогенеза Например, вставив в ДНК мыши «мусорный» фрагмент человеческой ДНК, не кодирующий
- 23. Ученые из Йельского университета смогли остановить рост опухоли в легких мышей с помощью интраназального введения лекарства,
- 24. Специфические микроРНК (например, микроРНК-122) контролируют размножение вируса гепатита С в клетках печени у человека. В отсутствие
- 25. МикроR214 отвечает за выработку инсулина поджелудочной железой. Согласно работам профессора Гая Руттера из Имперского Колледжа Лондона,
- 26. Российские учёные синтезировали противоопухолевую микроРНК Учёные также исследовали способность препарата вызывать синтез интерферона. Было показано, что
- 27. В декабре 2008 г. фармацевтическая компания Regulus Therapeutics объявила об успешных испытаниях на животных синтетических молекул,
- 28. Ироничный афоризм "Ты – есть то, что ты ешь" стал реальностью. МикроРНК растений, которые мы каждый
- 29. Еще одно открытие! Прорыв в науке — перепрограммирование клеток Лауреатами Нобелевской премии по физиологии и медицине
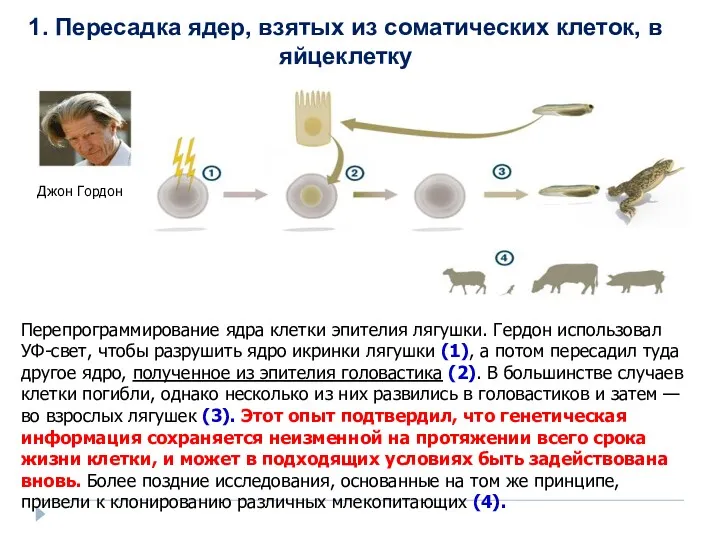
- 30. 1. Пересадка ядер, взятых из соматических клеток, в оплодотворенную яйцеклетку, из которой предварительно удалено ядро; 2.
- 31. Перепрограммирование ядра клетки эпителия лягушки. Гердон использовал УФ-свет, чтобы разрушить ядро икринки лягушки (1), а потом
- 32. Неоплодотворенная яйцеклетка Инактивация ядра ультрафиолетом Клетки кишечника головастика Пересадка ядра в яйцеклетку Микропипетка Клонирование лягушки
- 33. 1958 First cloned animal Xenopus laevis Джон Гордон
- 34. Ian Wilmut Долли …и ее потопство 1994, 1996
- 35. На седьмом году её жизни Долли пришлось усыпить. Специалисты предполагают, что причиной ранней ее смерти могли
- 36. 3. Модификация соматической клетки, приводящая к её превращению в стволовую клетку Колонии человеческих индуцированных плюрипотентных стволовых
- 37. Способ перепрограммирования специализированной клетки в стволовую Яманака изъял фибробласт из тканей мыши, ввел в него 4
- 38. Метод Гордона и Яманаки в действии Под впечатлением от работ Яманаки ученые быстро нашли способ превратить
- 39. , Ученые отмечают, что сам процесс превращения эпителиальных клеток в ИПСК занимал всего 12 дней. Помещая
- 40. Из стволовых клеток выращены клетки мозга Исследователи из Висконсинского университета вживили в мозг мыши нейрон, выращенный
- 41. С ооцитами сложнее – тут пришлось использовать следующую процедуру: смесь эмбриональных стволовых клеток помещали в яичники
- 42. Данная технология позволит производить человеческие половые клетки, а затем и эмбрионы из клеточных линий и тканей
- 43. Японцы предложили выращивать человеческие органы в животных Для проведения эксперимента исследователи из Токийского университета создали генно-инженерных
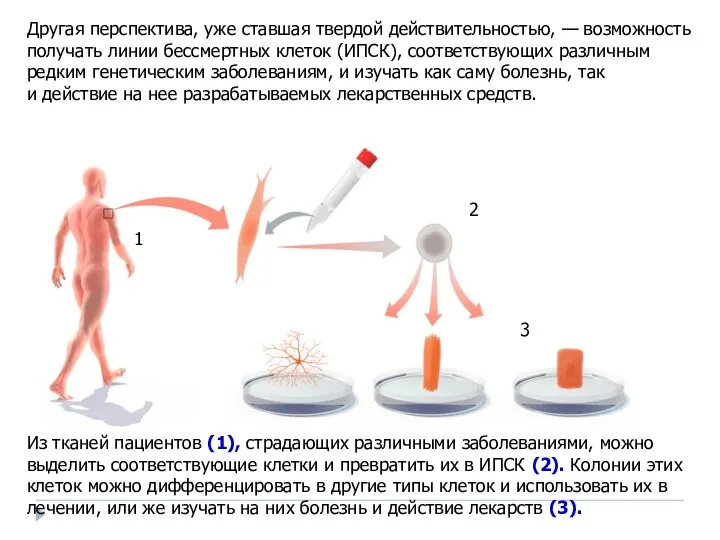
- 44. Из тканей пациентов (1), страдающих различными заболеваниями, можно выделить соответствующие клетки и превратить их в ИПСК
- 45. В частности, на модели наследственной вегетативной дистонии проведен скрининг ряда химических веществ и найден прототип лекарства
- 46. ИПСК уже получены для таких заболеваний как: амиотрофический латеральный склероз (болезнь Шарко) - прогрессирующее поражение двигательных
- 47. Использование стволовых клеток для выращивания органов
- 48. В Японии созданы фрагменты почки человека из ИПСК Ученые вырастили из ИПСК человека клетки тканей, из
- 50. По общему заключению экспертов котлета мало чем отличалась от нормального бургера, разве что не была такой
- 51. С помощью стволовых клеток отечественные специалисты планируют научиться лечить в первую очередь склероз, сердечно-сосудистые заболевания, получать
- 52. В Минске откроется международный центр клеточных технологий Инфраструктура медицинского заведения уже создана, а первый этап открытия
- 53. У нас мало генов, но это не мешает быть нам самыми умными! Почему?
- 54. Анализ 400 млн фрагментов РНК из разных тканей и органов показал, что 94% человеческих генов подвергаются
- 55. Сплайсинг это довольно простое и важное биологическое явление. Его суть состоит в том, что считанная с
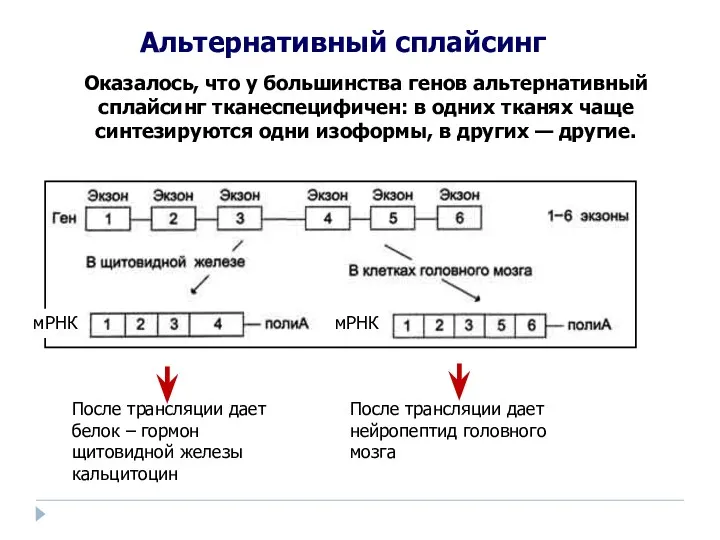
- 56. Пре-мРНК Зрелая мРНК Экзоны (последовательности, которые кодируют белок) Интроны (последовательности, которые не кодируют белок) Экзоны 1
- 57. Альтернативный сплайсинг В ходе созревания пре-мРНК в ядре сшиваться могут не все экзоны, и в разных
- 58. Альтернативный сплайсинг — процесс, в ходе которого экзоны, вырезаемые из пре-мРНК, объединяются в различных комбинациях, что
- 59. После трансляции дает белок – гормон щитовидной железы кальцитоцин мРНК После трансляции дает нейропептид головного мозга
- 60. Какова роль альтернативного сплайсинга в эволюции живого? К альтернативному сплайсингу начинают приглядываться эволюционисты Большая группа ученых
- 61. 20 мая 2010 года навсегда войдет в историю как день, в который было объявлено о создании
- 62. Альтернативная энергетика. В 2009 г. принадлежащая Крейгу Вентеру компания Synthetic Genomics Inc. и нефтегазовый гигант Exxon
- 63. Успехи в клонировании животных
- 64. Методика: пересадка ядер, взятых из соматических клеток, в яйцеклетку и внедрение ее в половые пути соответствующего
- 66. Затем появилась трансгенная Полли и ее сестры В геноме Полли содержится человеческий ген IX фактора свертываемости
- 67. 2002 – кролик 2003 – мул по имени «Драгоценный камень Айдахо» 2004 - гуар
- 68. 2003 – бентанг 2003 – белохвостый олень 2004 - коммерческое клонирование кота Маленький Никки
- 69. 2005 – собака - африканская борзая Снаппи 2005 – африканская кошка 2006 – хорьки Либби и
- 70. 2006 – индийский буйвол 2007 - собака 2008 - коммерческое клонирование собаки - лабрадора Чэйс. Начато
- 71. К настоящему времени клонированы и другие млекопитающие – корова, свинья, мышь, кошка, собака, мул, обезьяна
- 72. Аргентинские генетики вывели трансгенную корову, которая имеет ряд человеческих генов и дает молоко, идентичное материнскому благодаря
- 73. Корову, которая дает молоко, не вызывающее аллергию, вырастили ученые в Новой Зеландии Для выведения генно-модифицированной коровы
- 74. Трансгенные козы, живут в Жодино. Они стали настоящей сенсацией в белорусской науке.
- 75. Лактоферрин является уникальным и многофункциональным белком, который содержится в том числе в молоке. Для этого белка
- 76. Первые в мире фантастические обезьяны словно сошли со страниц научно-фантастического произведения. Обезьянки, созданные американскими исследователями, имеют
- 77. Клонированы светящиеся собаки Ученые из Южной Кореи клонировали четырех щенков породы Бигль, которые светятся в темноте
- 78. У трансгенной лягушки Xenopus laevis зеленым светятся только глаза www.uchc.edu/ dsp/plucky.htm Трансгенные светящиеся рыбки предназначены для
- 80. В Израиле изобрели курицу без перьев В скором времени нужда в ощипывании кур отпадет. Израильские ученые
- 81. Ноги вместо плавников – новый эксперимент генетиков Ученые не перестают экспериментировать на животных в поисках ответов
- 83. Скачать презентацию











































































 Physiological bases of hemo dynamic
Physiological bases of hemo dynamic Развитие органического мира
Развитие органического мира Презентация к уроку Класс птицы. Особенности строения связанные с полетом
Презентация к уроку Класс птицы. Особенности строения связанные с полетом Открытый урок по биологии 8 класс
Открытый урок по биологии 8 класс Бұршақтар, қалақайлар, шамшаттар тұқымдастарына сипаттама
Бұршақтар, қалақайлар, шамшаттар тұқымдастарына сипаттама Гигиена пищеварения. Предупреждение желудочно-кишечных заболеваний
Гигиена пищеварения. Предупреждение желудочно-кишечных заболеваний Приспособленность живых организмов к среде обитания
Приспособленность живых организмов к среде обитания Люпин белый. Особенности биологии и технологии возделывания
Люпин белый. Особенности биологии и технологии возделывания Донецкий ботанический сад— один из крупнейших ботанических садов Европы
Донецкий ботанический сад— один из крупнейших ботанических садов Европы Грунт для биологической очистки, для аквариумных растений, для естественной красоты
Грунт для биологической очистки, для аквариумных растений, для естественной красоты Живая природа осенью
Живая природа осенью Класс птицы
Класс птицы Мой домашний любимец
Мой домашний любимец Растительный и животный мир Раменского района
Растительный и животный мир Раменского района Анатомия и физиология женской половой системы
Анатомия и физиология женской половой системы Нормофлоры и пробиотики. Препараты на основе живых культур микроорганизмов. Культуры клеток и тканей растений
Нормофлоры и пробиотики. Препараты на основе живых культур микроорганизмов. Культуры клеток и тканей растений Цветок. Строение и функции цветка и его частей
Цветок. Строение и функции цветка и его частей Органические и неорганические вещества, входящие в состав клетки. Нуклеиновые кислоты и их роль в клетке
Органические и неорганические вещества, входящие в состав клетки. Нуклеиновые кислоты и их роль в клетке План-конспект урока по биологии
План-конспект урока по биологии Кость как орган
Кость как орган Изучение жизни муравьев-жнецов в условиях домашнего формикария
Изучение жизни муравьев-жнецов в условиях домашнего формикария Презентация к уроку биологии 5 класс Зачем живые организмы запасают питательные вещества?
Презентация к уроку биологии 5 класс Зачем живые организмы запасают питательные вещества? Закрепление материала по биологии для 5-ого класса
Закрепление материала по биологии для 5-ого класса Роль воды в жизни растений. Проращивание семян
Роль воды в жизни растений. Проращивание семян Фотосинтез
Фотосинтез Разнообразие земноводных
Разнообразие земноводных Влияние никотина, алкоголя и наркотических веществ на развитие зародыша человека
Влияние никотина, алкоголя и наркотических веществ на развитие зародыша человека Остеология, часть 1. Лекция 2
Остеология, часть 1. Лекция 2