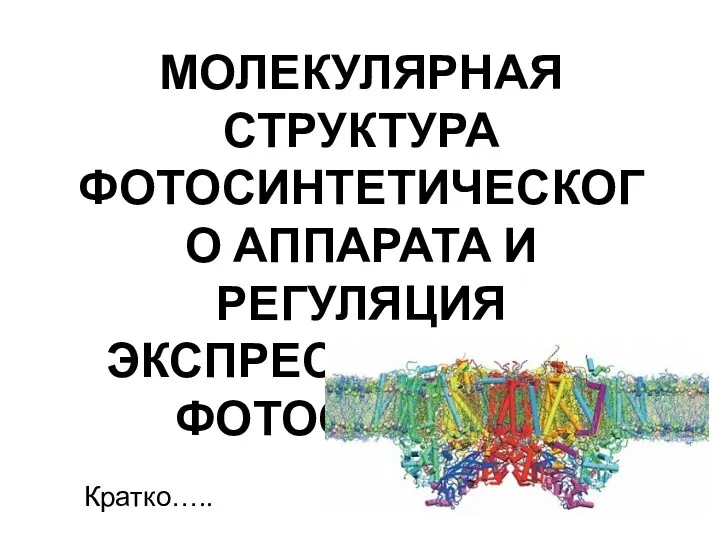
Молекулярная структура фотосинтетического аппарата и регуляция экспрессии генов фотосинтеза презентация
Содержание
- 2. План лекции: 1. Молекулярная структура фотосинтетического аппарата. Регуляция экспрессии генов фотосинтеза 2. Процессы анаболизма в клетках
- 3. МОЛЕКУЛЯРНАЯ СТРУКТУРА ФОТОСИНТЕТИЧЕСКОГО АППАРАТА И РЕГУЛЯЦИЯ ЭКСПРЕССИИ ГЕНОВ ФОТОСИНТЕЗА Кратко…..
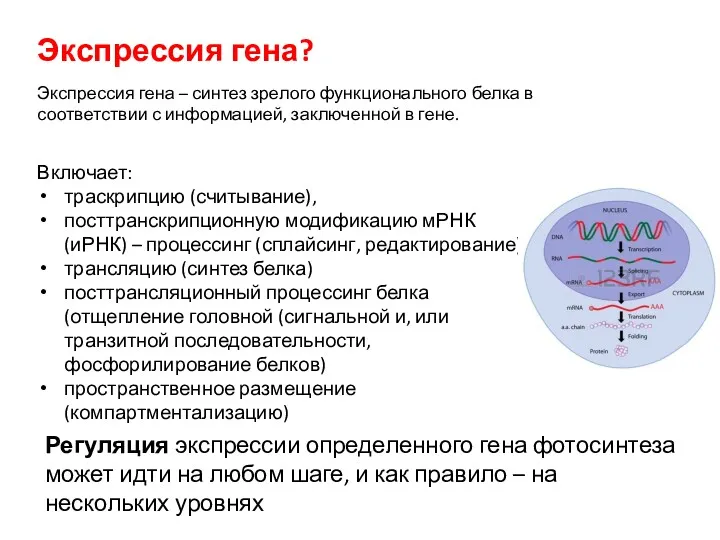
- 4. Включает: траскрипцию (считывание), посттранскрипционную модификацию мРНК (иРНК) – процессинг (сплайсинг, редактирование) трансляцию (синтез белка) посттрансляционный процессинг
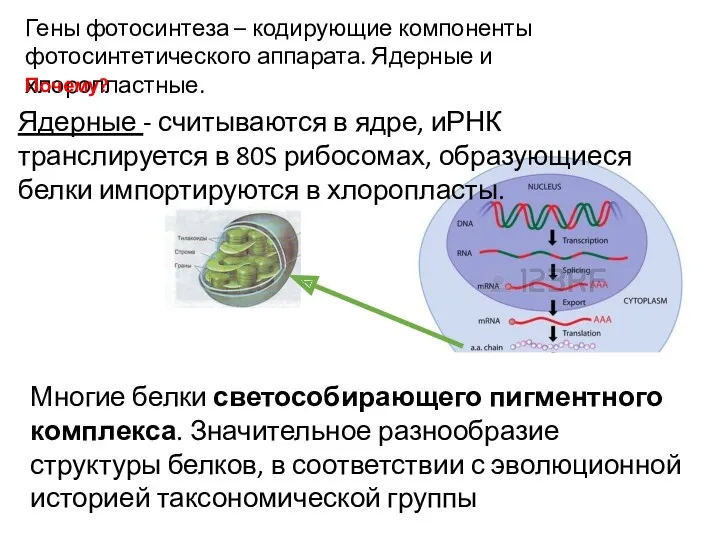
- 5. Гены фотосинтеза – кодирующие компоненты фотосинтетического аппарата. Ядерные и хлоропластные. Ядерные - считываются в ядре, иРНК
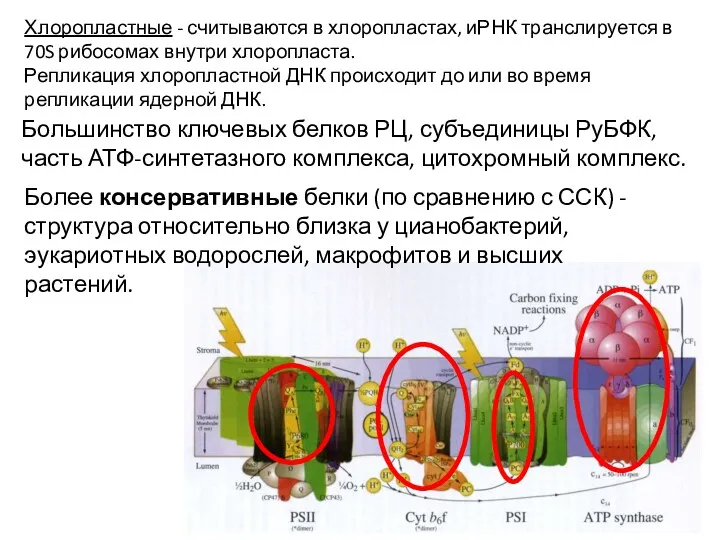
- 6. Большинство ключевых белков РЦ, субъединицы РуБФК, часть АТФ-синтетазного комплекса, цитохромный комплекс. Хлоропластные - считываются в хлоропластах,
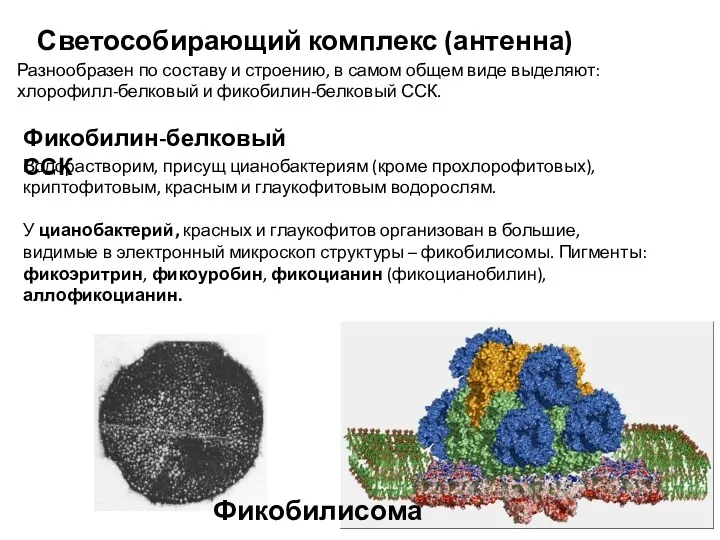
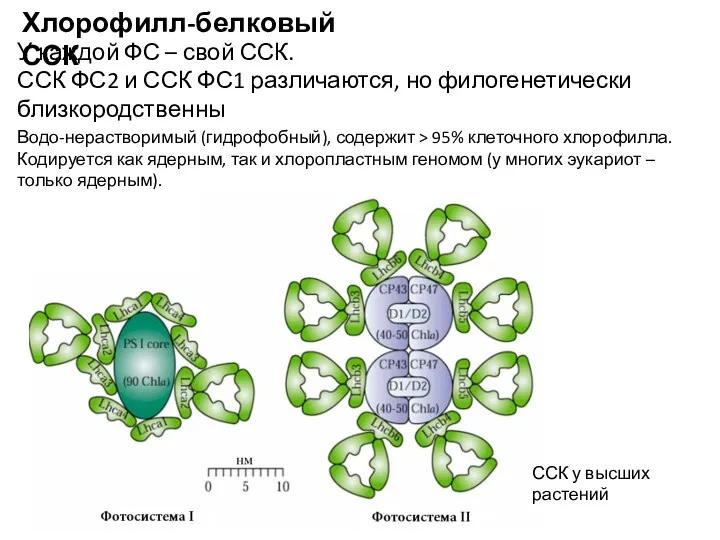
- 7. Светособирающий комплекс (антенна) Разнообразен по составу и строению, в самом общем виде выделяют: хлорофилл-белковый и фикобилин-белковый
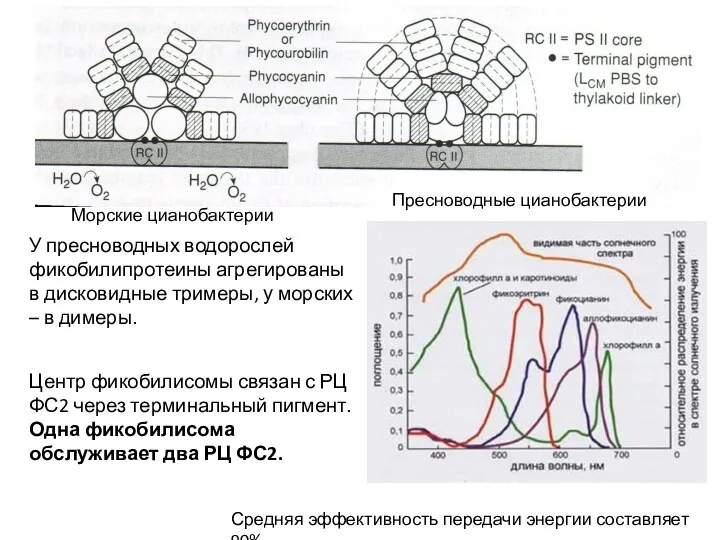
- 8. Пресноводные цианобактерии Морские цианобактерии У пресноводных водорослей фикобилипротеины агрегированы в дисковидные тримеры, у морских – в
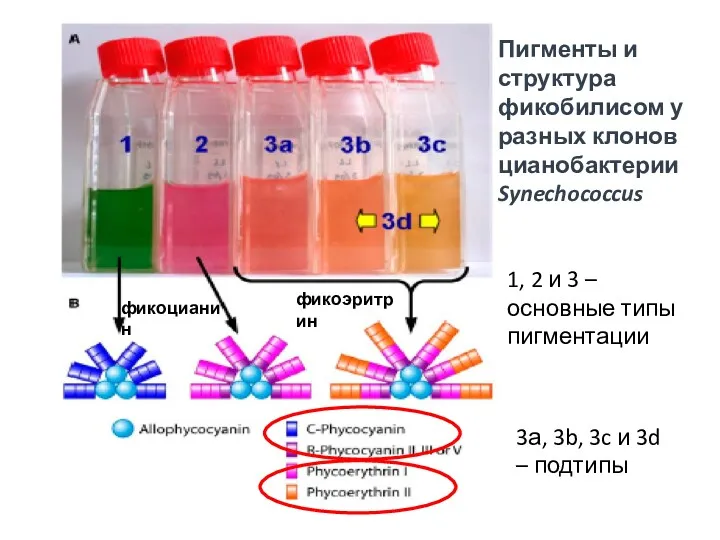
- 9. Пигменты и структура фикобилисом у разных клонов цианобактерии Synechococcus 1, 2 и 3 – основные типы
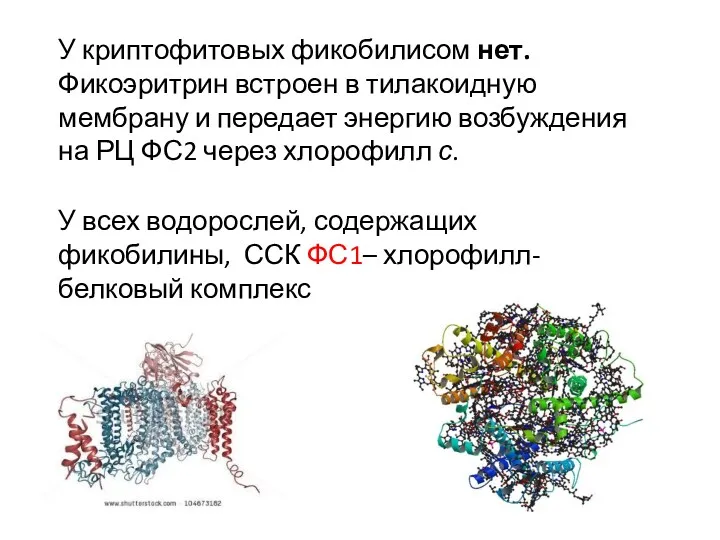
- 10. У всех водорослей, содержащих фикобилины, ССК ФС1– хлорофилл-белковый комплекс У криптофитовых фикобилисом нет. Фикоэритрин встроен в
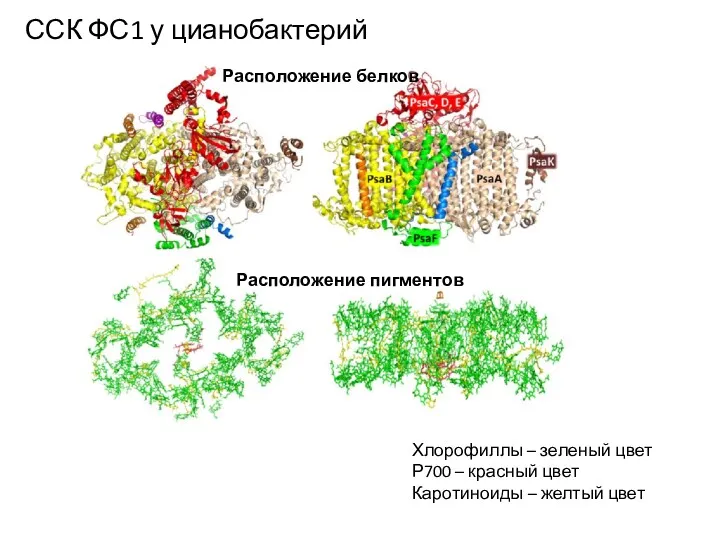
- 11. ССК ФС1 у цианобактерий Расположение белков Расположение пигментов Хлорофиллы – зеленый цвет Р700 – красный цвет
- 12. Водо-нерастворимый (гидрофобный), содержит > 95% клеточного хлорофилла. Кодируется как ядерным, так и хлоропластным геномом (у многих
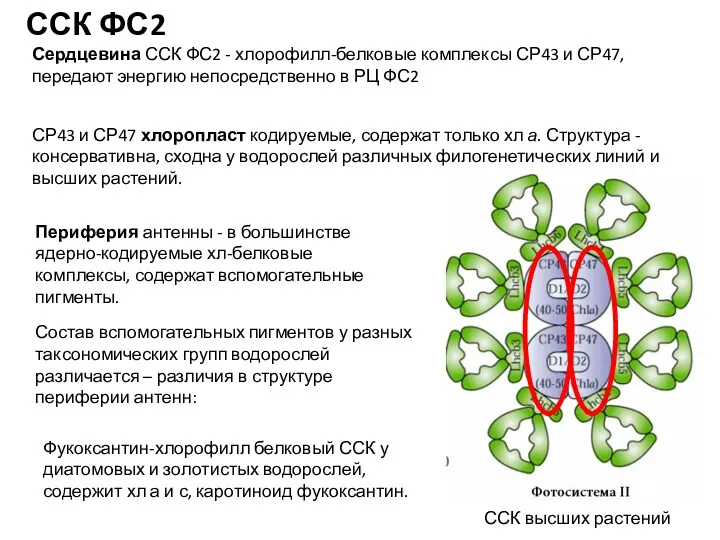
- 13. Сердцевина ССК ФС2 - хлорофилл-белковые комплексы СР43 и СР47, передают энергию непосредственно в РЦ ФС2 Периферия
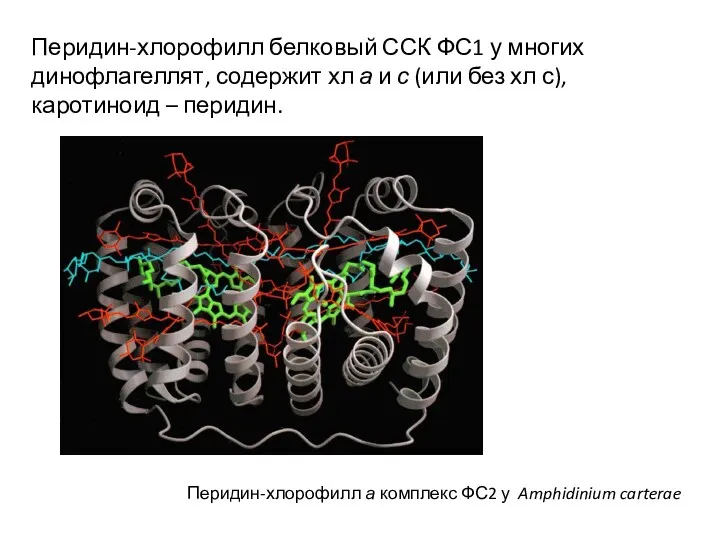
- 14. Перидин-хлорофилл а комплекс ФС2 у Amphidinium carterae Перидин-хлорофилл белковый ССК ФС1 у многих динофлагеллят, содержит хл
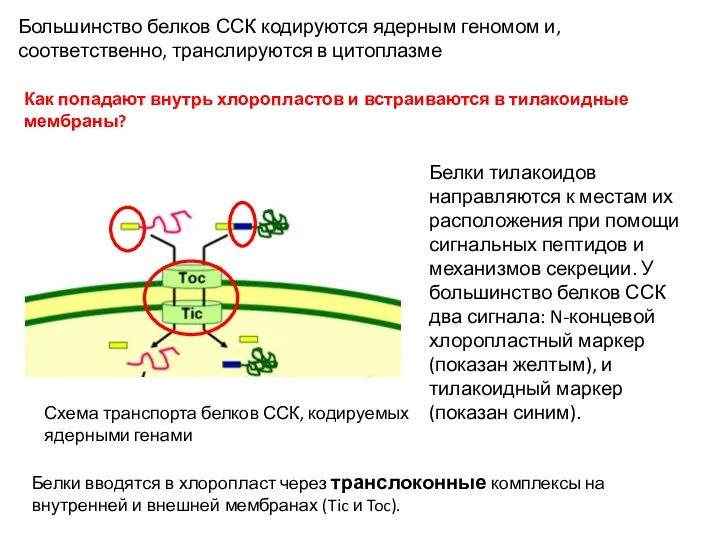
- 15. Белки тилакоидов направляются к местам их расположения при помощи сигнальных пептидов и механизмов секреции. У большинство
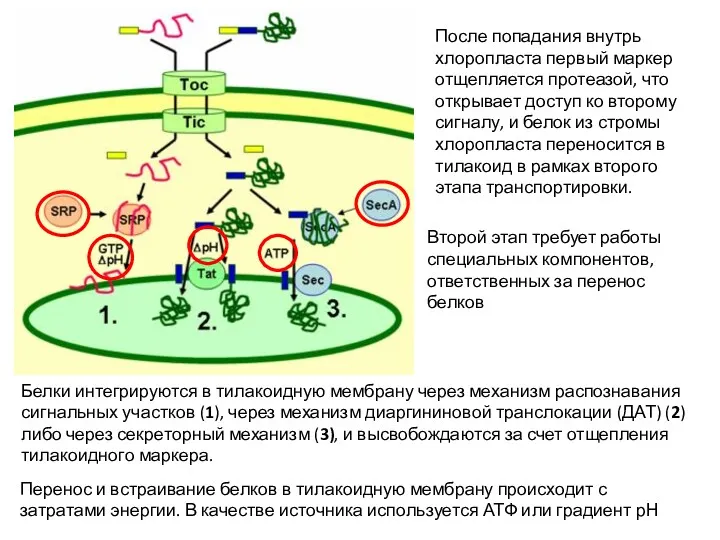
- 16. После попадания внутрь хлоропласта первый маркер отщепляется протеазой, что открывает доступ ко второму сигналу, и белок
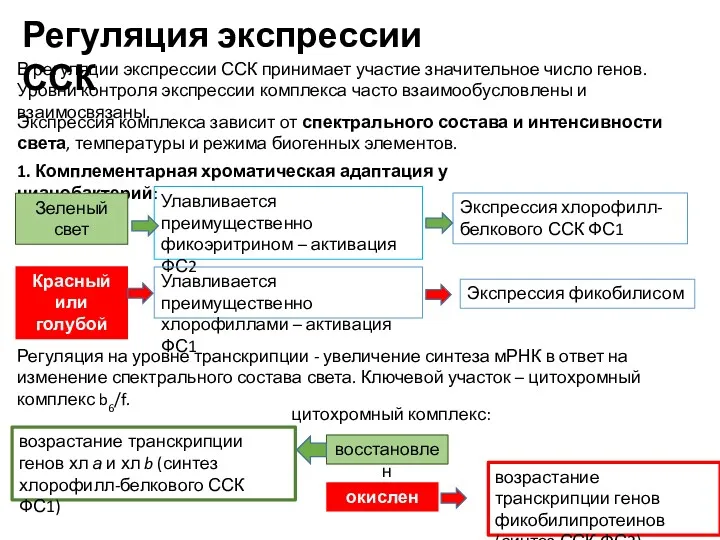
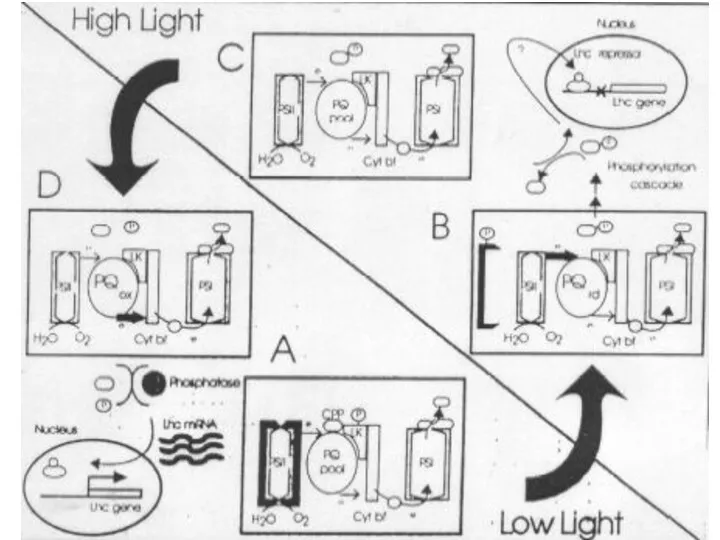
- 17. В регуляции экспрессии ССК принимает участие значительное число генов. Уровни контроля экспрессии комплекса часто взаимообусловлены и
- 18. Регуляция экспрессии ССК блокирование транскрипции генов ССК ФС2 и ФС1 Пул пластохинонов: восстановлен окислен возрастание транскрипции
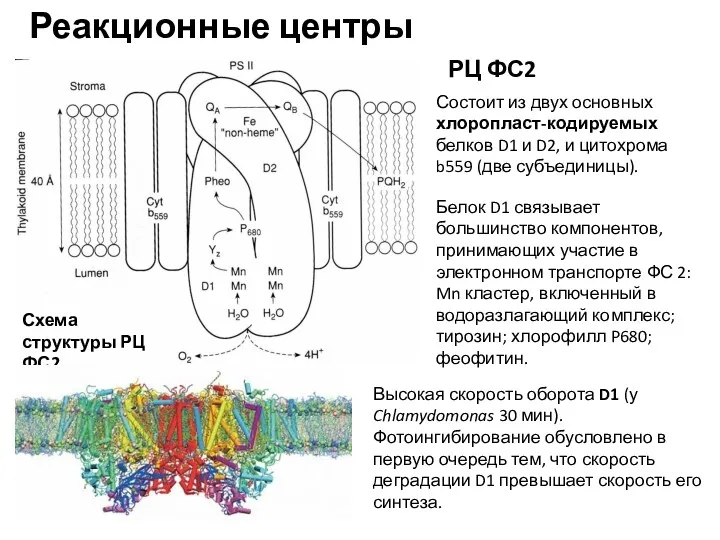
- 19. Реакционные центры Схема структуры РЦ ФС2 Белок D1 связывает большинство компонентов, принимающих участие в электронном транспорте
- 20. Структура D1 консервативна - от цианобактерий до высших растений последовательность аминокислот совпадает примерно на 85%. Консервативность
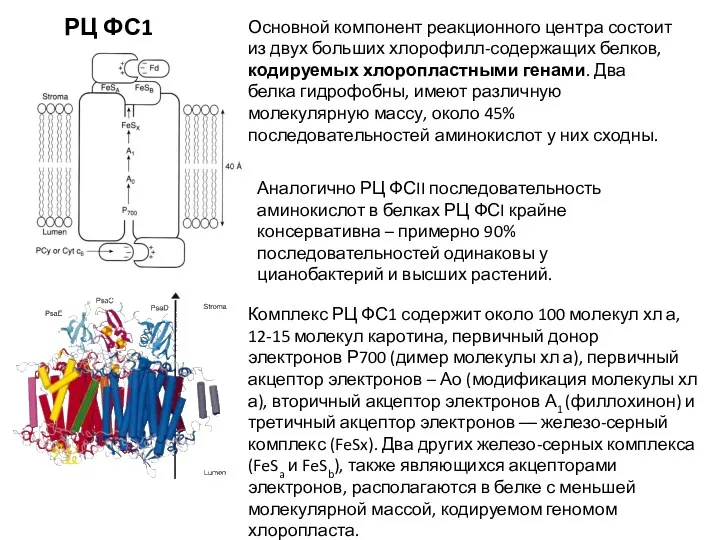
- 21. РЦ ФС1 Комплекс РЦ ФС1 содержит около 100 молекул хл а, 12-15 молекул каротина, первичный донор
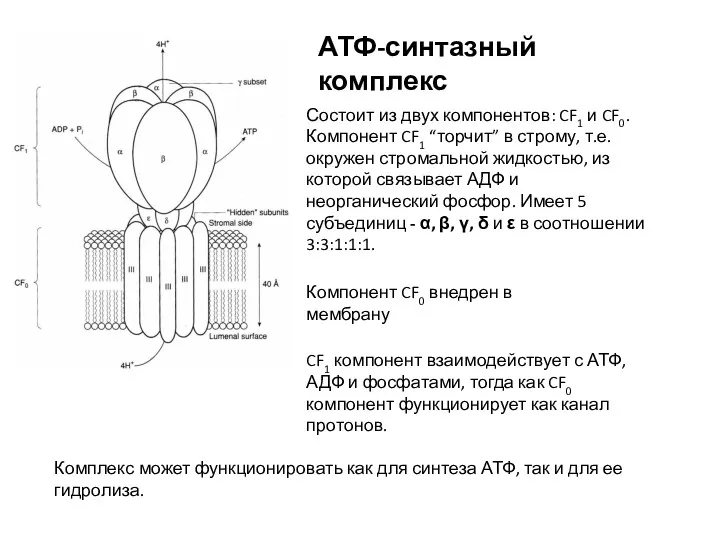
- 22. АТФ-синтазный комплекс Состоит из двух компонентов: CF1 и CF0. Компонент CF1 “торчит” в строму, т.е. окружен
- 23. У гетероконтовых и красных водорослей все субъединицы комплекса (кроме одной субъединицы компонента CF1) кодированы в хлоропластах.
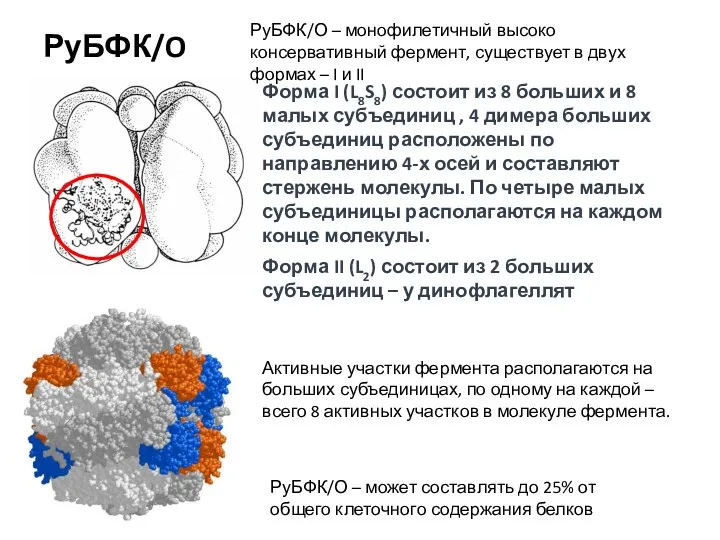
- 24. РуБФК/O РуБФК/О – монофилетичный высоко консервативный фермент, существует в двух формах – I и II Форма
- 25. По тому, каким геномом кодируются субъединицы РуБФК/О, форму I делят на B и D группы (зеленый
- 26. У всех эукариот - пост-трансляционная модификация конфигурации молекулы. Добавление небольшой молекулы “структуро-формирующего” белка. Синтез самого “структуро-формирующего”
- 27. А как ядро «узнает», что необходима экспрессия/репрессия генов ССК? Передача сигнала из хлоропластов к ядру осуществляется
- 29. ПРОЦЕССЫ АНАБОЛИЗМА В КЛЕТКАХ ВОДОРОСЛЕЙ. ТЕМНОВОЕ ДЫХАНИЕ Темновое дыхание – независимое от света выделение СО2. Включает
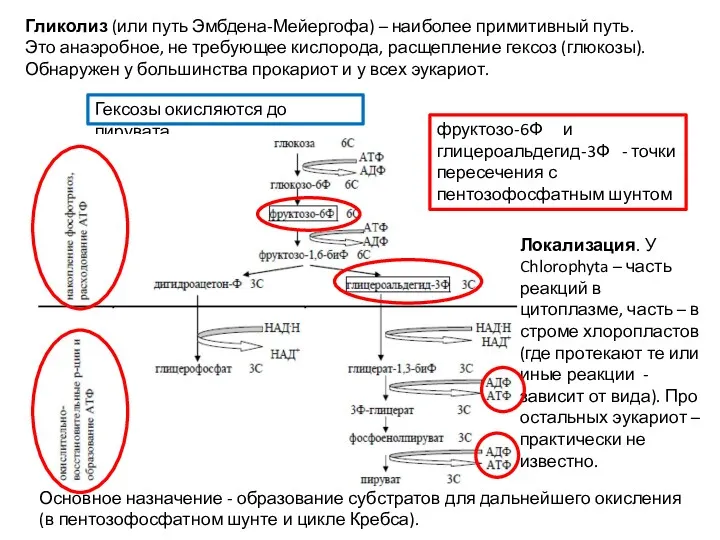
- 30. Гликолиз (или путь Эмбдена-Мейергофа) – наиболее примитивный путь. Это анаэробное, не требующее кислорода, расщепление гексоз (глюкозы).
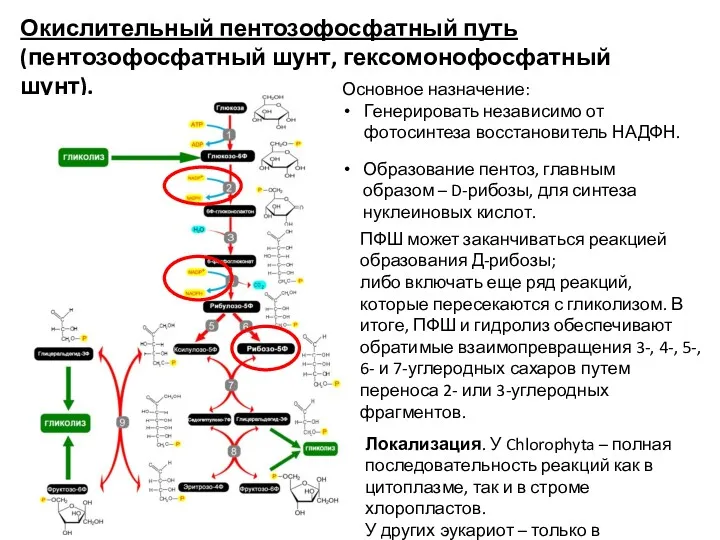
- 31. Окислительный пентозофосфатный путь (пентозофосфатный шунт, гексомонофосфатный шунт). Основное назначение: Генерировать независимо от фотосинтеза восстановитель НАДФН. Образование
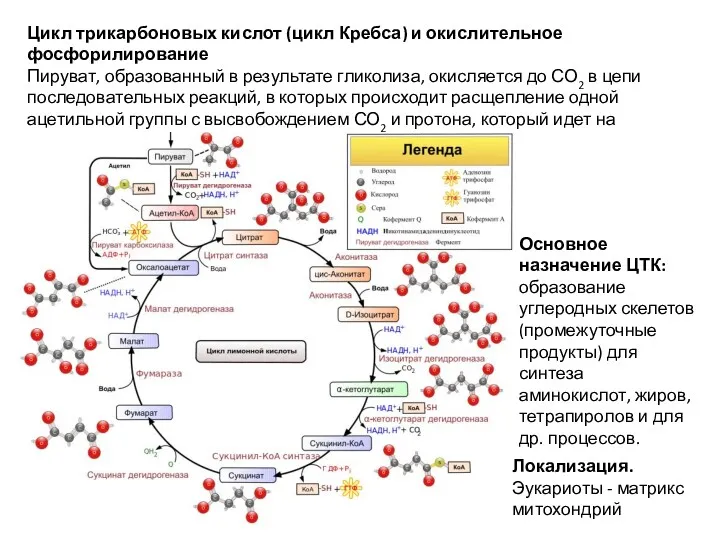
- 32. Цикл трикарбоновых кислот (цикл Кребса) и окислительное фосфорилирование Пируват, образованный в результате гликолиза, окисляется до СО2
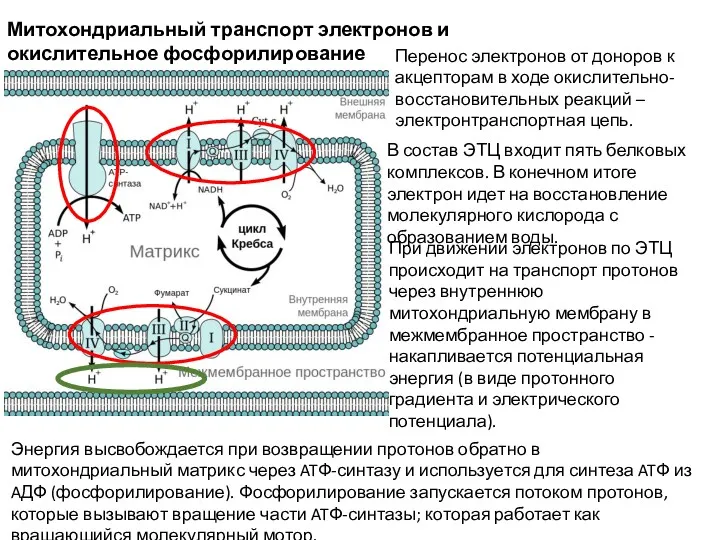
- 33. Митохондриальный транспорт электронов и окислительное фосфорилирование Перенос электронов от доноров к акцепторам в ходе окислительно-восстановительных реакций
- 34. Альтернативный путь митохондриального транспорта электронов Перенос электронов с комплекса II непосредственно на кислород. При этом по
- 35. Анаплеротические реакции Норма: концентрация промежуточных соединений цикла трикарбоновых кислот поддерживается постоянной. Т.е. реакции, за счет которых
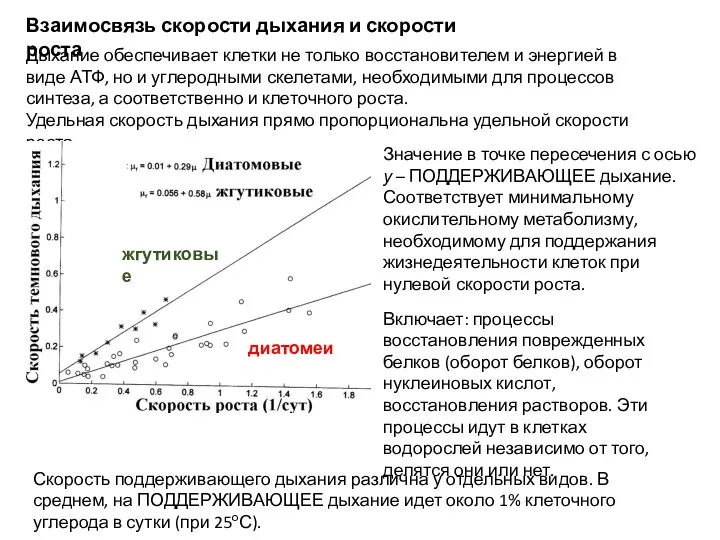
- 36. Взаимосвязь скорости дыхания и скорости роста Дыхание обеспечивает клетки не только восстановителем и энергией в виде
- 37. Зависимость дыхания от размеров клеток водорослей R = a W (b), где R – удельная скорость
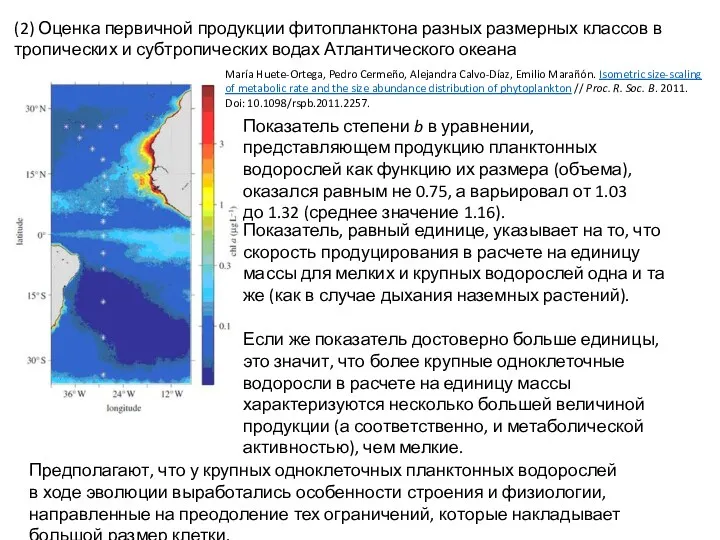
- 38. НО! Возможно, сегодняшнее представление о том, что в мире водорослей правило «¾» работает, будет пересмотрено. (1)
- 39. Показатель степени b в уравнении, представляющем продукцию планктонных водорослей как функцию их размера (объема), оказался равным
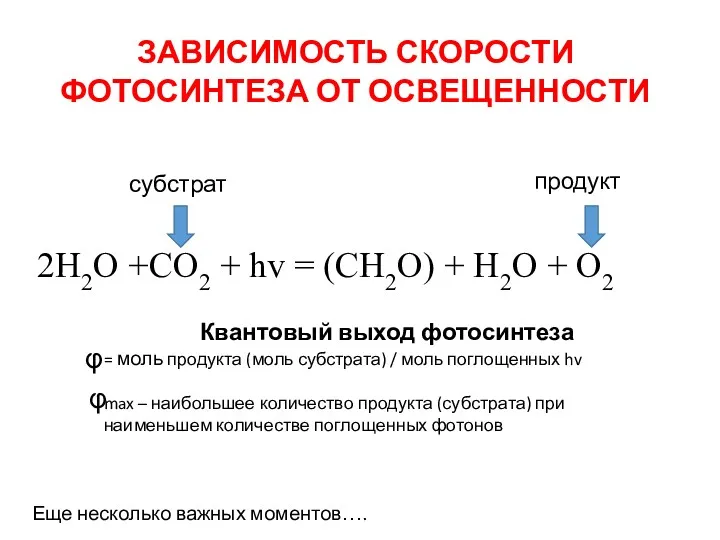
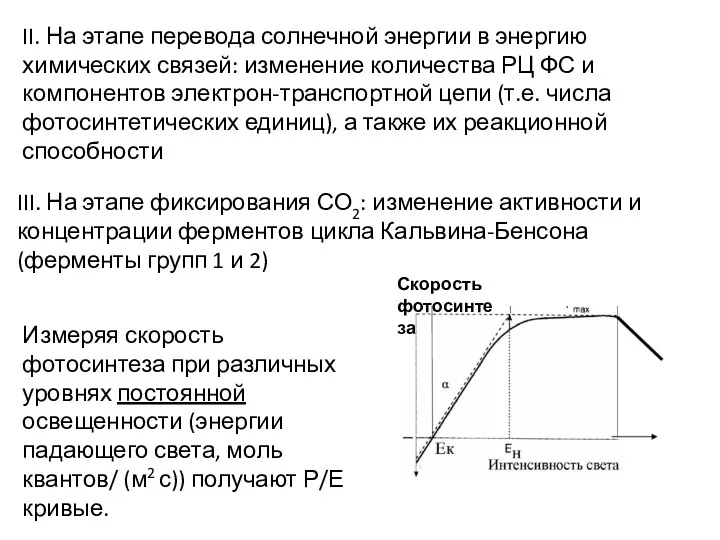
- 40. ЗАВИСИМОСТЬ СКОРОСТИ ФОТОСИНТЕЗА ОТ ОСВЕЩЕННОСТИ φ 2H2O +CO2 + hv = (CH2O) + H2O + O2
- 41. Фосфорилирование – включение в молекулу белка остатка фосфорной кислоты (Н2РО3-). Ферментируется киназами (фосфотрансферазами). Дефосфорилирование – отщепление
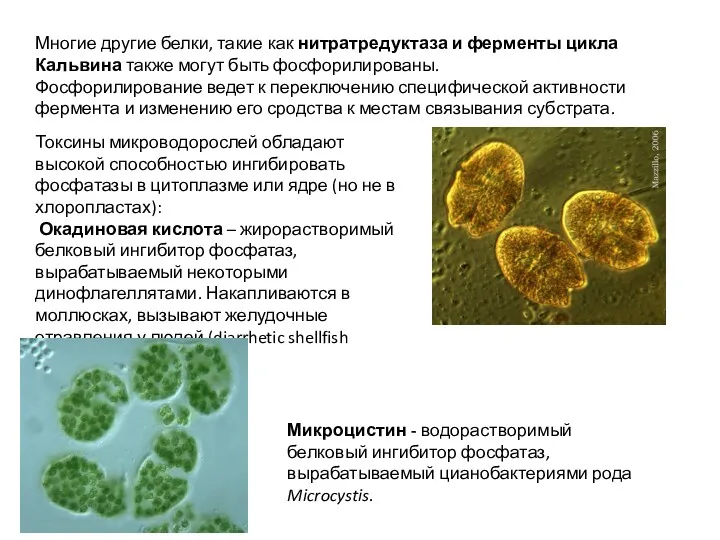
- 42. Многие другие белки, такие как нитратредуктаза и ферменты цикла Кальвина также могут быть фосфорилированы. Фосфорилирование ведет
- 43. ЗАВИСИМОСТЬ СКОРОСТИ ФОТОСИНТЕЗА ОТ ОСВЕЩЕННОСТИ (а) изменение способности улавливать световую энергию (размер антенны - количество молекул
- 44. II. На этапе перевода солнечной энергии в энергию химических связей: изменение количества РЦ ФС и компонентов
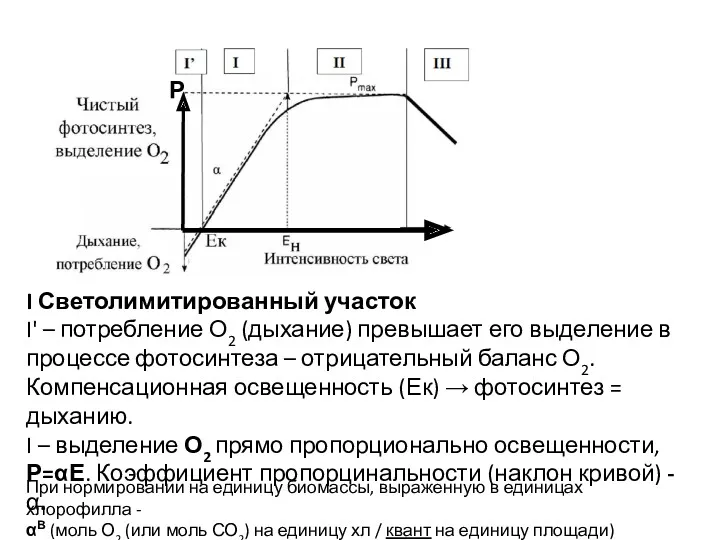
- 45. I Светолимитированный участок I' – потребление О2 (дыхание) превышает его выделение в процессе фотосинтеза – отрицательный
- 46. В ситуациях, когда практически весь падающей свет поглощается (листья высших растений, пластины макрофитов, плотные суспензии водорослей)
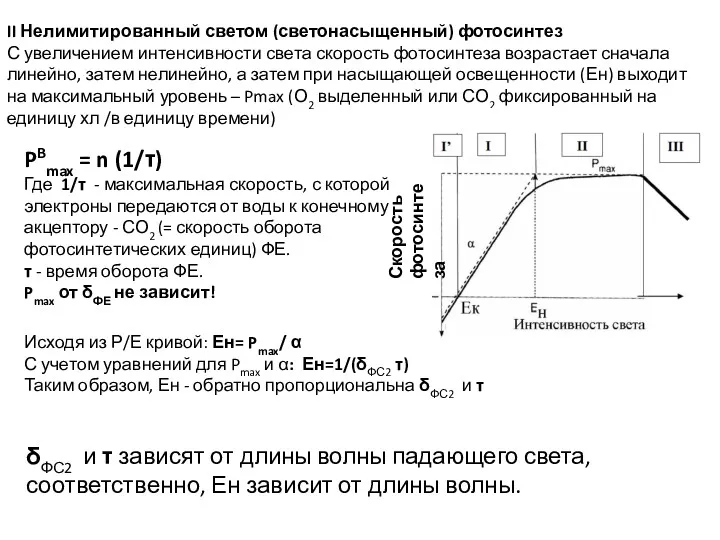
- 47. II Нелимитированный светом (светонасыщенный) фотосинтез С увеличением интенсивности света скорость фотосинтеза возрастает сначала линейно, затем нелинейно,
- 48. При насыщающей интенсивности света скорость поглощения фотонов превышает скорость транспорта электронов от воды к СО2. Ен
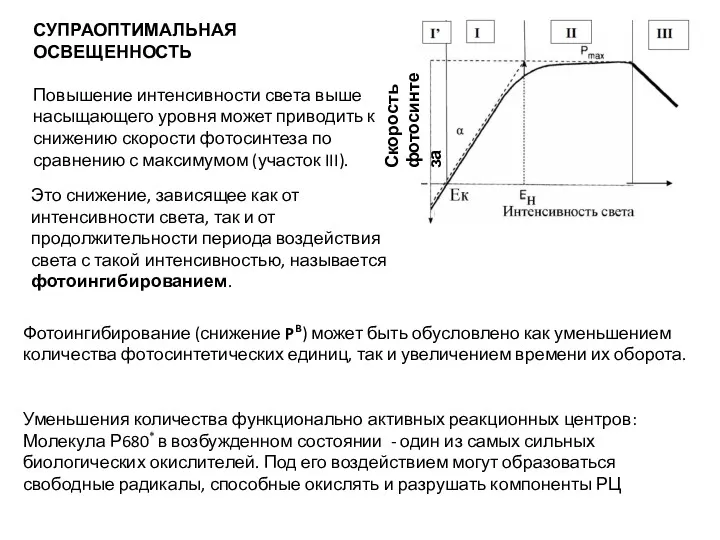
- 49. СУПРАОПТИМАЛЬНАЯ ОСВЕЩЕННОСТЬ Повышение интенсивности света выше насыщающего уровня может приводить к снижению скорости фотосинтеза по сравнению
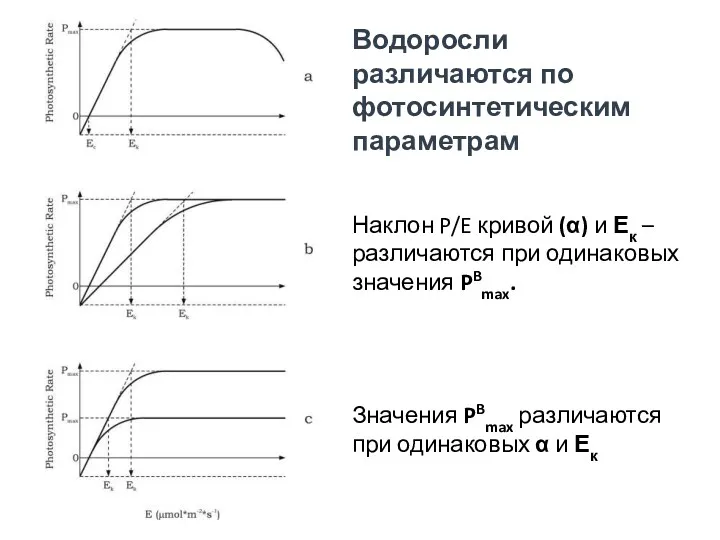
- 50. Водоросли различаются по фотосинтетическим параметрам Наклон P/E кривой (α) и Ек – различаются при одинаковых значения
- 51. Регуляция – изменения в каталитической или энергетической эффективности определенных процессов. Изменения эффективности идут не за счет
- 52. AФЭТ - активность электрон транспортной цепи, мкмоль электрон/ (г C) сек; Аhv - удельная (на единицу
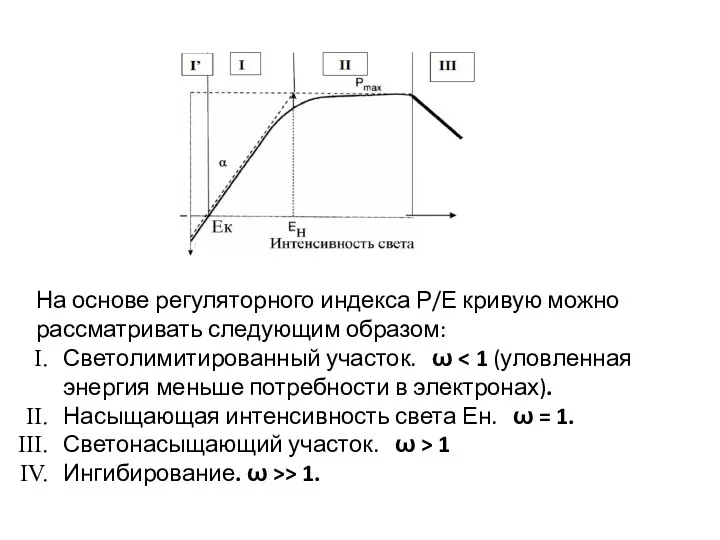
- 53. На основе регуляторного индекса Р/Е кривую можно рассматривать следующим образом: Светолимитированный участок. ω Насыщающая интенсивность света
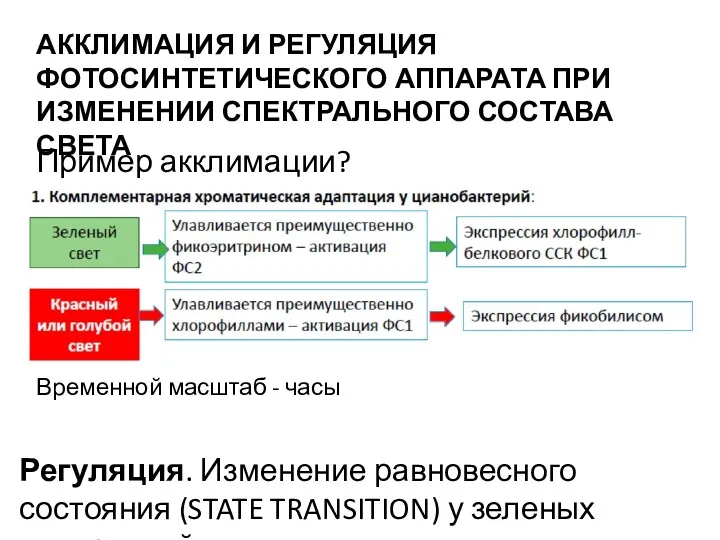
- 54. АККЛИМАЦИЯ И РЕГУЛЯЦИЯ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА ПРИ ИЗМЕНЕНИИ СПЕКТРАЛЬНОГО СОСТАВА СВЕТА Пример акклимации? Регуляция. Изменение равновесного состояния
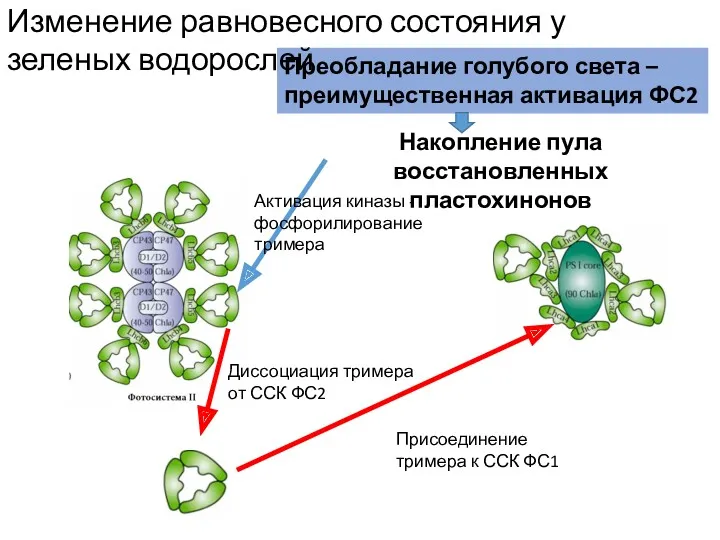
- 55. Накопление пула восстановленных пластохинонов Активация киназы - фосфорилирование тримера Диссоциация тримера от ССК ФС2 Преобладание голубого
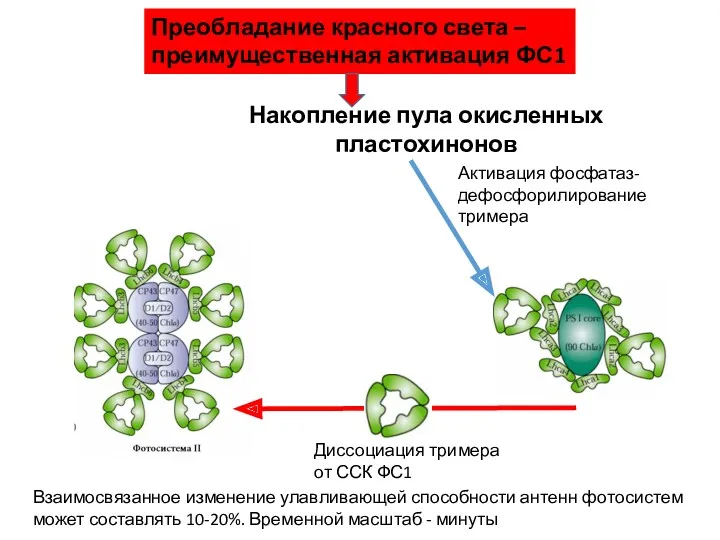
- 56. Накопление пула окисленных пластохинонов Активация фосфатаз- дефосфорилирование тримера Диссоциация тримера от ССК ФС1 Преобладание красного света
- 57. АККЛИМАЦИЯ И РЕГУЛЯЦИЯ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА ПРИ ИЗМЕНЕНИИ ИНТЕНСИВНОСТИ СВЕТА E0 - оптимальные δ и число фотосинтетических
- 59. Скачать презентацию



















 Экологические группы млекопитающих
Экологические группы млекопитающих Микрооргнаизмдерді дақылдауға арналған қоректік орталар, қоректік орталарды залалсыздандыру әдістері
Микрооргнаизмдерді дақылдауға арналған қоректік орталар, қоректік орталарды залалсыздандыру әдістері Семечки: вред или польза
Семечки: вред или польза Жер бетінде тіршіліктің пайда болуы
Жер бетінде тіршіліктің пайда болуы Интересные факты о водорослях
Интересные факты о водорослях Многообразие природы родного края. Краснодарский край
Многообразие природы родного края. Краснодарский край Дыхательная система. Органы дыхания
Дыхательная система. Органы дыхания Флотационды қондырғылар. Флокулянттар және коагулянттар
Флотационды қондырғылар. Флокулянттар және коагулянттар Влияние человека на животных
Влияние человека на животных Класс земноводные. Внутреннее строение
Класс земноводные. Внутреннее строение Нехромосомные генетические элементы
Нехромосомные генетические элементы Дикие животные
Дикие животные Хрящова та кісткова тканини
Хрящова та кісткова тканини Биогеоценоз. Структурные компоненты биогеоценоза. Процессы, происходящие в биогеоценозе
Биогеоценоз. Структурные компоненты биогеоценоза. Процессы, происходящие в биогеоценозе Семенные растения. Характеристика отделов голосеменные и покрытосеменные
Семенные растения. Характеристика отделов голосеменные и покрытосеменные Антропосоциогенез
Антропосоциогенез Цветы. Уход за цветами
Цветы. Уход за цветами Применение метода проектов во внеурочной деятельности
Применение метода проектов во внеурочной деятельности Автономная нервная система
Автономная нервная система Безусловные и условные рефлексы
Безусловные и условные рефлексы Дятлы
Дятлы Животные и растения Самарской области, занесенные в Красную книгу России
Животные и растения Самарской области, занесенные в Красную книгу России Как переносятся семена растений
Как переносятся семена растений Отдел голосеменных (или Pinophyta)
Отдел голосеменных (или Pinophyta) Анатомія і фізіологія жіночої статевої системи
Анатомія і фізіологія жіночої статевої системи Биокомпьютер
Биокомпьютер Тяжёлые металлы. Главный источник поступления тяжелых металлов
Тяжёлые металлы. Главный источник поступления тяжелых металлов Строение и физико-химические свойства белков
Строение и физико-химические свойства белков