Содержание
- 2. Gerardus Johannes Mulder 1835 г открыты белки 1838 г Jöns Jacob Berzelius ввел термин protéine prôtos
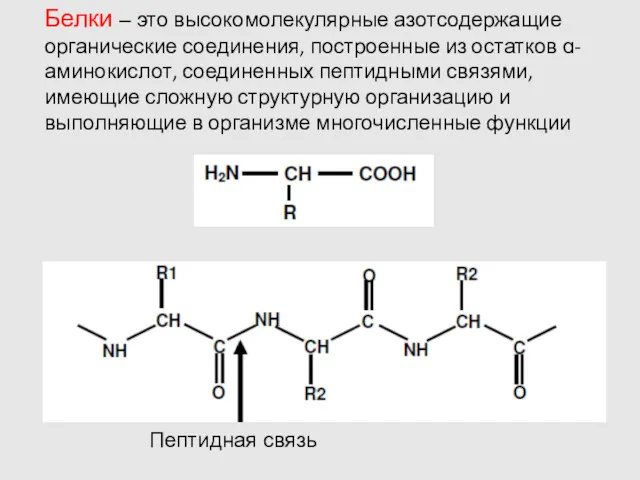
- 3. Пептидная связь Белки – это высокомолекулярные азотсодержащие органические соединения, построенные из остатков ɑ-аминокислот, соединенных пептидными связями,
- 4. Функции белков Структурная (белки мембран) Каталитическая (пепсин, амилаза, каталаза и др.) Транспортная (гемоглобин, трансферрин и др.)
- 5. Особенности белков Бесконечное разнообразие структуры и высокая видовая специфичность. Динамическая структура молекулы. 3. Способность изменять конформацию
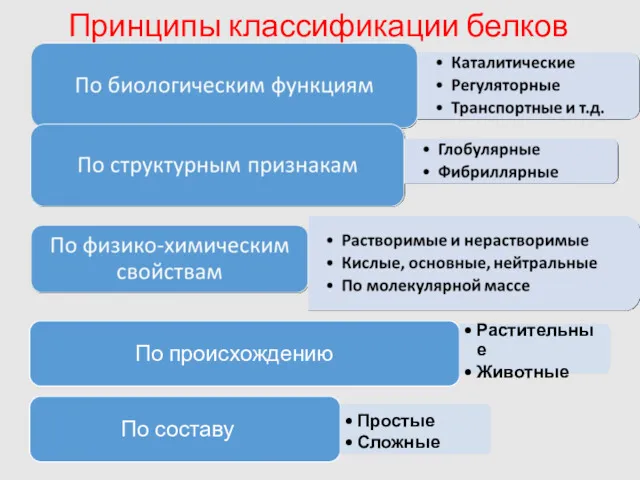
- 6. Принципы классификации белков
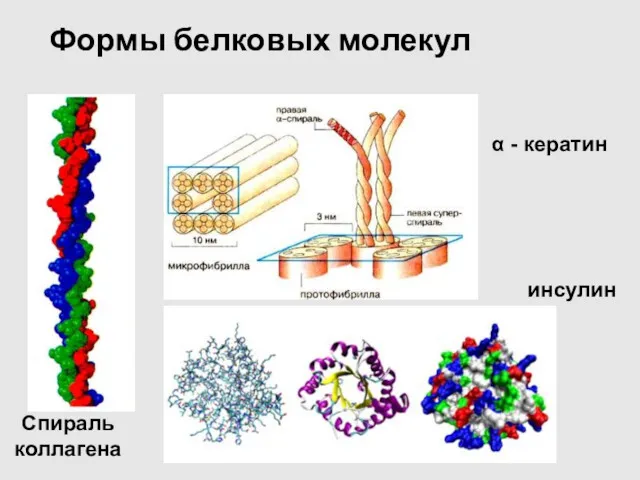
- 7. Формы белковых молекул Спираль коллагена α - кератин инсулин
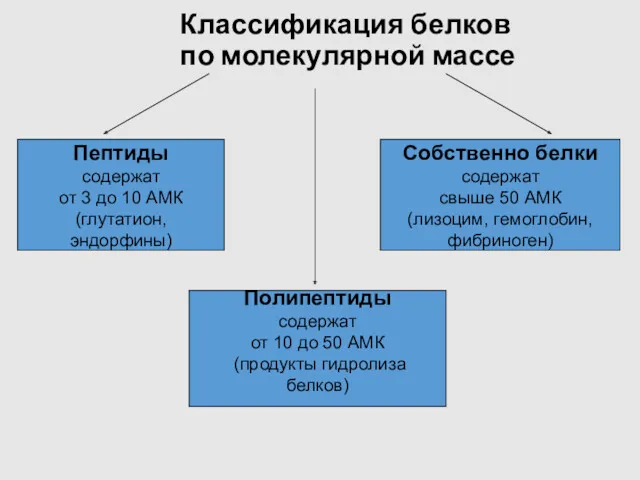
- 8. Классификация белков по молекулярной массе Пептиды содержат от 3 до 10 АМК (глутатион, эндорфины) Полипептиды содержат
- 9. Структуры белковых молекул Каждый белок имеет биологически активную струтуру, нативную структуру (конформацию) Нативная структура белка –
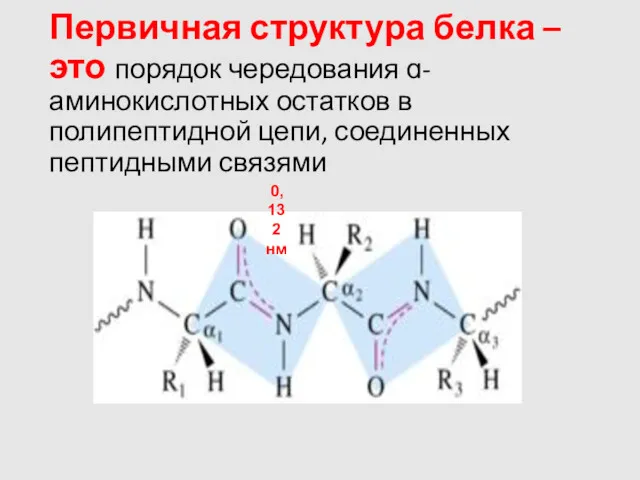
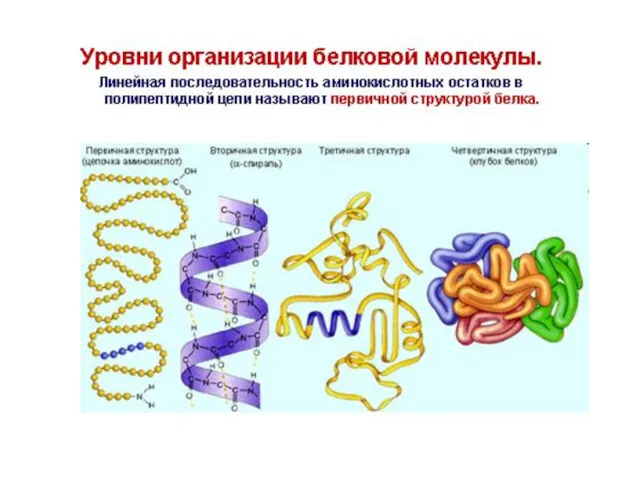
- 10. Первичная структура белка – это порядок чередования ɑ-аминокислотных остатков в полипептидной цепи, соединенных пептидными связями 0,132
- 11. Яичный белок Биуретовая реакция
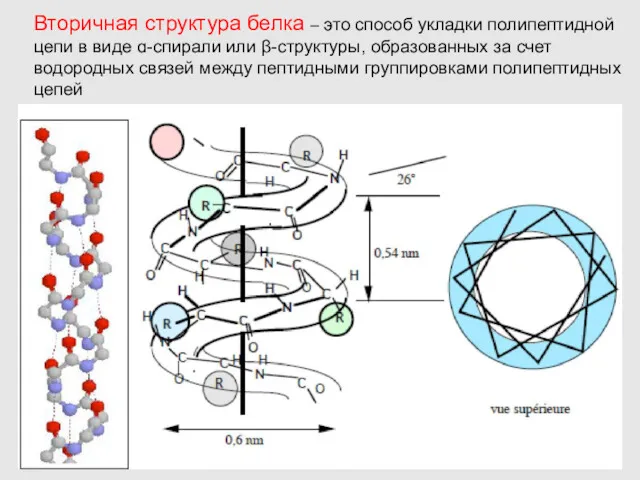
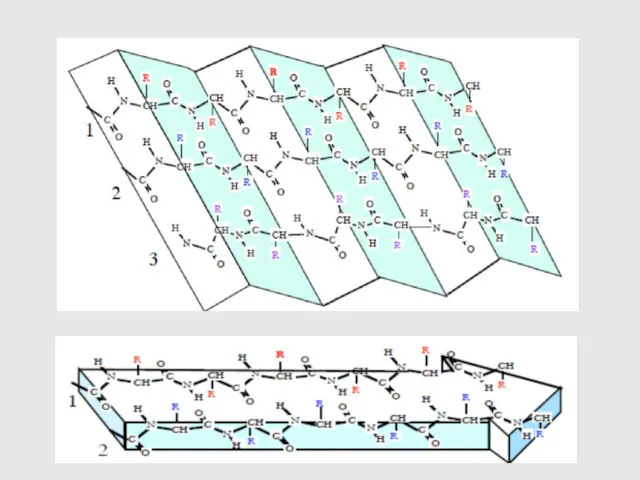
- 12. Вторичная структура белка – это способ укладки полипептидной цепи в виде ɑ-спирали или β-структуры, образованных за
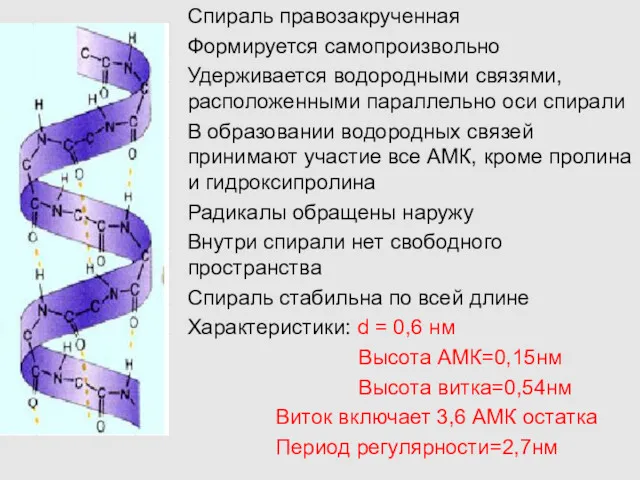
- 13. Спираль правозакрученная Формируется самопроизвольно Удерживается водородными связями, расположенными параллельно оси спирали В образовании водородных связей принимают
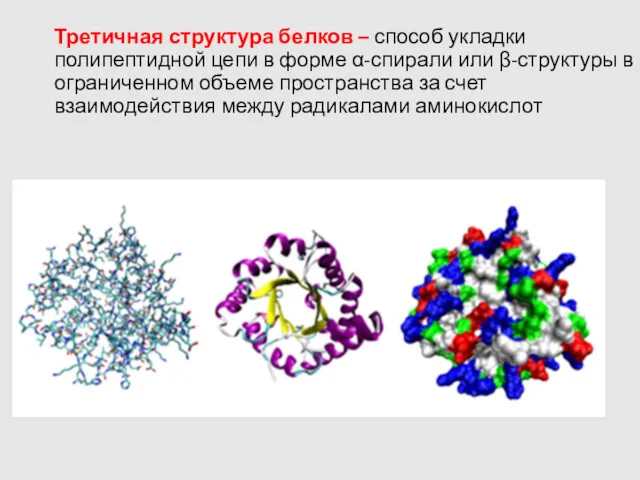
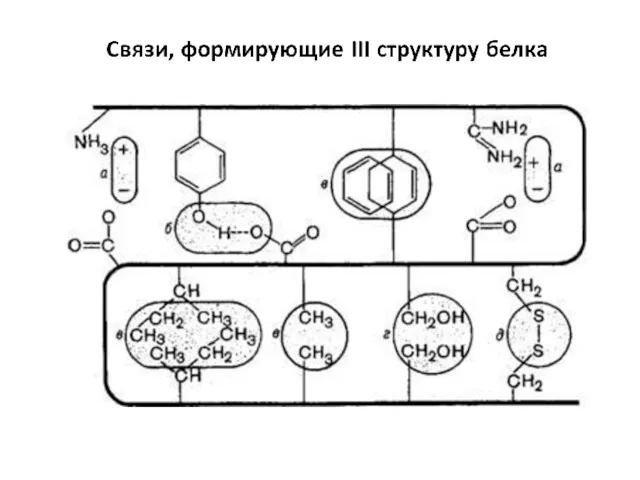
- 15. Третичная структура белков – способ укладки полипептидной цепи в форме α-спирали или β-структуры в ограниченном объеме
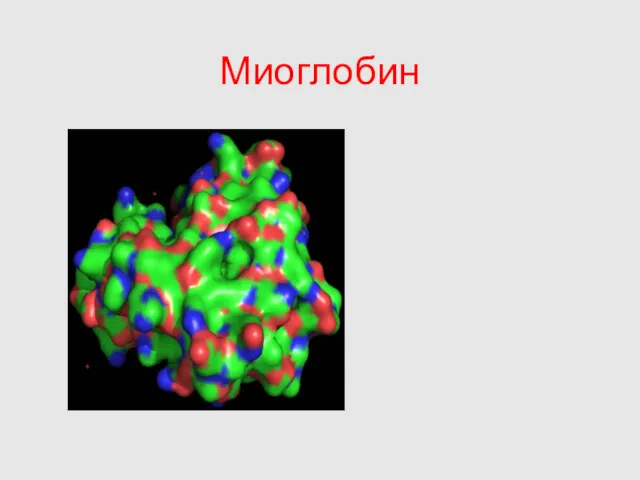
- 17. Миоглобин
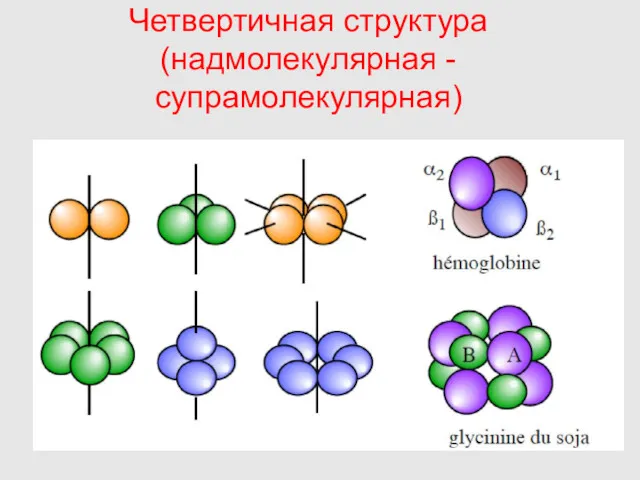
- 18. Четвертичная структура белка – это способ укладки нескольких полипептидных цепей, каждая из которых имеет третичную структуру
- 19. Четвертичная структура (надмолекулярная - супрамолекулярная)
- 21. Формирование нативной структуры белка обеспечивают молекулярные шапероны Белки шапероны были открыты Артуром Горовицем (Arthur Horwich, Yale,
- 22. Основные физико-химические свойства белков Гидрофильность и растворимость Кислотно-основные свойства, буферные свойства Осаждение белков (высаливание и денатурация)
- 23. Физико- химические свойства Растворимость – это способность белка равномерно располагаться (распространяться) между молекулами растворителя. Белки формируют
- 24. Гидрофильные группы в молекуле белка Полярные (не ионогенные) группы: - ОН (сер, тре, тир) SН (цис),
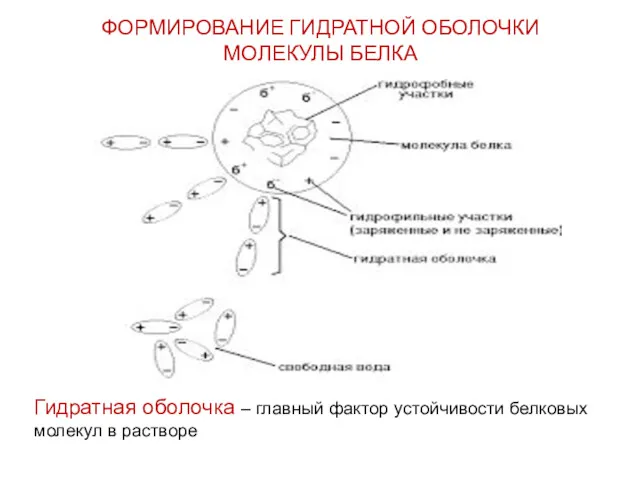
- 25. ФОРМИРОВАНИЕ ГИДРАТНОЙ ОБОЛОЧКИ МОЛЕКУЛЫ БЕЛКА Гидратная оболочка – главный фактор устойчивости белковых молекул в растворе
- 26. Состояние белковых молекул в водном растворе Гидратная оболочка (главный фактор устойчивости белковых молекул в растворе) предотвращает
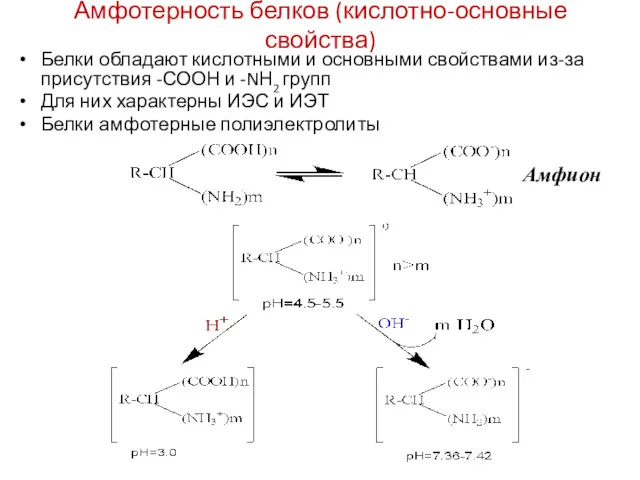
- 27. Амфотерность белков (кислотно-основные свойства) Белки обладают кислотными и основными свойствами из-за присутствия -СООН и -NН2 групп
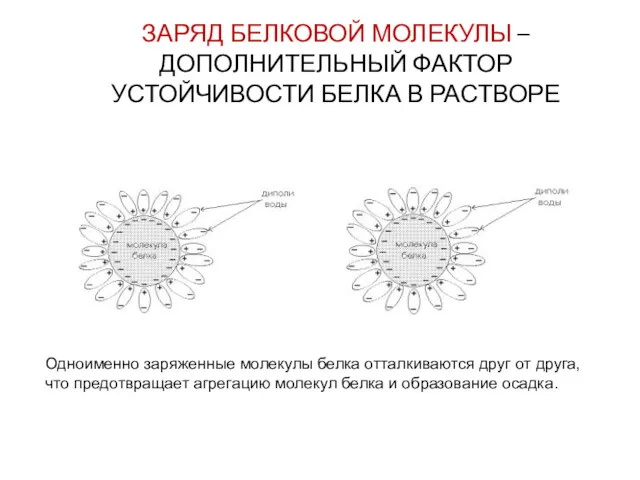
- 28. ЗАРЯД БЕЛКОВОЙ МОЛЕКУЛЫ – ДОПОЛНИТЕЛЬНЫЙ ФАКТОР УСТОЙЧИВОСТИ БЕЛКА В РАСТВОРЕ Одноименно заряженные молекулы белка отталкиваются друг
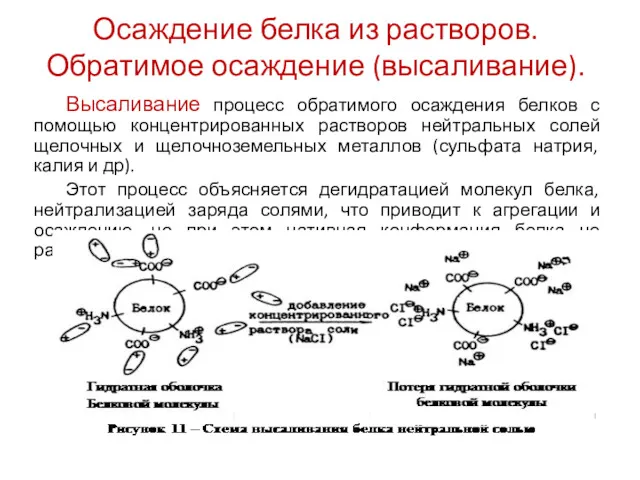
- 29. Осаждение белка из растворов. Обратимое осаждение (высаливание). Высаливание процесс обратимого осаждения белков с помощью концентрированных растворов
- 30. Необратимое осаждение белка Денатурация - любое негидролитическое разрушение нативной конформации белка, сопровождающееся потерей физико-химических свойств и
- 31. Биологическая роль высаливания и денатурации Высаливание Получение белков в кристаллическом виде Разделение белков на фракции (альбуминов
- 33. Скачать презентацию













 Кормление декоративных птиц
Кормление декоративных птиц Мышцы туловища
Мышцы туловища Домашні улюбленці. Собака
Домашні улюбленці. Собака Птицы от А до Я
Птицы от А до Я Развитие эволюционного учения Ч. Дарвина
Развитие эволюционного учения Ч. Дарвина Производство продукции полевых культур
Производство продукции полевых культур Анатомия домашних животных
Анатомия домашних животных Какие бывают животные. (Окружающий мир. 2 класс)
Какие бывают животные. (Окружающий мир. 2 класс) Класс Ракообразные
Класс Ракообразные Ветеринарная биотехнология
Ветеринарная биотехнология Интегративная деятельность организма. Рефлексы
Интегративная деятельность организма. Рефлексы Организм – единое целое. Многообразие организмов
Организм – единое целое. Многообразие организмов Природное сообщество. Экологические факторы среды
Природное сообщество. Экологические факторы среды Сердечно-сосудистая система
Сердечно-сосудистая система Технология возделывания гречихи
Технология возделывания гречихи Фізіологія вегетативної нервової системи
Фізіологія вегетативної нервової системи Тип Членистоногие
Тип Членистоногие Царство Растения. Высшие семенные растения. Покрытосеменные ( = цветковые)
Царство Растения. Высшие семенные растения. Покрытосеменные ( = цветковые) Интерактивная игра Умники и умницы по биологии (6 класс КОУ VIII вида)
Интерактивная игра Умники и умницы по биологии (6 класс КОУ VIII вида) Среды обитания живых организмов
Среды обитания живых организмов Цитология – наука о клетке. Методы изучения клетки
Цитология – наука о клетке. Методы изучения клетки Тварини Африки
Тварини Африки Размножение многоклеточных животных. Строение яйца птицы. Лабораторная работа № 10. 6 класс
Размножение многоклеточных животных. Строение яйца птицы. Лабораторная работа № 10. 6 класс Почему в лесу будем соблюдать тишину
Почему в лесу будем соблюдать тишину Кровеносная система
Кровеносная система Наследственные болезни. Причины
Наследственные болезни. Причины Культуры животных клеток
Культуры животных клеток Систематика грибов
Систематика грибов