Содержание
- 2. Некроз – это изменения клетки необратимого характера, заключающиеся в постепенном ферментативном разрушении и денатурации ее белков.
- 3. Некроз - не требует затрат энергии; - не зависит от управляющих сигналов местного и центрального происхождения;
- 4. Морфологическая картина некроза: денатурация внутриклеточных белков ферментативное переваривание поврежденной клетки лизосомальными ферментами нарушение целостности мембран содержимое
- 5. Некрозу могут предшествовать периоды паранекроза и некробиоза. Паранекроз - заметные, но обратимые изменения в клетке: помутнение
- 6. Некробиоз - состояние «между жизнью и смертью» (от necros - мертвый и bios - живой); совокупность
- 7. Виды некроза: Травматический (прямое действие механических, температурных, вибрационных, радиационных и др. факторов). Токсический (действие токсинов, чаще
- 8. Иммуногенный (результат цитолиза в ходе аутоагрессивных иммунных и аллергических реакций). Циркуляторный (недостаточность циркуляции крови в кровеносных
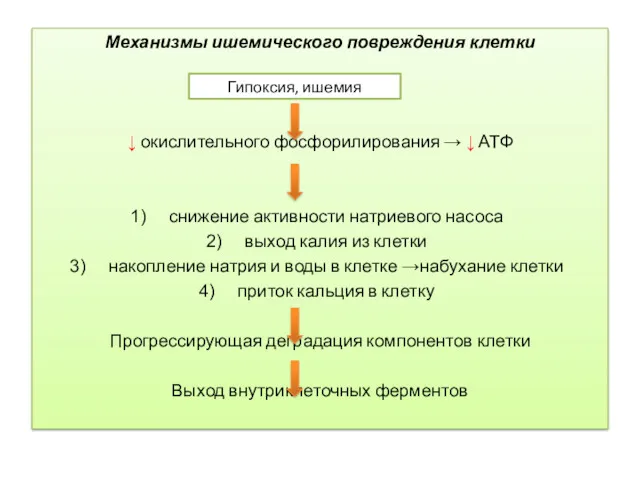
- 9. Механизмы ишемического повреждения клетки ↓ окислительного фосфорилирования → ↓ АТФ снижение активности натриевого насоса выход калия
- 10. Выход внутриклеточных ферментов и других белков через аномально проницаемую плазматическую мембрану в кровь - важный клинический
- 11. Признаки необратимости повреждения клеток. Разрывы плазматической мембраны. Выраженные изменения структуры ядра: Кариорексис – разрывы ядерной мембраны,
- 12. Апоптоз – это программированная клеточная смерть в развитии которой активную роль принимают специальные и генетически запрограммированные
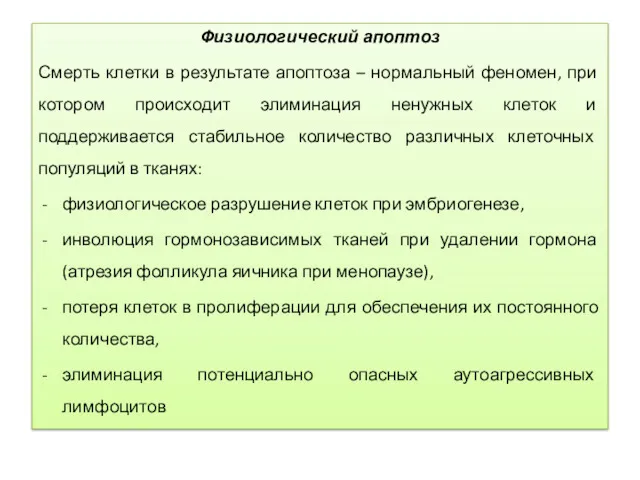
- 13. Физиологический апоптоз Смерть клетки в результате апоптоза – нормальный феномен, при котором происходит элиминация ненужных клеток
- 14. Апоптоз при патологических состояниях В процессе апоптоза удаляются клетки, которые не подлежат восстановлению после повреждения, таким
- 15. Смерть в результате апоптоза происходит при разных патологических состояниях: При повреждении ДНК (радиация, цитостатики) При накоплении
- 16. Морфологические изменения при апоптозе Сморщивание клетки, цитоплазма плотная Конденсация хроматина (хроматин собирается под мембраной ядра) Формирование
- 17. Биохимические признаки апоптоза Активация каспаз (семейство цистеиновых протеаз) Каспазы разделены на две группы: инициаторы и эффекторы.
- 18. В процессе апоптоза выделяют: Инициальную фазу (некоторые каспазы становятся каталитически активными) Эффекторную фазу (другие каспазы вызывают
- 19. Внутренний путь развития апоптоза (митохондриальный) Результат повышения митохондриальной проницаемости и высвобождение проапоптозных молекул (индукторов смерти клетки)
- 20. Внешний путь развития апоптоза инициируется рецепторами смерти плазматической мембраны. Рецепторы смерти являются белками семейства рецепторов TNF.
- 21. Стадии апоптоза: 1 стадия – стадия инициации (индукции). В зависимости от происхождения сигнала, стимулирующего апоптоз, различают:
- 22. 0 трансмембранные стимулы апоптоза, в этом случае он активируется внешней «сигнализацией», которая передается через мембранные или
- 23. Трансмембранные сигналы подразделяют на: -«отрицательные» сигналы Для нормальной жизнедеятельности клетки, регуляции ее деления и размножения необходимо
- 24. «положительные» сигналы Сигнальные молекулы, такие как ФНОα, глюкокортикоиды, некоторые антигены, адгезивные белки и др., после взаимодействия
- 25. 2 стадия – стадия программирования (контроля и интеграции механизмов апоптоза). Происходит либо: - реализация пускового сигнала
- 26. 3 стадия – стадия реализация программы (исполнительная, эффекторная) заключается в гибели клетки, осуществляемой посредством активации протеаз
- 28. Скачать презентацию























 О тех, кого не любят (Многообразие пресмыкающихся)
О тех, кого не любят (Многообразие пресмыкающихся) Расщепление пероксида водорода в клетках клубня картофеля. Лабораторная работа №1
Расщепление пероксида водорода в клетках клубня картофеля. Лабораторная работа №1 Ауыз су, өндірістік су
Ауыз су, өндірістік су Життя – це спосіб існування білкових тіл
Життя – це спосіб існування білкових тіл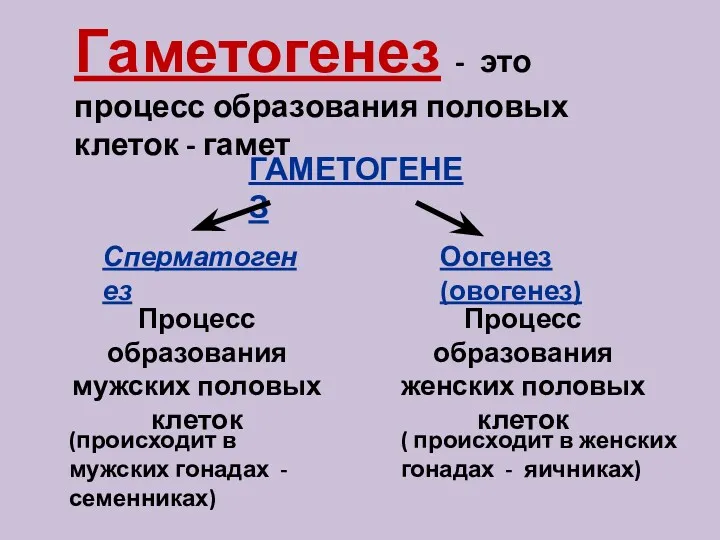 Процесс образования половых клеток - гаметогенез
Процесс образования половых клеток - гаметогенез Физические основы деятельности систем дыхания, кровообращения и энергообмена при мышечных движениях
Физические основы деятельности систем дыхания, кровообращения и энергообмена при мышечных движениях Вегетативное размножение растения
Вегетативное размножение растения Животные Красной книги Республики Коми
Животные Красной книги Республики Коми Өсімдіктерді қорғауда биологиялық препараттарды қолдану. (Лекция 13)
Өсімдіктерді қорғауда биологиялық препараттарды қолдану. (Лекция 13) Фотосинтез. Суммарная реакция фотосинтеза
Фотосинтез. Суммарная реакция фотосинтеза Метод максимальной парсимонии (продолжение). Метод максимального правдоподобия
Метод максимальной парсимонии (продолжение). Метод максимального правдоподобия Тварини-будівельники
Тварини-будівельники Генетика человека с основами медицинской генетики
Генетика человека с основами медицинской генетики Анатомия листа С3 и С4 растений. Особенности фиксация диоксида углерода в клетках мезофилла. Акцепторы диоксида углерода
Анатомия листа С3 и С4 растений. Особенности фиксация диоксида углерода в клетках мезофилла. Акцепторы диоксида углерода Морфология и классификация микроорганизмов (часть 3)
Морфология и классификация микроорганизмов (часть 3) Многообразие моллюсков
Многообразие моллюсков Отряд голенастые
Отряд голенастые Which statement about the properties of life is false?
Which statement about the properties of life is false? Сезонные изменения в природе и жизнедеятельности организмов
Сезонные изменения в природе и жизнедеятельности организмов Серцевий цикл. Робота серця
Серцевий цикл. Робота серця презентация Единство многообразия
презентация Единство многообразия Комнатные растения
Комнатные растения Молекулярный механизм генетических процессов. Репликация. (Лекция 10)
Молекулярный механизм генетических процессов. Репликация. (Лекция 10) Лікарська сировина тваринного походження
Лікарська сировина тваринного походження Ткани. Эпителиальная ткань. Соединительная ткань. Мышечная ткань
Ткани. Эпителиальная ткань. Соединительная ткань. Мышечная ткань Ядовитые грибы и ягоды
Ядовитые грибы и ягоды Свечение моря
Свечение моря Взаимосвязи животных в природе. Биологические сообщества
Взаимосвязи животных в природе. Биологические сообщества