Содержание
- 2. Історія дослідження В 1728р. Я.Бекарі виділив із пшеничного борошна клейковину і дослідив її властивості. Білки були
- 3. Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм
- 4. Історія вивчення білків О.Я.Данилевський. Ф.Сенгер Л.Полінг
- 5. Перші тривимірні структури білків гемоглобіну і міоглобіну були отримані за допомогою рентгеноструктурного аналізу, за що автори
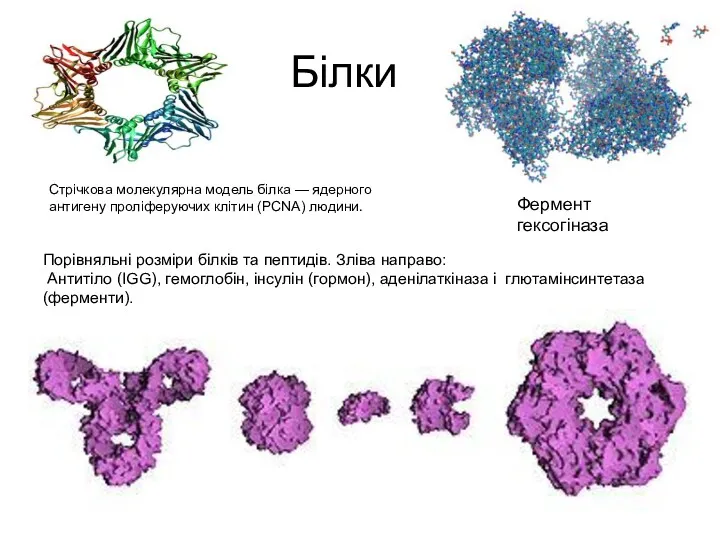
- 6. Білки Порівняльні розміри білків та пептидів. Зліва направо: Антитіло (IGG), гемоглобін, інсулін (гормон), аденілаткіназа і глютамінсинтетаза
- 7. Що таке білки? Білки – це високомолекулярні біополімери , мономерами яких є залишки амінокислоти.
- 8. Гетеромерні біополімери міоглобін колаген гемоглобін
- 9. Різноманітність білкових молекул забезпечується різними комбінаціями 20 основних (золотих) амінокислот.
- 10. Розмір білка може вимірюватися за числом амінокислот або в одиницях молекулярної маси — дальтонах — Да
- 11. Найменший білок також важко визначити, багато білків. що мають ензиматичну активність, не перевищують за розміром кілька
- 12. Хімічний склад білків Елементарний склад: Амінокислоти Грен, 1809 р. Браконно, 1820 р C – 55 -60%
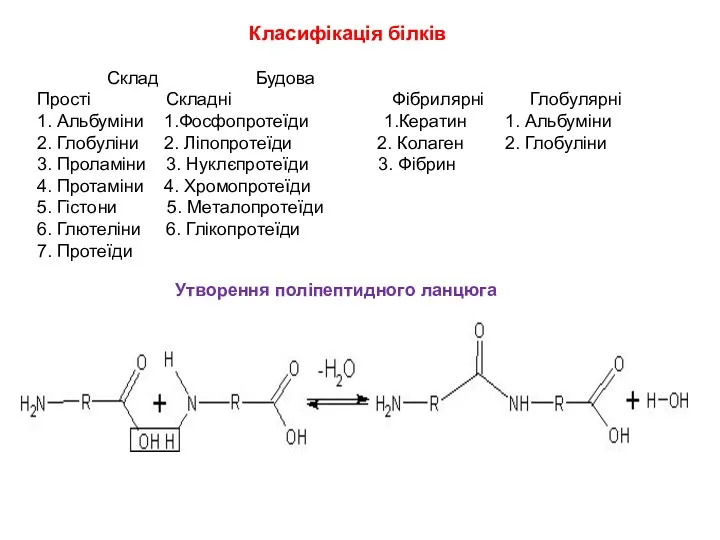
- 13. Класифікація білків Склад Будова Прості Складні Фібрилярні Глобулярні 1. Альбуміни 1.Фосфопротеїди 1.Кератин 1. Альбуміни 2. Глобуліни
- 14. Хімічні властивості білків 1. Гідроліз (кислотно-основний, ферментативний), в результаті якого утворються амінокислоти. 2. Денатурація – порушення
- 15. Кольорові реакції на білки 1. Ксантопротеїнова – взаємодія з концентрованою азотною кислотою, яка супроводжується появою жовтого
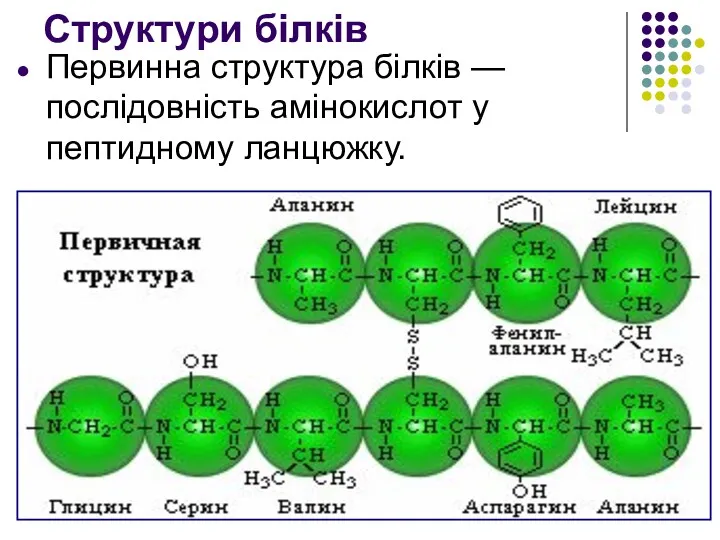
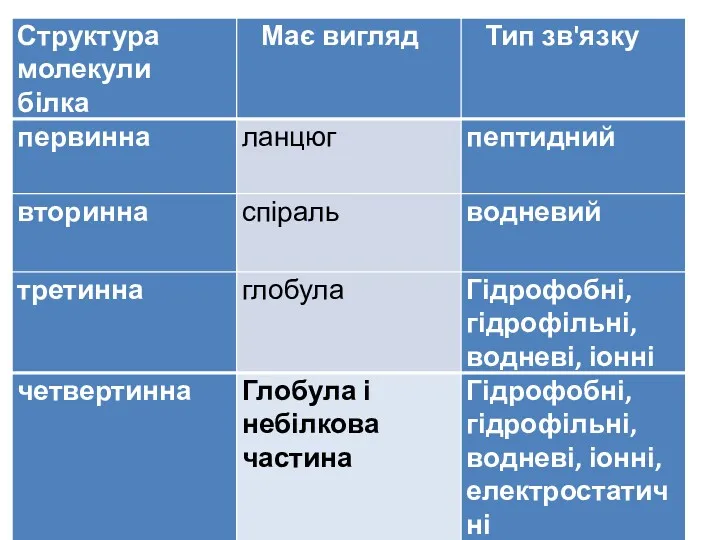
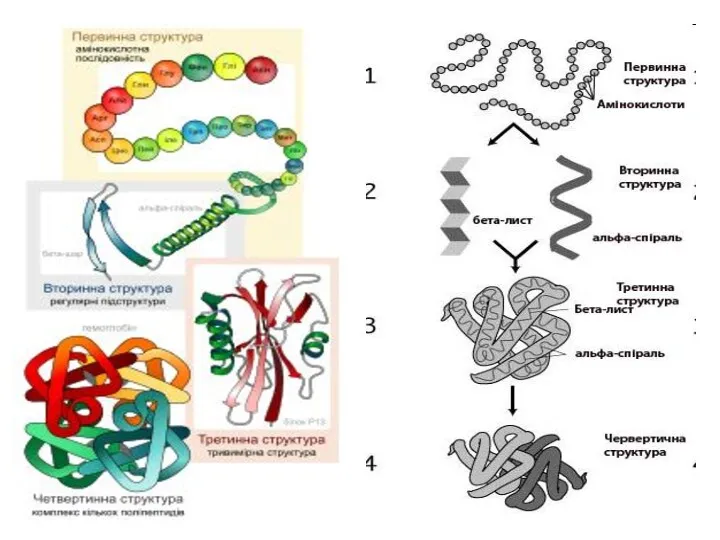
- 17. Структури білків Первинна структура білків — послідовність амінокислот у пептидному ланцюжку.
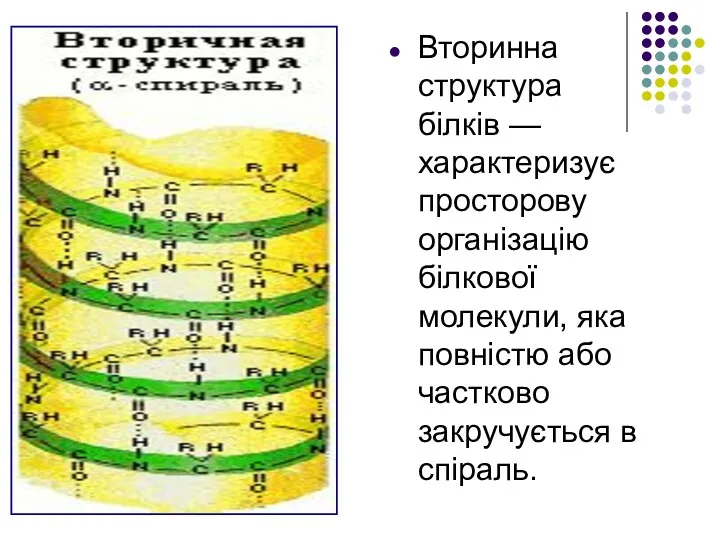
- 18. Вторинна структура білків — характеризує просторову організацію білкової молекули, яка повністю або частково закручується в спіраль.
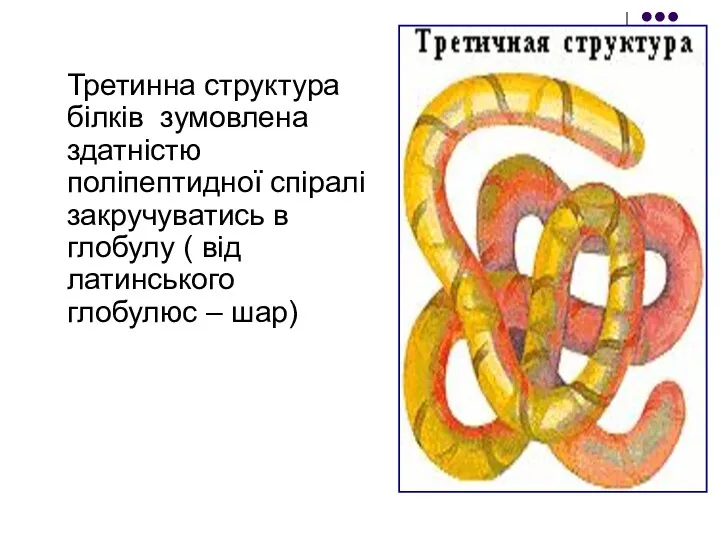
- 19. Третинна структура білків зумовлена здатністю поліпептидної спіралі закручуватись в глобулу ( від латинського глобулюс – шар)
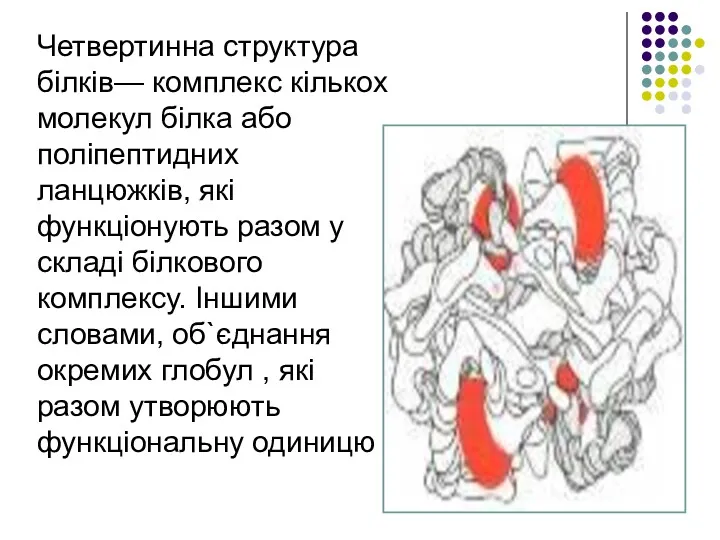
- 20. Четвертинна структура білків— комплекс кількох молекул білка або поліпептидних ланцюжків, які функціонують разом у складі білкового
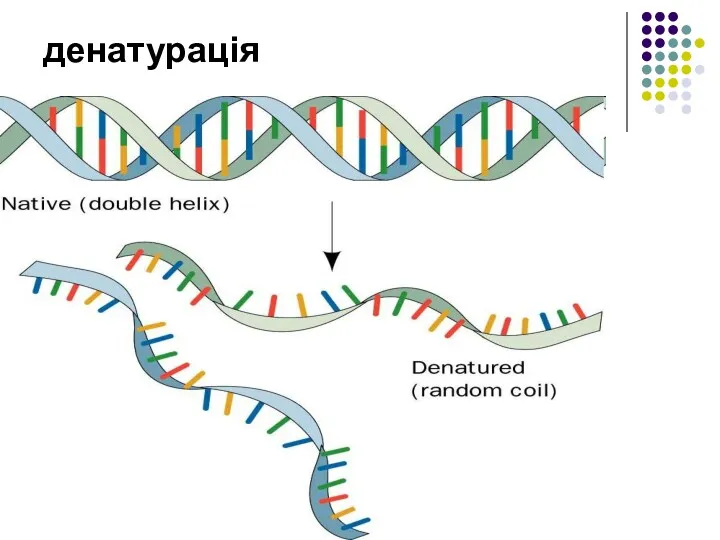
- 23. Властивості білків Денатурація — зміна високорівневої структури молекул. Ренатурація — відновлення структури білка на початковій стадії
- 24. денатурація
- 25. Амінокислоти
- 26. Назви основних амінокислот: Аланін. 11. Лейцин. Аргінін. 12. Лізин Аспарагін. 13. Метіонін Аспарагінова кислота. 14. Пролін
- 28. Скачать презентацию
















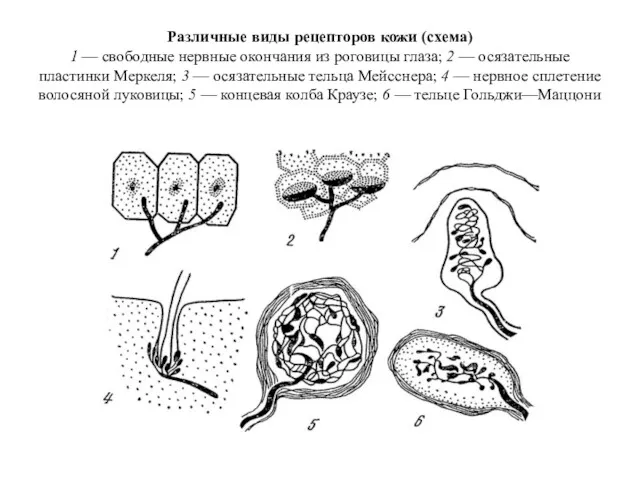 Различные виды рецепторов кожи
Различные виды рецепторов кожи Тест по теме Кровь.
Тест по теме Кровь.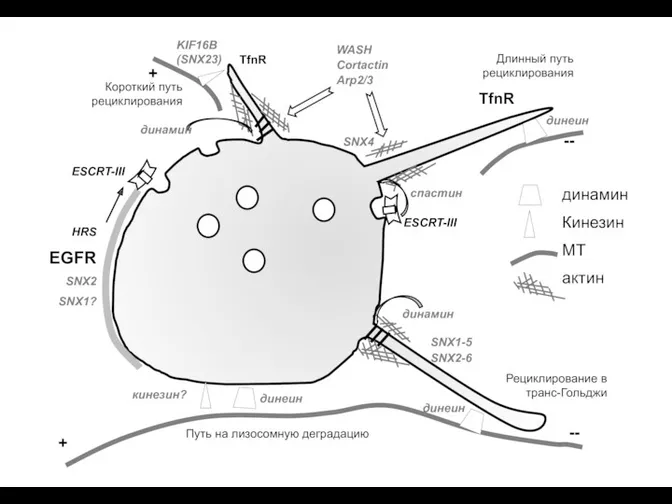 Везикулярный транспорт (эндосомы)
Везикулярный транспорт (эндосомы) Царство Растения
Царство Растения Однодольные растения
Однодольные растения Закономерности изменчивости. Наследственная изменчивость
Закономерности изменчивости. Наследственная изменчивость Перші мікроскопи
Перші мікроскопи Сон і сноведіння
Сон і сноведіння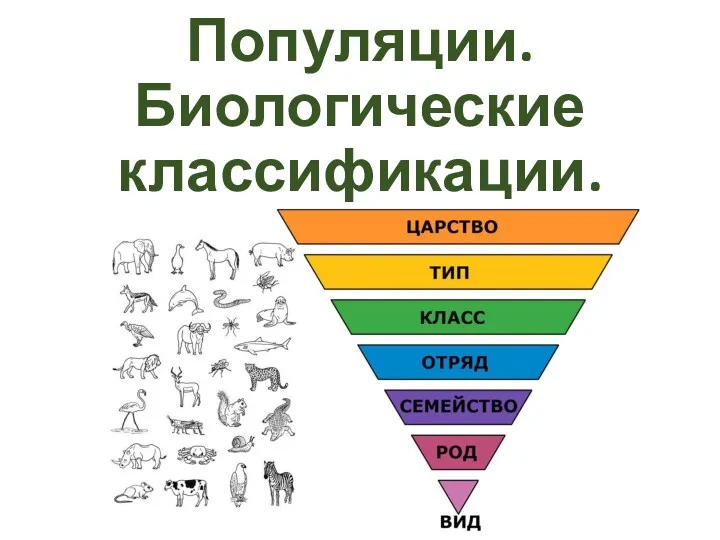 Популяция. Биологическая классификация
Популяция. Биологическая классификация Витамины
Витамины Фотосинтез як характерна особливість рослин
Фотосинтез як характерна особливість рослин Регуляция пищеварения. Заболевания органов пищеварения и их предупреждение. Биология 8 кл (Пасечник)
Регуляция пищеварения. Заболевания органов пищеварения и их предупреждение. Биология 8 кл (Пасечник) Тип Nemathelminthes (Круглые Черви)
Тип Nemathelminthes (Круглые Черви) Сорняки как индикаторы среды обитания
Сорняки как индикаторы среды обитания Рыбы, земноводные, пресмыкающиеся (фотографии)
Рыбы, земноводные, пресмыкающиеся (фотографии)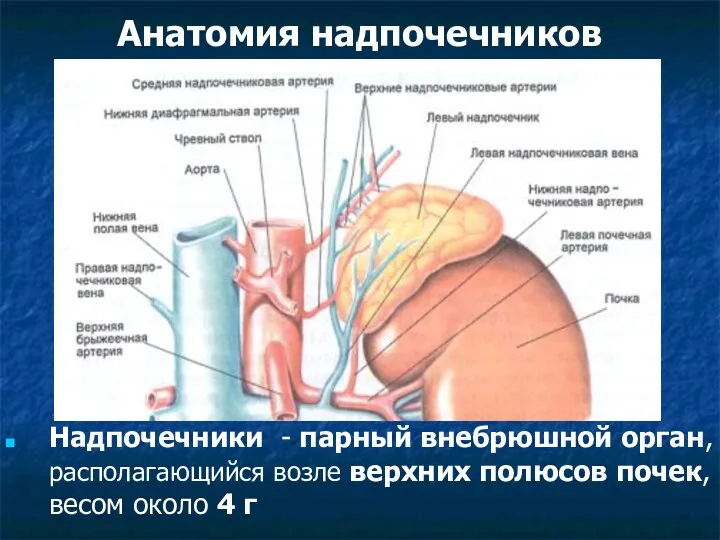 Анатомия надпочечников
Анатомия надпочечников Клеткалық биотехнология
Клеткалық биотехнология Хрящевые рыбы
Хрящевые рыбы Генетика пола. Наследование, сцепленное с полом
Генетика пола. Наследование, сцепленное с полом Презентация к уроку Анализаторы
Презентация к уроку Анализаторы Возрастное развитие сенсорной системы
Возрастное развитие сенсорной системы Размножение растений
Размножение растений Любите и берегите природу Алтайского края Внеклассное мероприятие для учащихся 7-8 классов.
Любите и берегите природу Алтайского края Внеклассное мероприятие для учащихся 7-8 классов. Лекарственные растения
Лекарственные растения Анатомия, как наука. Клетка
Анатомия, как наука. Клетка Апоптоз. Типы клеточной гибели
Апоптоз. Типы клеточной гибели Асимметрия функций больших полушарий. Моторика
Асимметрия функций больших полушарий. Моторика Презентация к уроку Хрящевые рыбы
Презентация к уроку Хрящевые рыбы