Содержание
- 2. Нуклеиновые кислоты
- 3. Нуклеиновые кислоты – это биологические полимеры, состоящие из нуклеотидов, соединенных 3`-5`- фосфодиэфирной связью. Существует 2 вида
- 4. Нуклеиновые кислоты состоят из нуклеотидов! Нуклеотиды состоят из: Азотистые основания Рибоза или дезоксирибоза («сахара») Фосфорная кислота
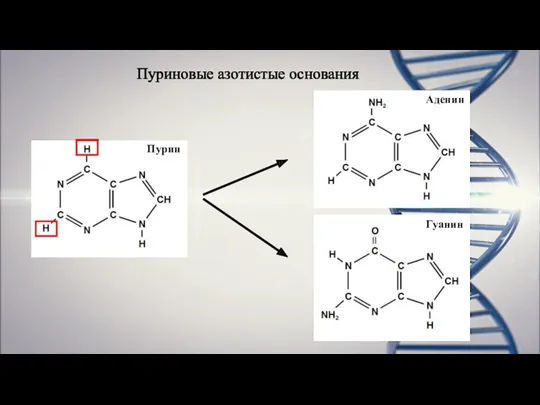
- 5. Пуриновые азотистые основания Пурин Гуанин
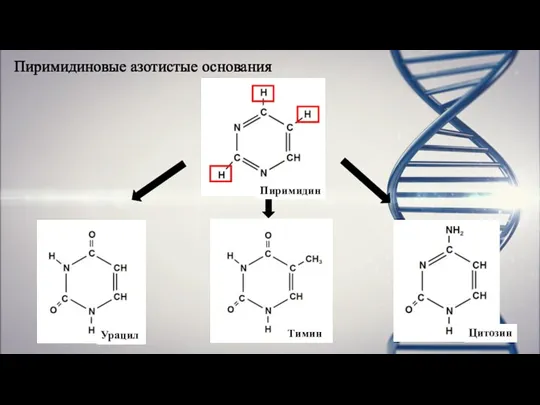
- 6. Пиримидиновые азотистые основания Пиримидин Тимин Урацил Цитозин
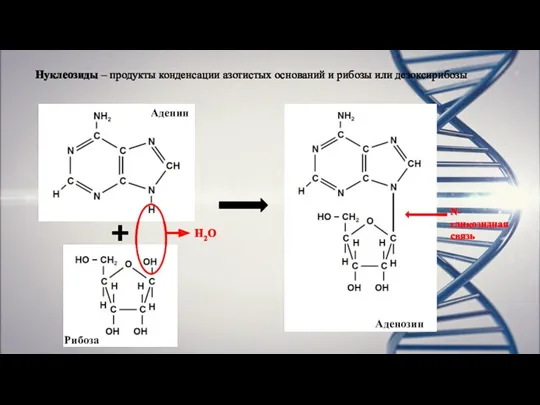
- 7. Нуклеозиды – продукты конденсации азотистых оснований и рибозы или дезоксирибозы Рибоза
- 8. Нуклеотиды – продукты конденсации нуклеозидов и фосфорной кислоты Н2О Аденозинмонофосфат (АМФ) Сложно-эфирная связь
- 9. Номенклатура * Если в состав нуклеозида и нуклеотида входит дезоксирибоза, то добавляется приставка «дезокси». Например, дезоксиаденозинмонофосфат
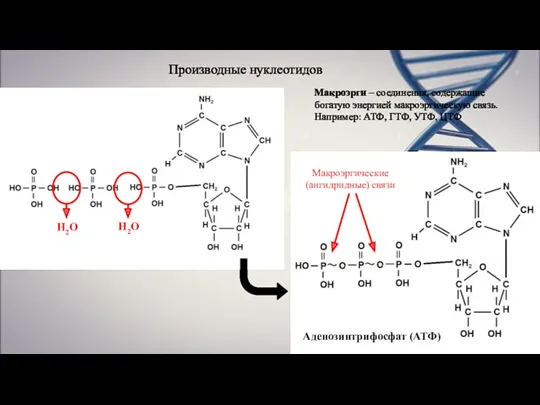
- 10. Производные нуклеотидов Н2О Н2О Макроэргические (ангидридные) связи Аденозинтрифосфат (АТФ) Макроэрги – соединения, содержащие богатую энергией макроэргическую
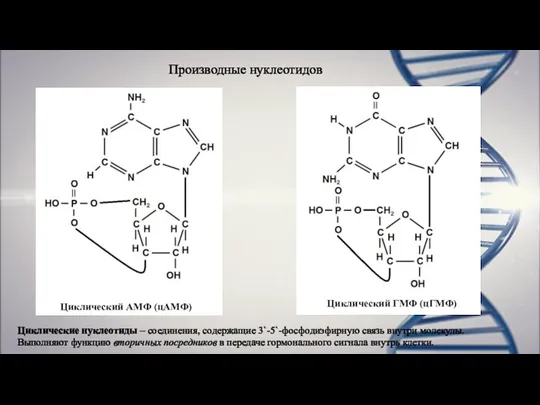
- 11. Производные нуклеотидов Циклический АМФ (цАМФ) Циклический ГМФ (цГМФ) Циклические нуклеотиды – соединения, содержащие 3`-5`-фосфодиэфирную связь внутри
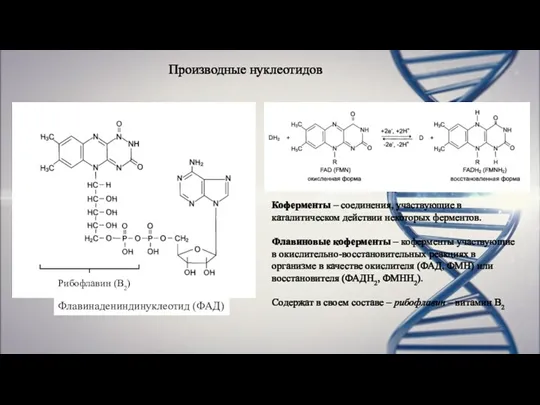
- 12. Производные нуклеотидов Флавинадениндинуклеотид (ФАД) Рибофлавин (В2) Коферменты – соединения, участвующие в каталитическом действии некоторых ферментов. Флавиновые
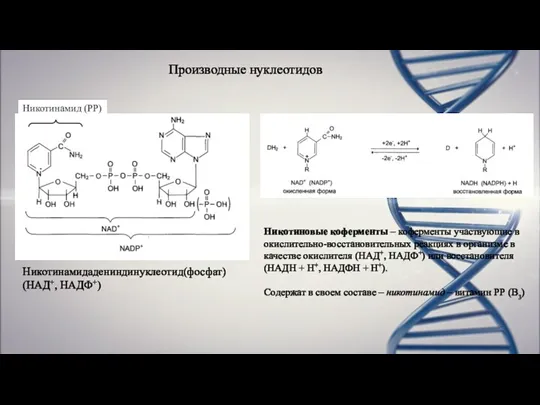
- 13. Производные нуклеотидов Никотинамидадениндинуклеотид(фосфат) (НАД+, НАДФ+) Никотиновые коферменты – коферменты участвующие в окислительно-восстановительных реакциях в организме в
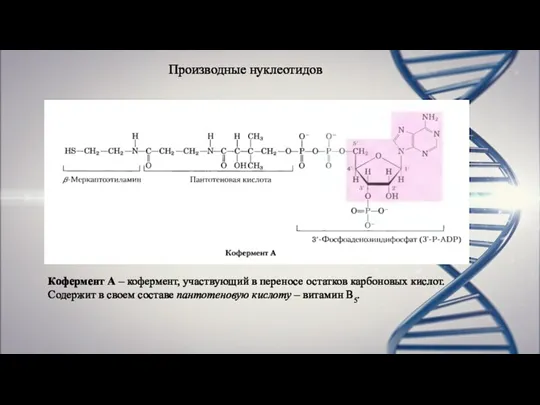
- 14. Производные нуклеотидов Кофермент А – кофермент, участвующий в переносе остатков карбоновых кислот. Содержит в своем составе
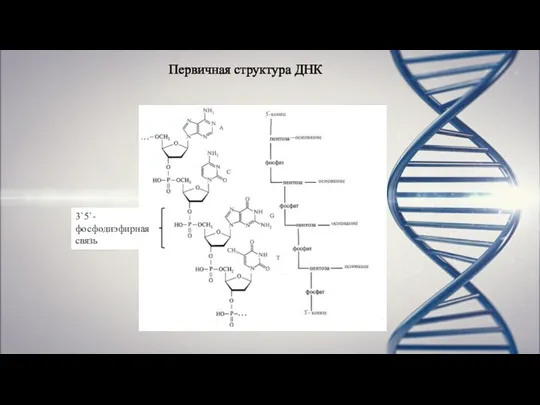
- 15. Первичная структура ДНК 3`5`-фосфодиэфирная связь
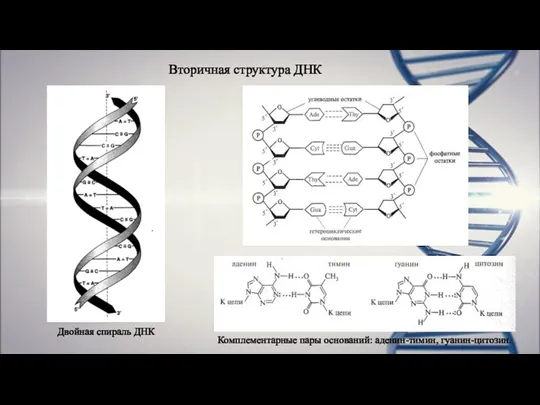
- 16. Вторичная структура ДНК Фрэнсис Крик, Джеймс Уотсон и Морис Уилкинс 1953 г. - Открытие вторичной структуры
- 17. Вторичная структура ДНК Комплементарные пары оснований: аденин-тимин, гуанин-цитозин. Двойная спираль ДНК
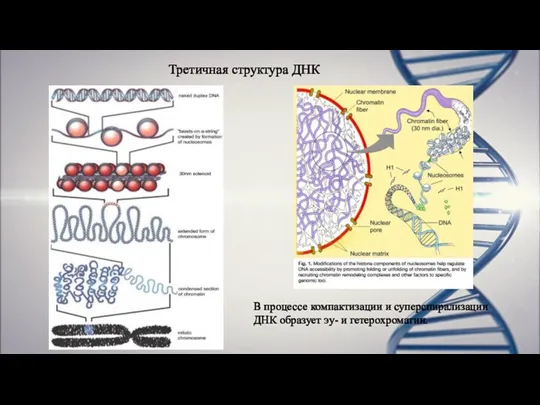
- 18. Третичная структура ДНК В процессе компактизации и суперспирализации ДНК образует эу- и гетерохроматин.
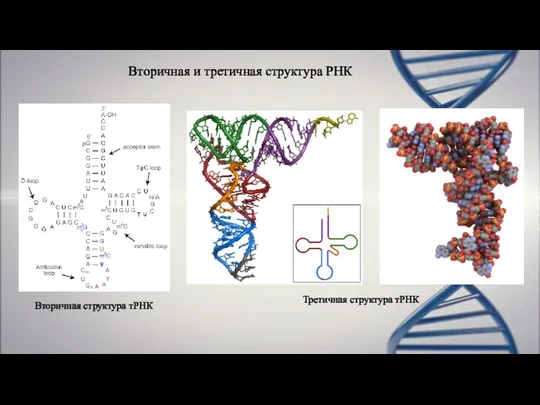
- 19. Вторичная и третичная структура РНК Вторичная структура тРНК Третичная структура тРНК
- 20. Белки
- 21. Белки – биологические полимеры, состоящие из аминокислот, соединенных пептидной связью. Аминокислоты – органические соединения, аминопроизводные карбоновых
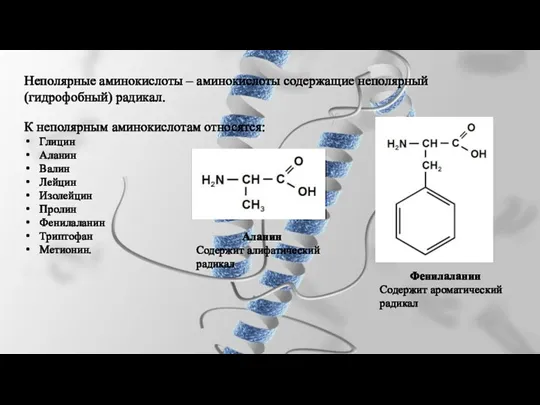
- 22. Неполярные аминокислоты – аминокислоты содержащие неполярный (гидрофобный) радикал. К неполярным аминокислотам относятся: Глицин Аланин Валин Лейцин
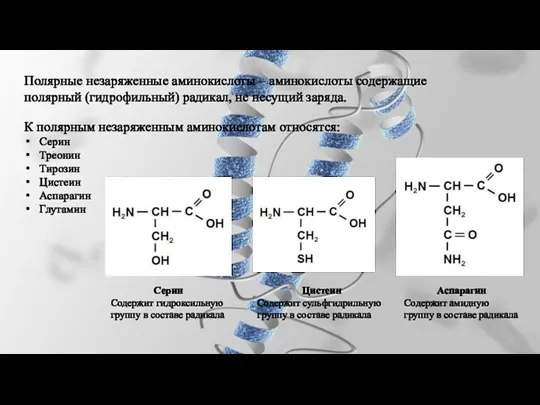
- 23. Полярные незаряженные аминокислоты – аминокислоты содержащие полярный (гидрофильный) радикал, не несущий заряда. К полярным незаряженным аминокислотам
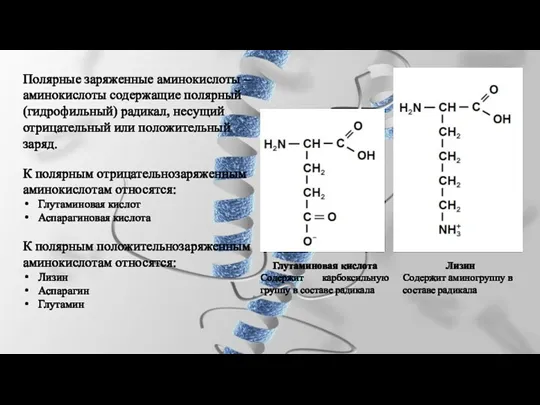
- 24. Полярные заряженные аминокислоты – аминокислоты содержащие полярный (гидрофильный) радикал, несущий отрицательный или положительный заряд. К полярным
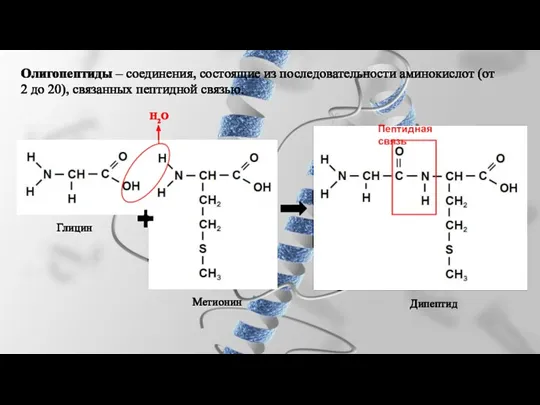
- 25. Олигопептиды – соединения, состоящие из последовательности аминокислот (от 2 до 20), связанных пептидной связью. Н2О Пептидная
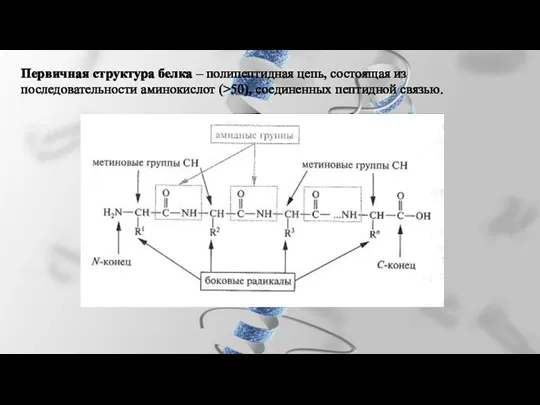
- 26. Первичная структура белка – полипептидная цепь, состоящая из последовательности аминокислот (>50), соединенных пептидной связью.
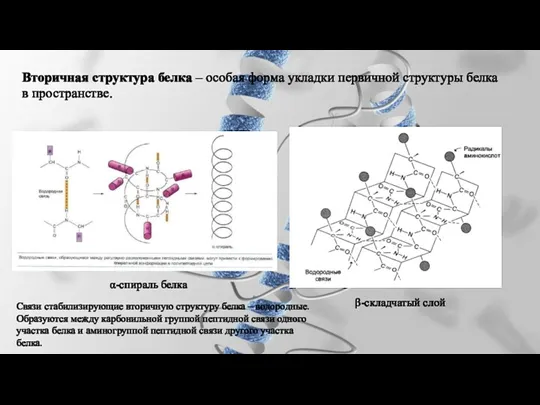
- 27. Вторичная структура белка – особая форма укладки первичной структуры белка в пространстве. β-складчатый слой α-спираль белка
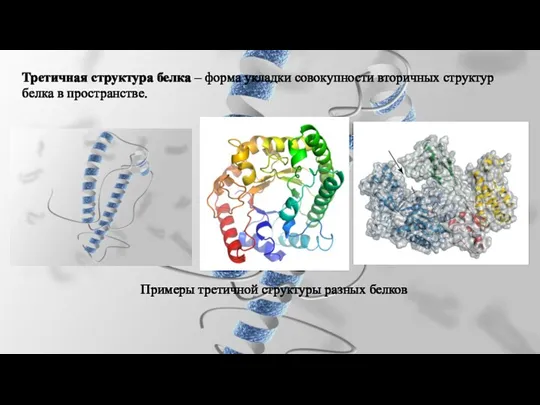
- 28. Третичная структура белка – форма укладки совокупности вторичных структур белка в пространстве. Примеры третичной структуры разных
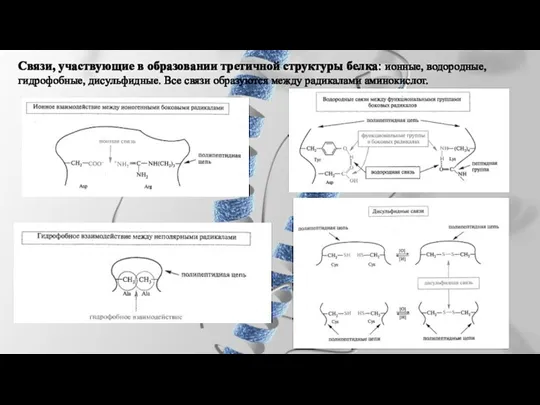
- 29. Связи, участвующие в образовании третичной структуры белка: ионные, водородные, гидрофобные, дисульфидные. Все связи образуются между радикалами
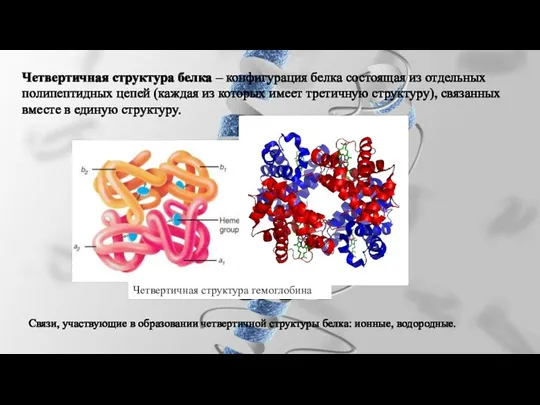
- 30. Четвертичная структура белка – конфигурация белка состоящая из отдельных полипептидных цепей (каждая из которых имеет третичную
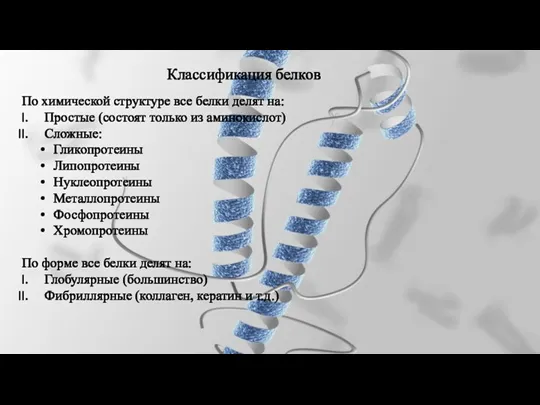
- 31. Классификация белков По химической структуре все белки делят на: Простые (состоят только из аминокислот) Сложные: Гликопротеины
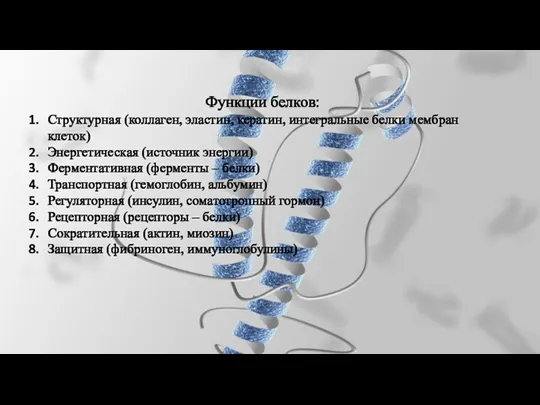
- 32. Функции белков: Структурная (коллаген, эластин, кератин, интегральные белки мембран клеток) Энергетическая (источник энергии) Ферментативная (ферменты –
- 34. Скачать презентацию







 Красная книга Казахстана
Красная книга Казахстана Бионика. Бионическая архитектура
Бионика. Бионическая архитектура Семейство сельдевых, тресковых, камбаловых и ставридовых рыб
Семейство сельдевых, тресковых, камбаловых и ставридовых рыб Бауырдың биохимиясы
Бауырдың биохимиясы Кісткові і Хрящові риби. 7 клас
Кісткові і Хрящові риби. 7 клас Лікарські рослини, які містять полісахариди
Лікарські рослини, які містять полісахариди Сезонные изменения в природе и жизнедеятельности организмов
Сезонные изменения в природе и жизнедеятельности организмов презентация по биологии 7 класс Плоские черви
презентация по биологии 7 класс Плоские черви Объекты биотехнологии. Биообъекты, применяемые на практике
Объекты биотехнологии. Биообъекты, применяемые на практике Лисичка желтая
Лисичка желтая Семейство розоцветных.
Семейство розоцветных. Эндокринная система
Эндокринная система Физиология сенсорных систем
Физиология сенсорных систем Биоэнергетика. Биологическое окисление. Биологические виды энергии
Биоэнергетика. Биологическое окисление. Биологические виды энергии Реакции электрофильного замещения в ароматическом и гетероциклическом рядах SE. (Лекция 5)
Реакции электрофильного замещения в ароматическом и гетероциклическом рядах SE. (Лекция 5) Exotic animals
Exotic animals Строение семян
Строение семян Определение соотношения размеров хвоинок и шишек хвойных деревьев. Выявление наиболее полезных хвойных деревьев
Определение соотношения размеров хвоинок и шишек хвойных деревьев. Выявление наиболее полезных хвойных деревьев Carbohydrates
Carbohydrates Метод селекции породы собак сиба-ину
Метод селекции породы собак сиба-ину Строение. Функции. Значение кожи
Строение. Функции. Значение кожи Царство Растения
Царство Растения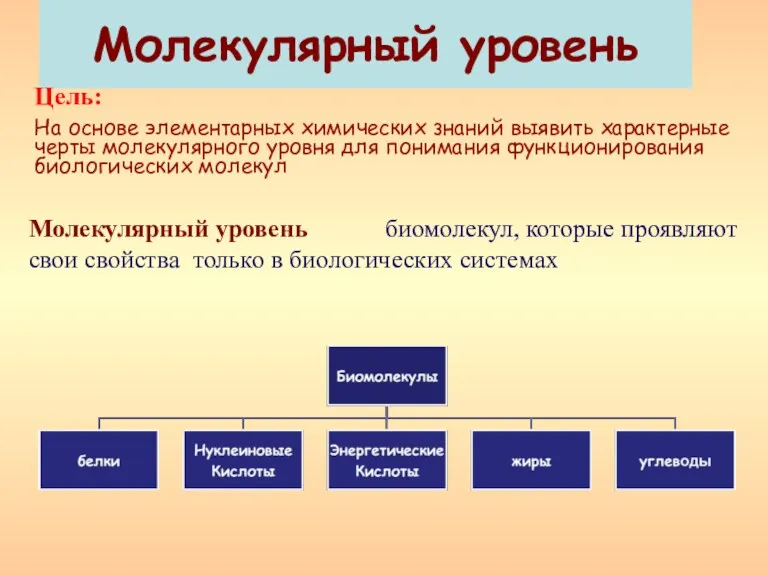 Молекулярный уровень
Молекулярный уровень Основные компоненты клетки
Основные компоненты клетки Ознаки живих організмів
Ознаки живих організмів Моногибридное скрещивание
Моногибридное скрещивание Состояние и перспективы развития пчеловодства в Республике Башкортостан. История развития, ведущие ученые
Состояние и перспективы развития пчеловодства в Республике Башкортостан. История развития, ведущие ученые о тиграх
о тиграх