Содержание
- 2. Азотистый баланс Количество азотсодержащих веществ в организме определяется балансом между поступающим азотом и выводимым азотом. Поступающий
- 3. Азотистый баланс Отрицательный азотистый баланс – это состояние, когда количество выводимого азота больше получаемого. Голодание Травмы
- 4. Азотистый баланс Положительный азотистый баланс – это состояние, когда количество поступающего азота больше выводимого. Беременность Регенерация
- 5. Нормы потребления белка Россия Взрослые 100-120 г, Дети 1 год жизни 2-3 г/кг веса, старшие 1,5-2
- 6. Качество белка Идеальный белок: соотношение заменимых и незаменимых аминокислот – в белке должно быть не менее
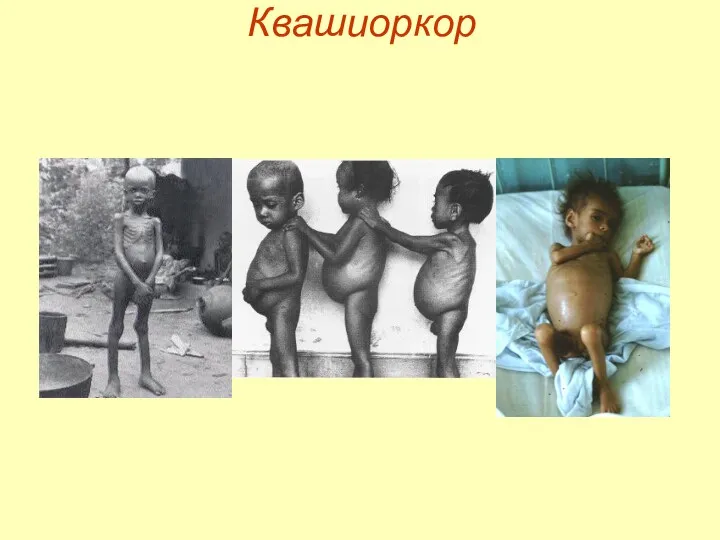
- 7. Квашиоркор Квашиоркор – последствия нехватки в пище белков, особенно животных. Симптомы: задержка роста, истощение отставание физического
- 8. Квашиоркор
- 9. Внешний обмен аминокислот и белков
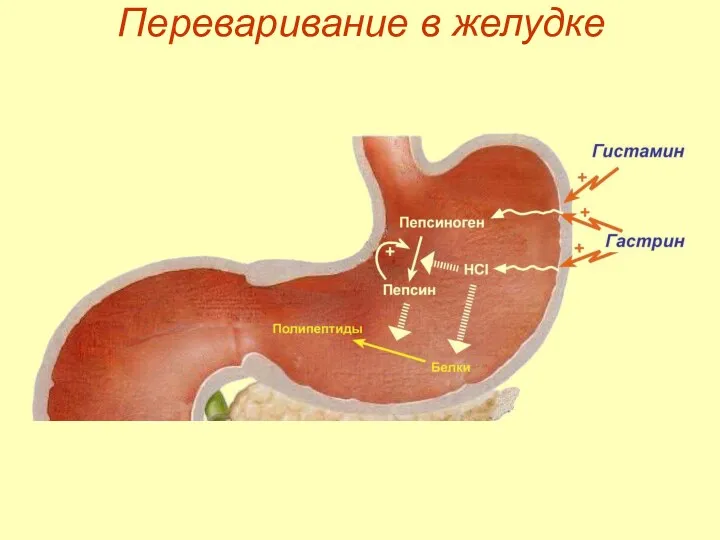
- 10. Переваривание в желудке
- 11. Соляная кислота Функции соляной кислоты денатурация белков пищи, бактерицидное действие, высвобождение Fe3+ из комплекса с белками
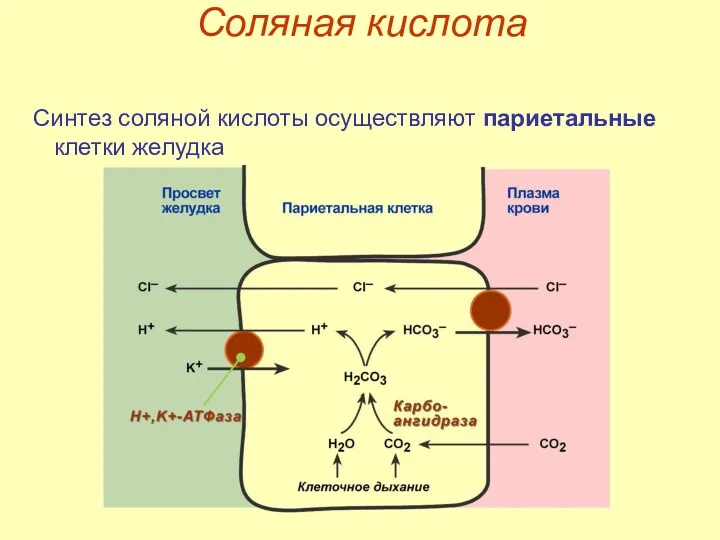
- 12. Соляная кислота Синтез соляной кислоты осуществляют париетальные клетки желудка
- 13. Пепсин эндопептидаза, синтезируется в главных клетках желудка в виде пепсиногена, стимулятором секреции являются гастриксин и гистамин,
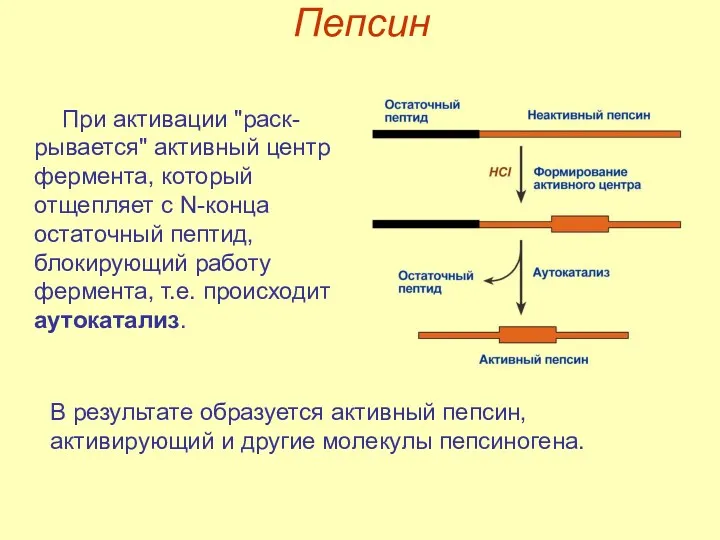
- 14. Пепсин В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена. При активации "раск-рывается" активный центр
- 15. Пепсин
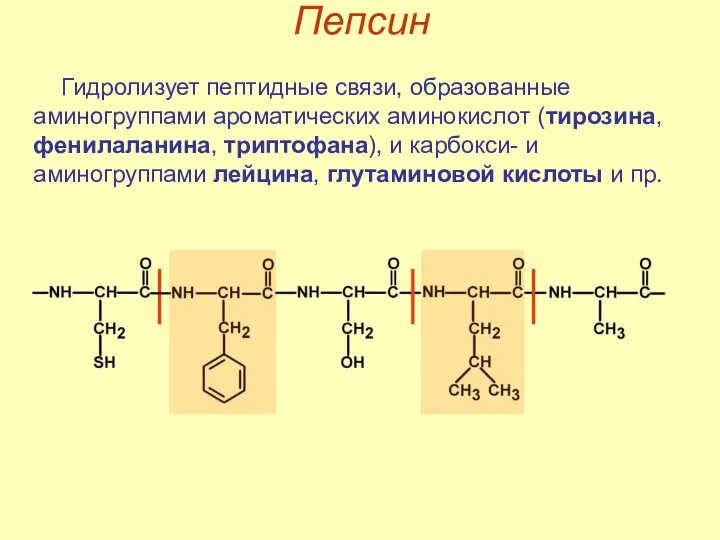
- 16. Пепсин Гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот (тирозина, фенилаланина, триптофана), и карбокси- и аминогруппами лейцина,
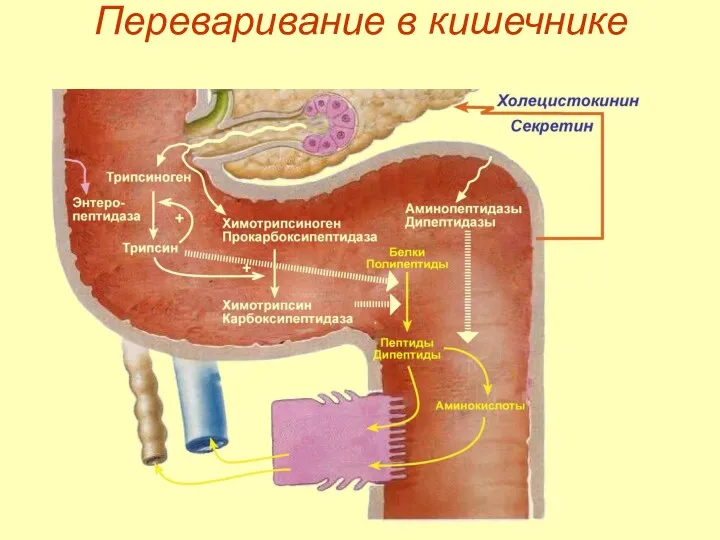
- 17. Переваривание в кишечнике
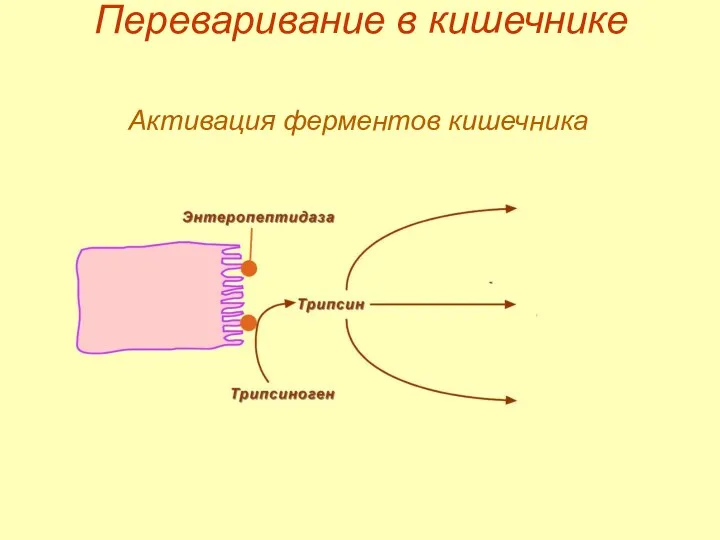
- 18. Переваривание в кишечнике Активация ферментов кишечника
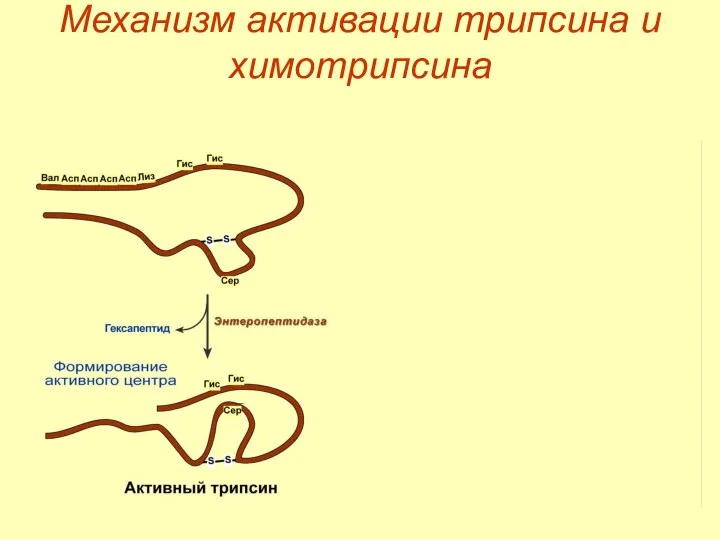
- 19. Механизм активации трипсина и химотрипсина
- 20. Специфичность ферментов Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групп лизина и аргинина. Химотрипсин
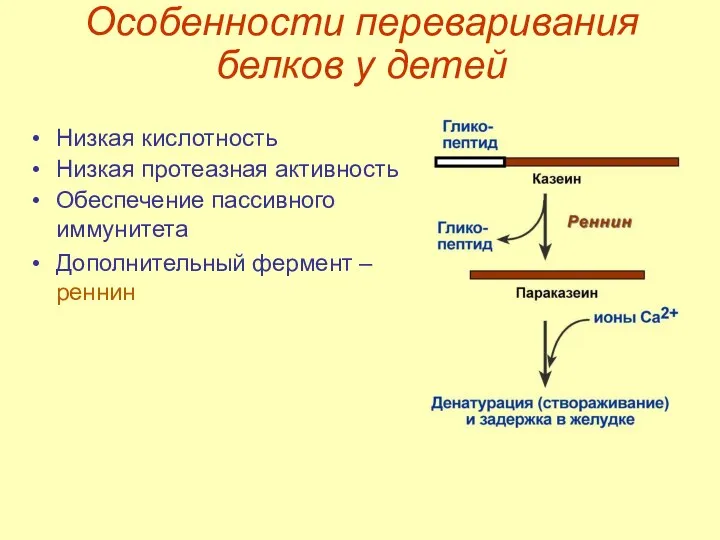
- 21. Особенности переваривания белков у детей Низкая кислотность Низкая протеазная активность Обеспечение пассивного иммунитета Дополнительный фермент –
- 22. Нарушение процессов переваривания белков
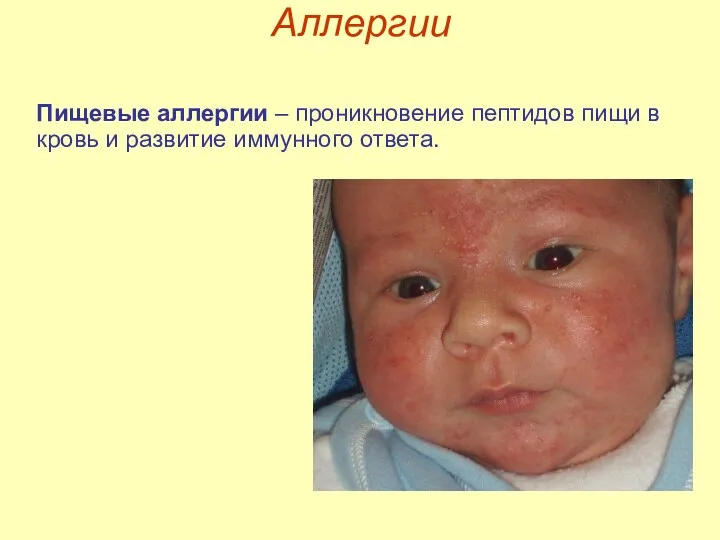
- 23. Аллергии Пищевые аллергии – проникновение пептидов пищи в кровь и развитие иммунного ответа.
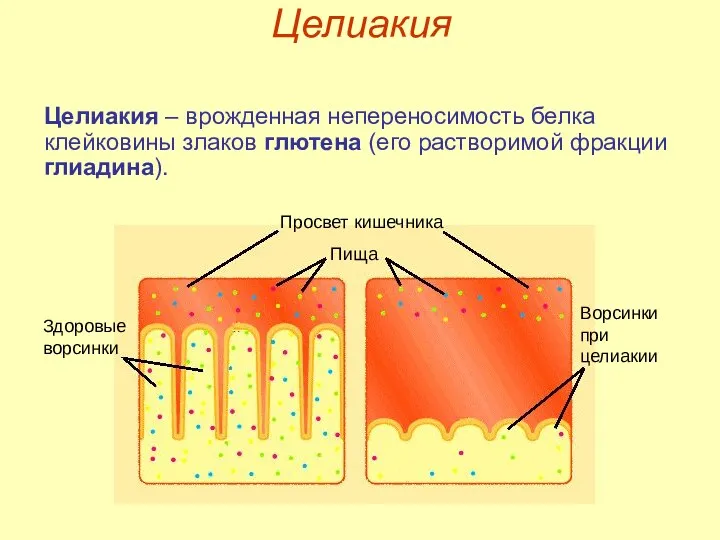
- 24. Целиакия Целиакия – врожденная непереносимость белка клейковины злаков глютена (его растворимой фракции глиадина). Просвет кишечника Пища
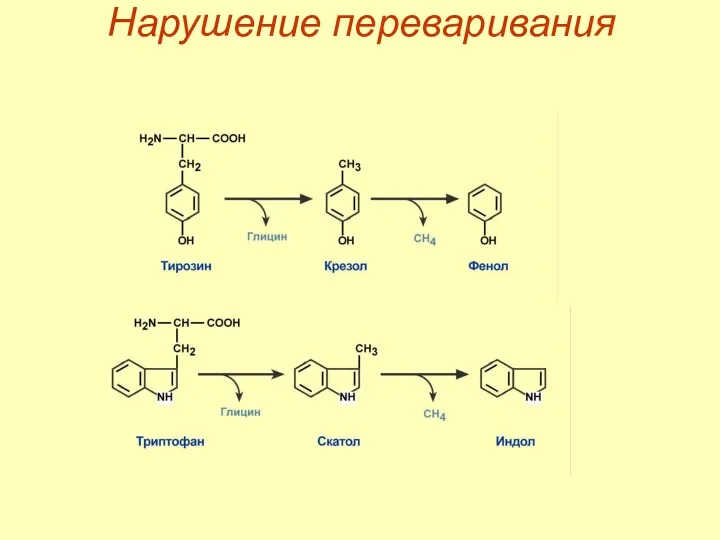
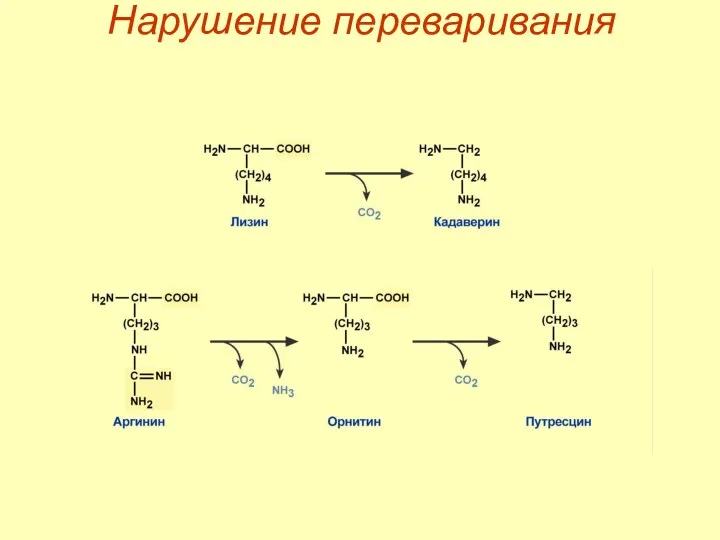
- 25. Гниение белков Гниение белков в кишечнике – превращение аминокислот под влиянием микрофлоры. Причины: избыток белка в
- 26. Нарушение переваривания
- 27. Нарушение переваривания
- 28. Детоксикационные системы печени
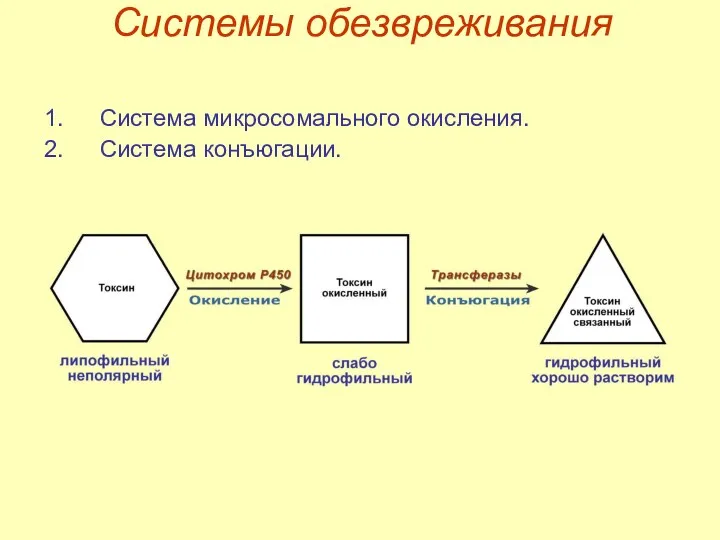
- 29. Системы обезвреживания Система микросомального окисления. Система конъюгации.
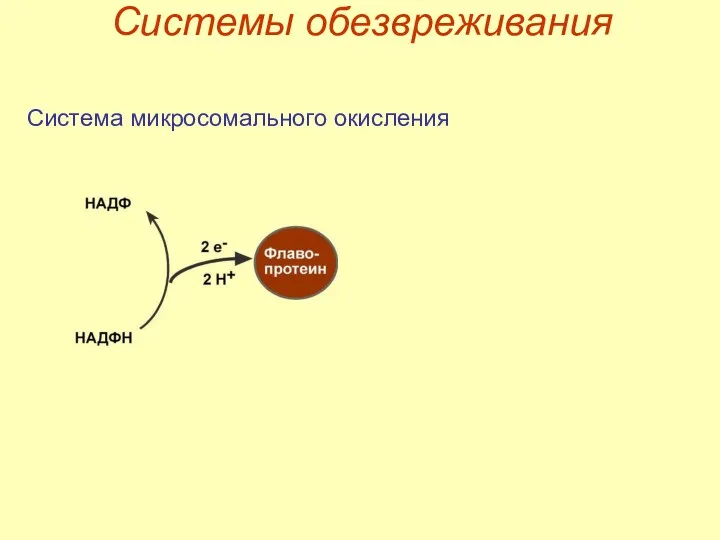
- 30. Системы обезвреживания Система микросомального окисления
- 31. Системы обезвреживания Система конъюгации – связывание с очень полярным соединением (глутатион, серная, глюкуроновая, уксусная кислоты, глицин,
- 32. Образование животного индикана
- 33. Внутриклеточный обмен аминокислот
- 34. Судьба аминокислот в клетке
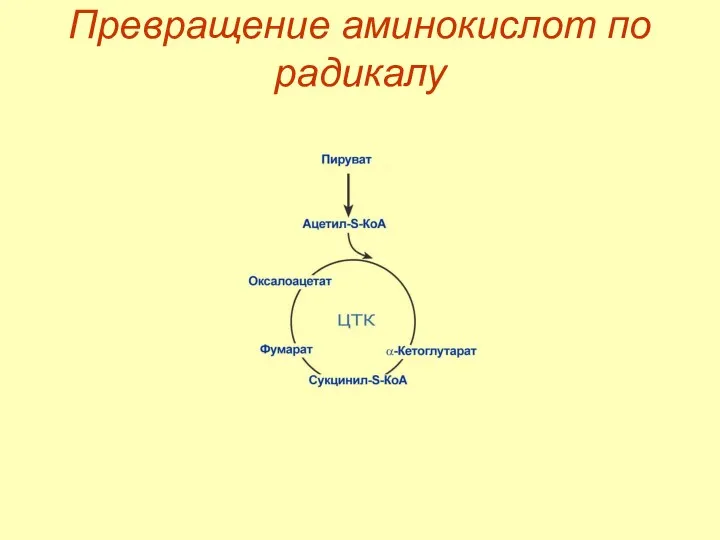
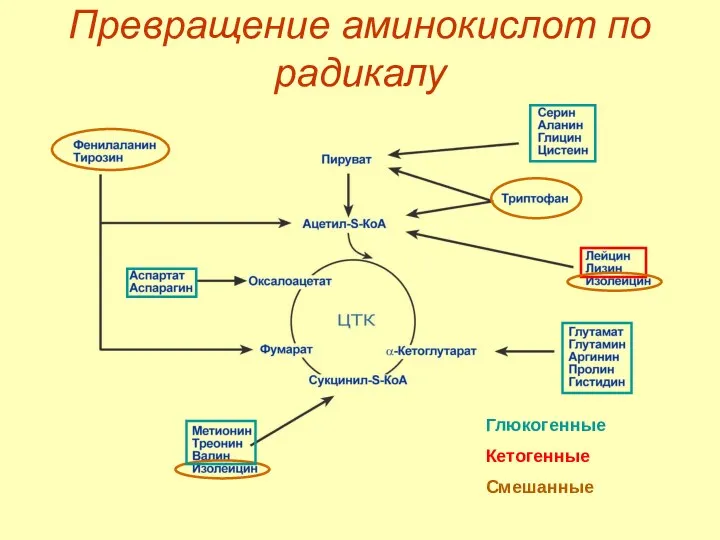
- 35. Превращение аминокислот по радикалу
- 36. Превращение аминокислот по радикалу Глюкогенные Кетогенные Смешанные
- 37. Превращение аминокислот по карбоксильной группе Это удаление карбоксильной группы от аминокислоты и образование биогенных аминов: гистамин
- 38. Превращение аминокислот с участием аминогруппы Превращение аминокислот с участием NH2‑группы сводится к ее отщеплению от углеродного
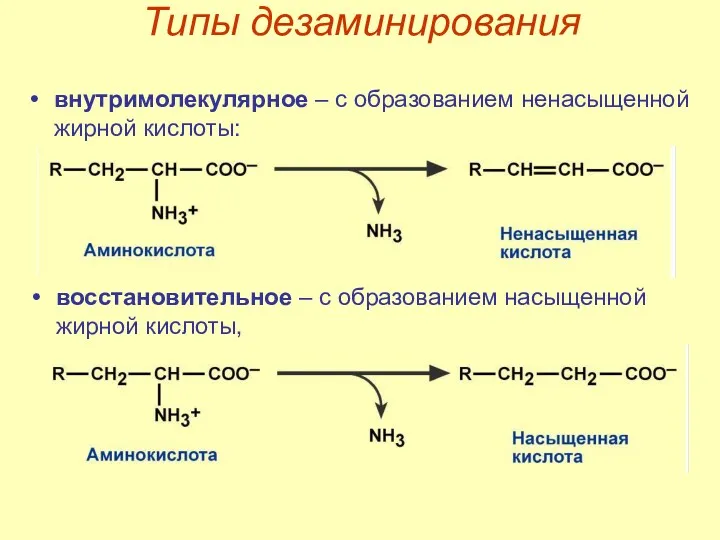
- 39. Типы дезаминирования внутримолекулярное – с образованием ненасыщенной жирной кислоты: восстановительное – с образованием насыщенной жирной кислоты,
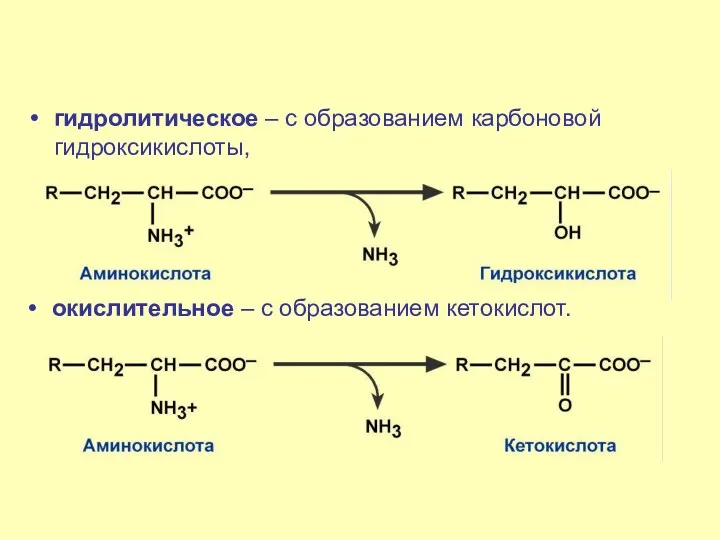
- 40. гидролитическое – с образованием карбоновой гидроксикислоты, окислительное – с образованием кетокислот.
- 41. Окислительное дезаминирование
- 42. Окислительное дезаминирование Прямое Непрямое Аэробное Анаэробное (трансдез- аминирование)
- 43. Прямое окислительное дезаминирование 1. Аэробное 2. Анаэробное
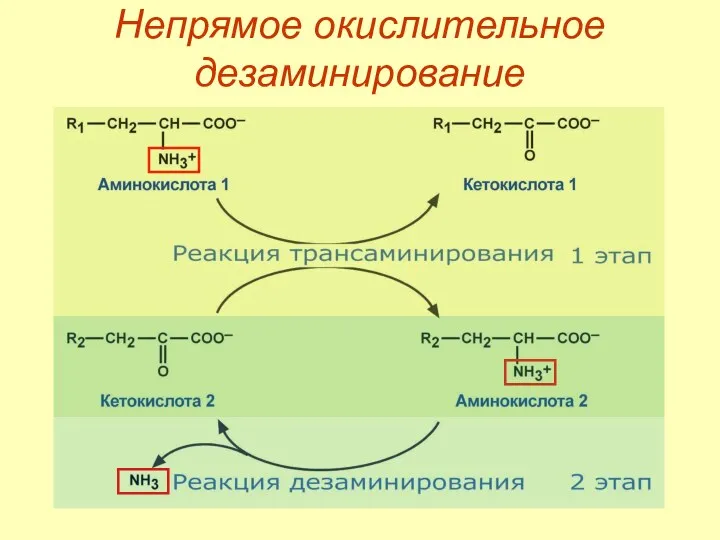
- 44. Непрямое окислительное дезаминирование Первый этап – обратимый перенос NH2‑группы с аминокислоты на кетокислоту с образованием новой
- 45. Непрямое окислительное дезаминирование
- 46. Непрямое окислительное дезаминирование
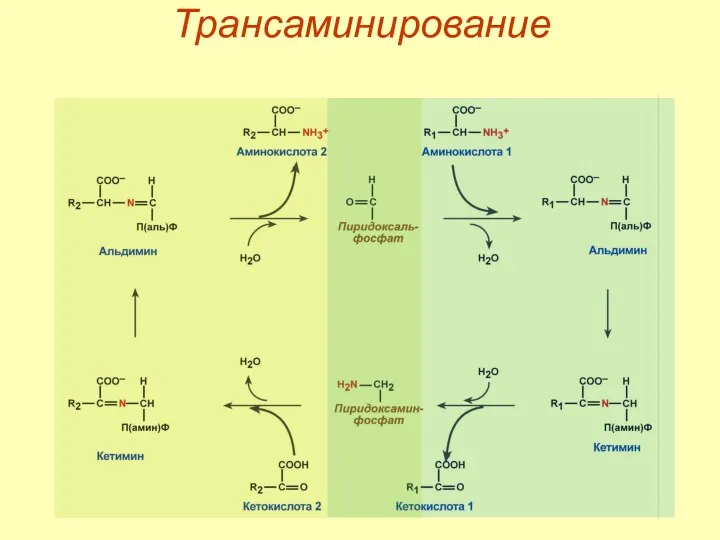
- 47. Механизм трансаминирования
- 48. Трансаминирование
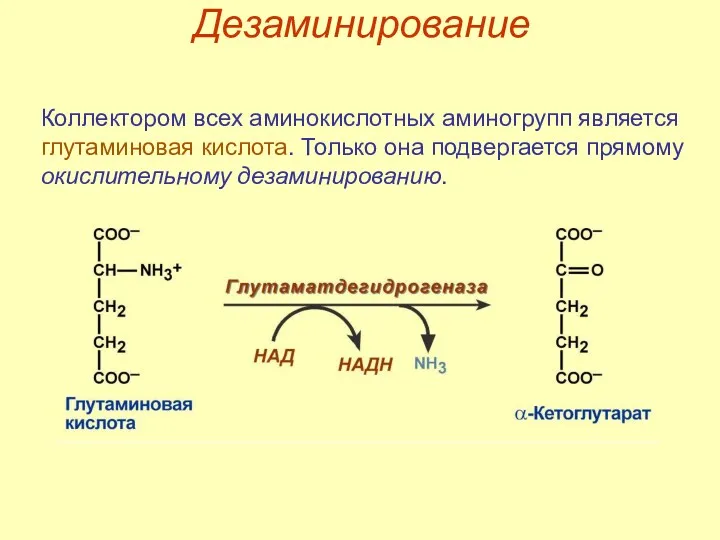
- 49. Дезаминирование Коллектором всех аминокислотных аминогрупп является глутаминовая кислота. Только она подвергается прямому окислительному дезаминированию.
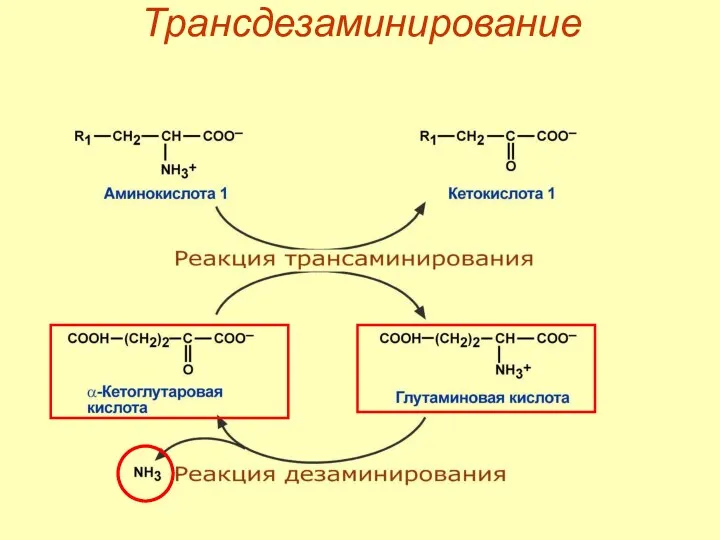
- 50. Трансдезаминирование
- 51. Роль трансаминирования Реакции трансаминирования: оптимизация соотношения аминокислот в клетке, синтез заменимых аминокислот в клетке при наличии
- 52. Роль трансдезаминирования Процесс трансдезаминирования идет в организме непрерывно. Сопряженные реакции трансаминирования и дезаминирования создают поток аминного
- 53. Энзимодиагностика
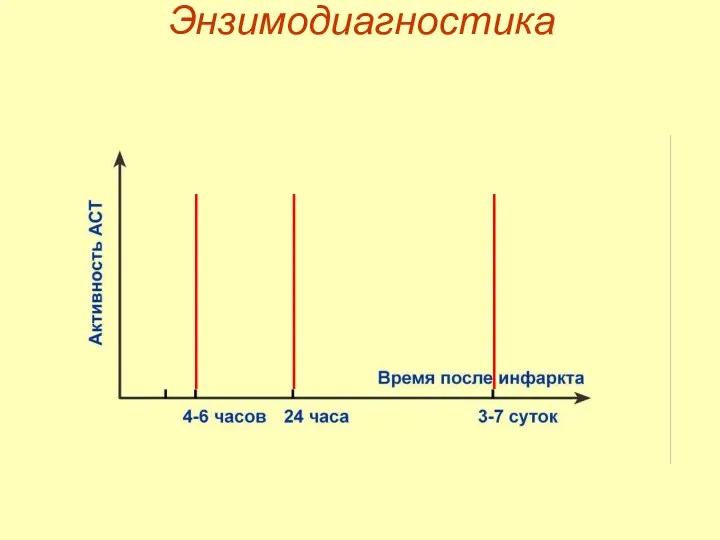
- 54. Энзимодиагностика
- 55. Дезаминирование в мышце
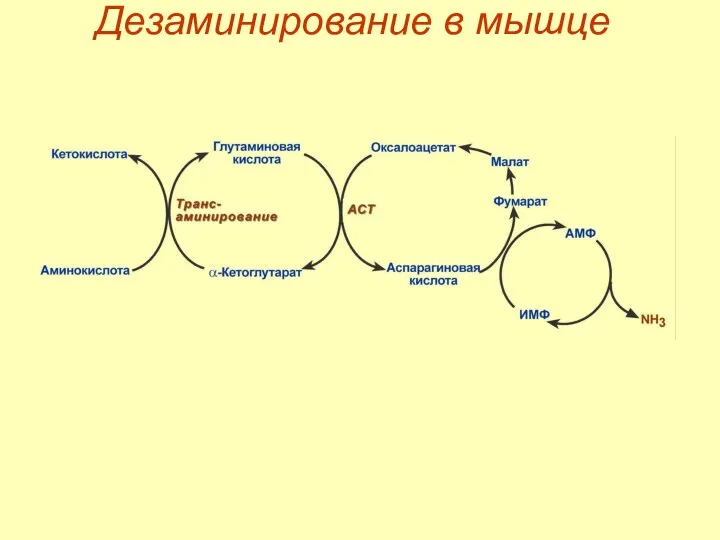
- 57. Скачать презентацию




























 Материал для урока по теме Движение животных в водной среде.
Материал для урока по теме Движение животных в водной среде. Растительный и животный мир Тульской области
Растительный и животный мир Тульской области Химический состав клетки
Химический состав клетки Производство гидропонных домашних систем для выращивания растений ECOBOX
Производство гидропонных домашних систем для выращивания растений ECOBOX Органы пищеварения и обмен веществ
Органы пищеварения и обмен веществ Ұтымды тамақтану және оны ұйымдастыруға қойылатын гигиеналық талаптар
Ұтымды тамақтану және оны ұйымдастыруға қойылатын гигиеналық талаптар Человек – предмет изучения анатомии и физиологии человека
Человек – предмет изучения анатомии и физиологии человека Плауны Хвощи Мхи Папоротники
Плауны Хвощи Мхи Папоротники Свойства живого. 5 класс
Свойства живого. 5 класс Бұлшық ет
Бұлшық ет Экзотические домашние животные
Экзотические домашние животные Тварини минулого
Тварини минулого Круглые черви
Круглые черви Анатомия органов дыхания
Анатомия органов дыхания Личинки животных
Личинки животных Видообразование
Видообразование Тип Членистоногие (Arthropoda). Класс Скрыточелюстные насекомые (Insecta - Entognatha)
Тип Членистоногие (Arthropoda). Класс Скрыточелюстные насекомые (Insecta - Entognatha) Самые необычные кошки планеты
Самые необычные кошки планеты Редактирование генома
Редактирование генома Нервная система. Строение и функции НС, спинного мозга, головного мозга
Нервная система. Строение и функции НС, спинного мозга, головного мозга Позвоночные. Семейный портрет
Позвоночные. Семейный портрет Донецкий ботанический сад— один из крупнейших ботанических садов Европы
Донецкий ботанический сад— один из крупнейших ботанических садов Европы Презентация по биологии для учащихся 8 класса на тему: Обмен веществ
Презентация по биологии для учащихся 8 класса на тему: Обмен веществ Forest Animals
Forest Animals Грунт для биологической очистки, для аквариумных растений, для естественной красоты
Грунт для биологической очистки, для аквариумных растений, для естественной красоты Доказательства эволюции
Доказательства эволюции Алкогольді мастықты талдаудың физико-химиялық әдістері
Алкогольді мастықты талдаудың физико-химиялық әдістері Основные этапы происхождения жизни на Земле
Основные этапы происхождения жизни на Земле