Содержание
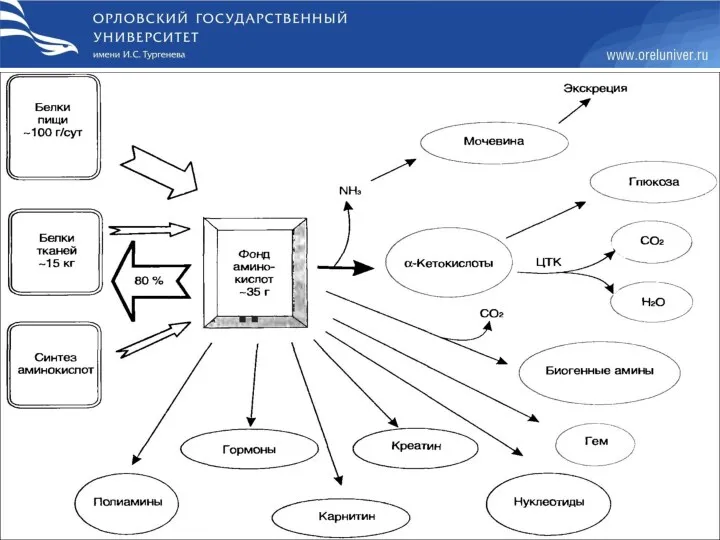
- 2. Фонд свободных АК (аминокислот) организма составляет примерно 35 г. Содержание свободных АК в крови в среднем
- 4. % Количество белка в некотрых продуктах
- 5. Все 20 АК, которые встречаются в белках организма, можно разделить на 4 группы: Заменимые АК Ала,
- 6. Недостаточность белкового питания приводит к заболеванию («красный мальчик»). Заболевание развивается при недостатке Лиз. Характеристика: Задержка роста
- 7. - разница между количеством N, поступающего с пищей, и количеством выделяемого N (в виде мочевины и
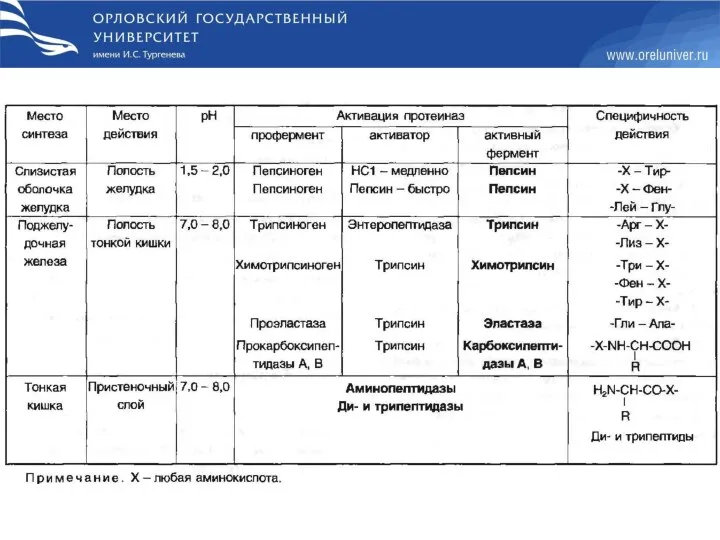
- 8. При переваривании происходит гидролиз пищевых белков до свободных АК под действием ферментов пептидгидролаз (пептидаз). Пептидазы делятся
- 9. Переваривание начинается в желудке. Профермент пепсиноген вырабатывается главными клетками желудка. Желудочный сок содержит HCl. Функции НСl
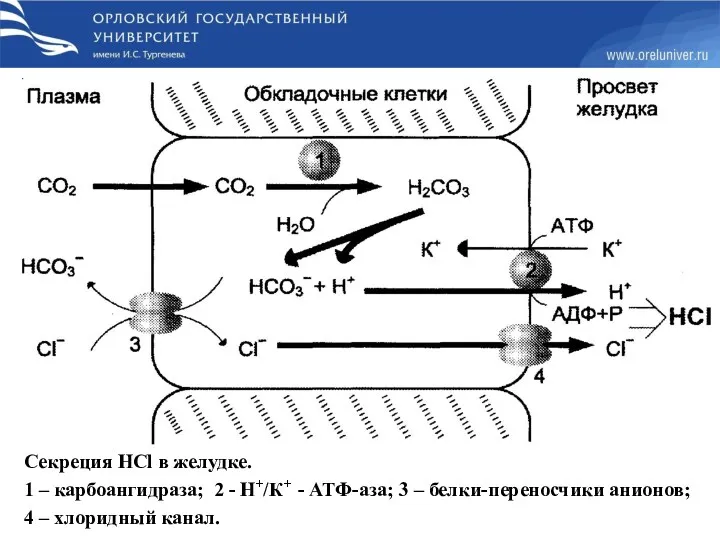
- 10. Секреция HCl в желудке. 1 – карбоангидраза; 2 - Н+/К+ - АТФ-аза; 3 – белки-переносчики анионов;
- 11. фермент желудочного сока детей грудного возраста, который переводит казеин молока в нерастворимый сгусток, чем предотвращает быстрый
- 12. Определение кислотности желудочного сока используют для диагностики различных заболеваний желудка. Повышенная кислотность – сопровождается изжогой, диареей,
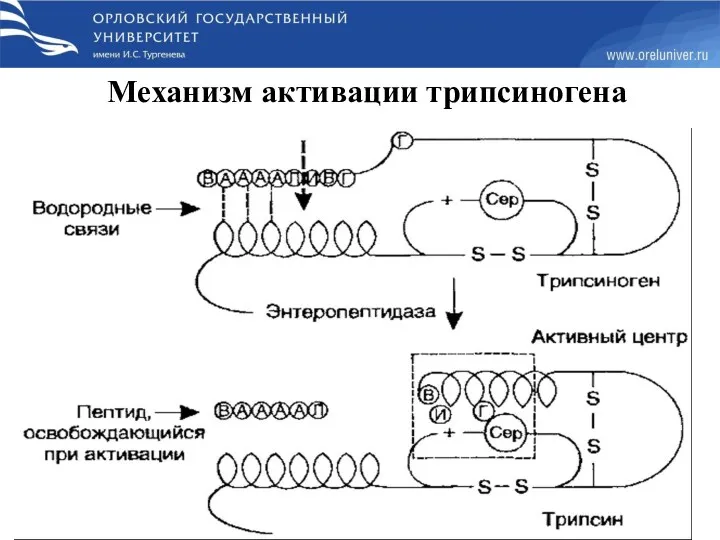
- 13. Механизм активации трипсиногена
- 14. Переваривание белков в кишечнике происходит под действием: Ферментов поджелудочной железы(трипсина, химотрипсина, эластазы, карбоксипептидазы) Ферментов тонкой кишки
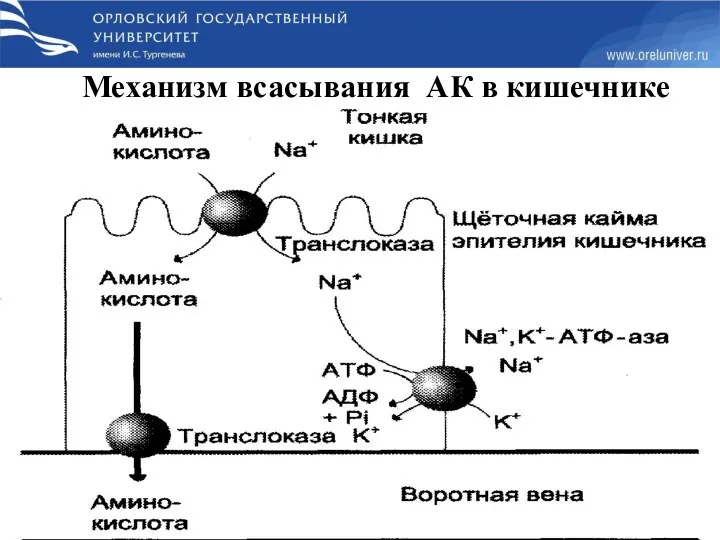
- 15. Механизм всасывания АК в кишечнике
- 17. Реакции характерные для АК: Трансаминирование Дезаминирование Декарбоксилирование Биосинтез Рацемизация (для микроорганизмов, синтез Д-изомеров)
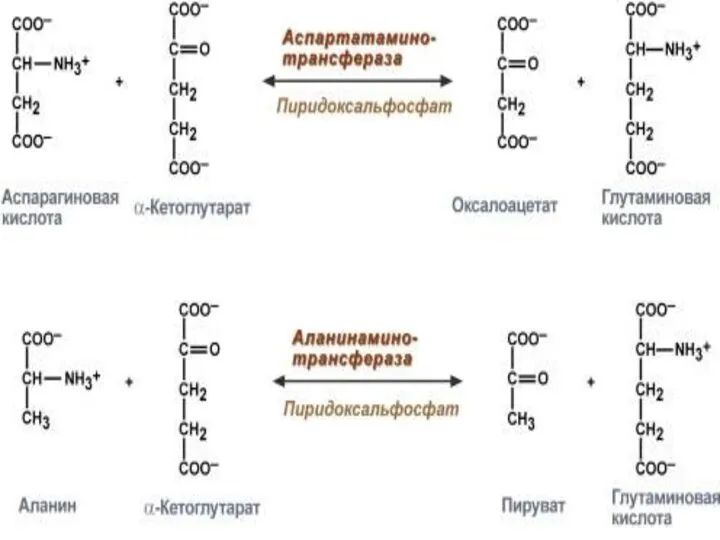
- 18. Это реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту без промежуточного образования NH3 . Реакцию катализируют ферменты
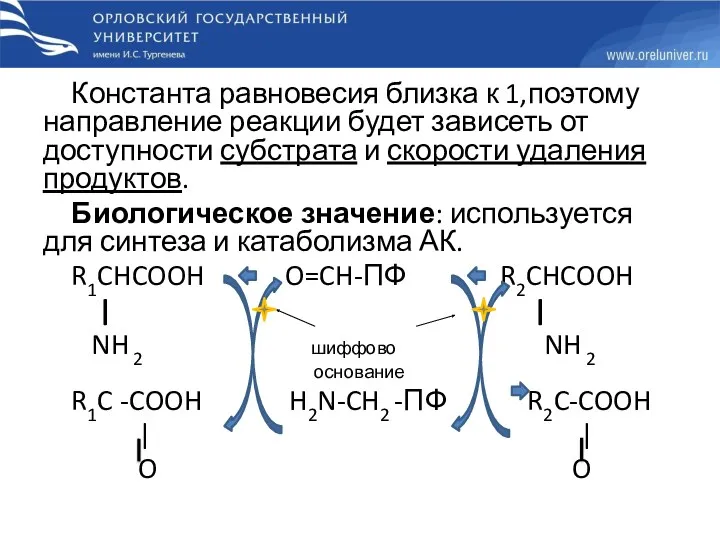
- 20. Константа равновесия близка к 1,поэтому направление реакции будет зависеть от доступности субстрата и скорости удаления продуктов.
- 21. АЛТ-маркерный фермент печени. АСТ-маркерный фермент сердечной мышцы. В норме: АЛТ = 0,1-0,68 мкмоль/час мл АСТ =
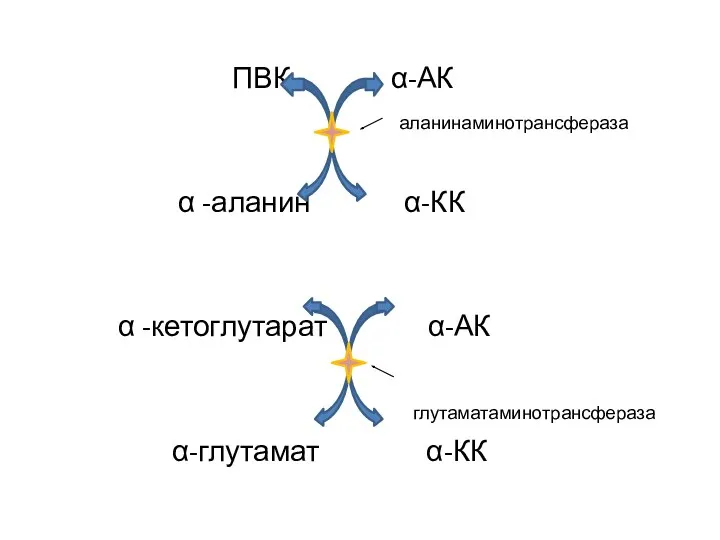
- 22. ПВК α-АК аланинаминотрансфераза α -аланин α-КК α -кетоглутарат α-АК глутаматаминотрансфераза α-глутамат α-КК
- 23. -это реакция отщепления α-аминогруппы от аминокислоты и выделение её в форме NH3 . Дезаминирование Прямое Непрямое
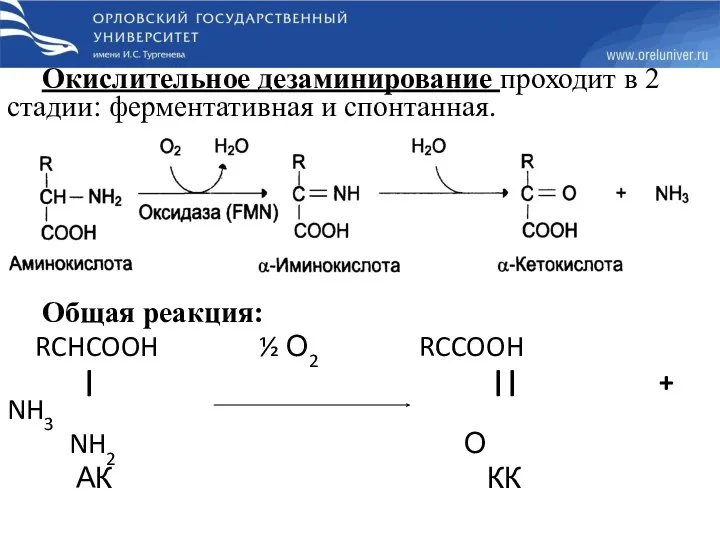
- 24. Окислительное дезаминирование проходит в 2 стадии: ферментативная и спонтанная. Общая реакция: RCHCOOH ½ О2 RCCOOH |
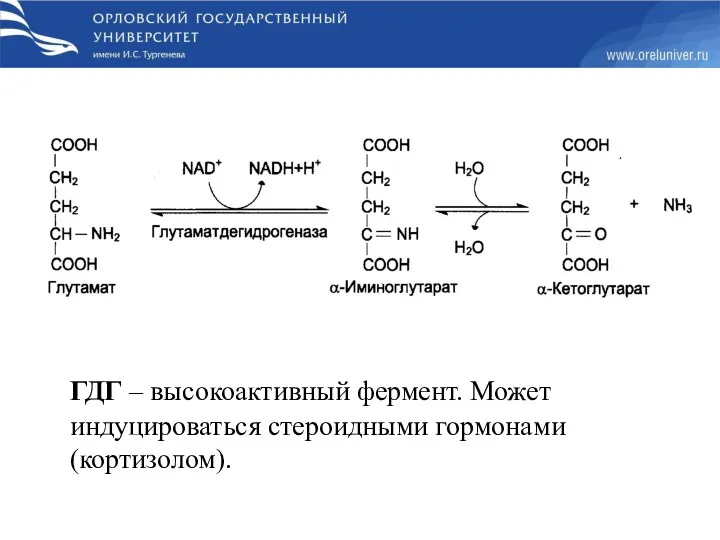
- 25. ГДГ – высокоактивный фермент. Может индуцироваться стероидными гормонами (кортизолом).
- 26. Неокислительное дезаминирование : Восстановительное R-CH-COOH R- CH2-COOH + NH3 | + 2Н NH2 Гидролитическое R-CH-COOH R
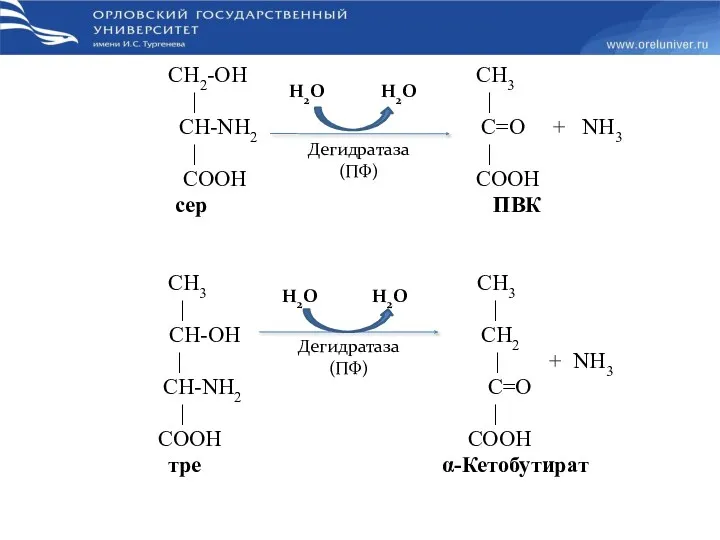
- 27. СН2-OH СН3 | | СН-NН2 С=O + NН3 | | СООН COOH сер ПВК СН3 СН3
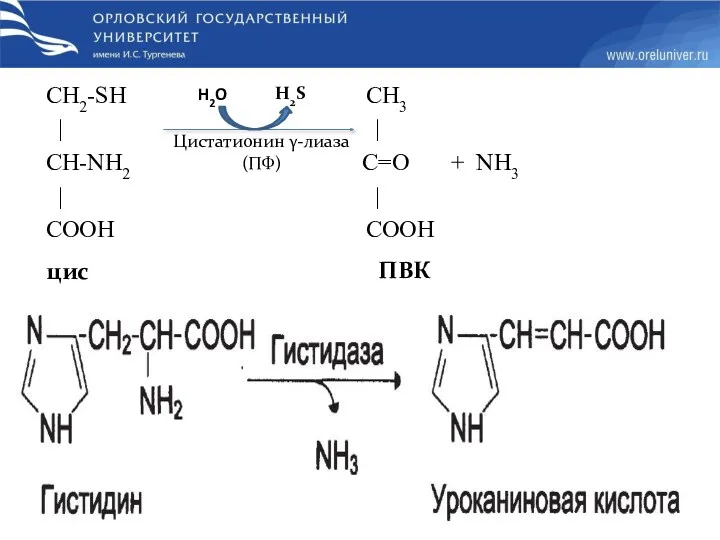
- 28. СН2-SH СН3 | | CH-NН2 С=O + NН3 | | COOH COOH цис ПВК Цистатионин γ-лиаза
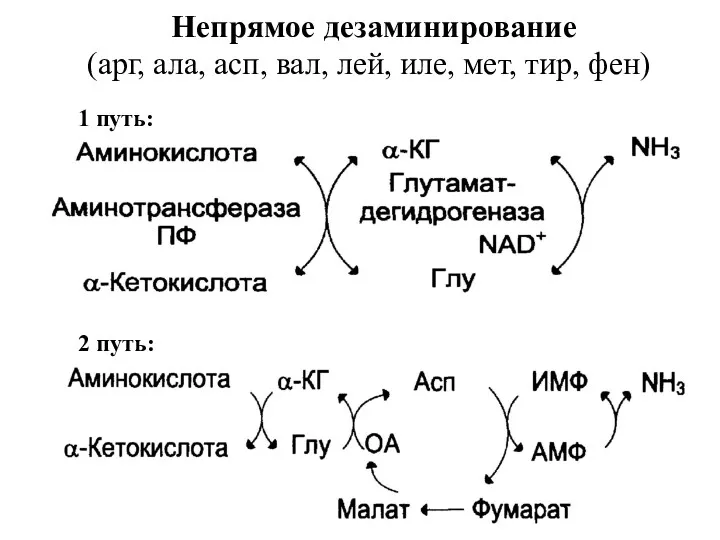
- 29. Непрямое дезаминирование (арг, ала, асп, вал, лей, иле, мет, тир, фен) 1 путь: 2 путь:
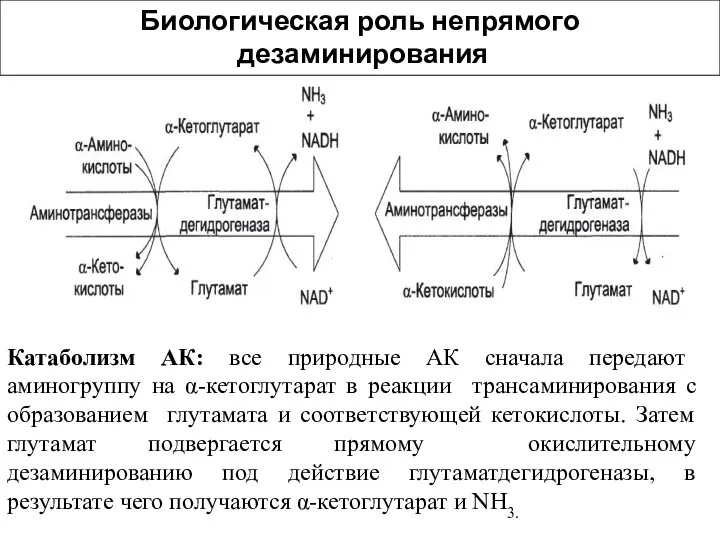
- 30. Катаболизм АК: все природные АК сначала передают аминогруппу на α-кетоглутарат в реакции трансаминирования с образованием глутамата
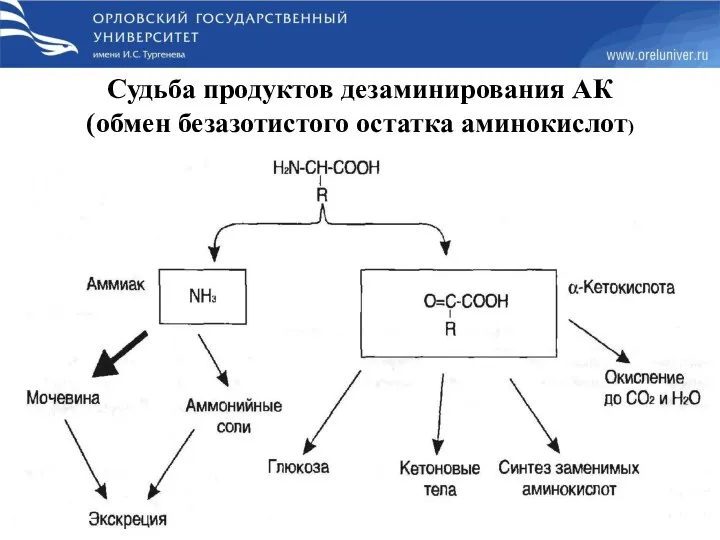
- 31. Судьба продуктов дезаминирования АК (обмен безазотистого остатка аминокислот)
- 32. Гликогенные и кетогенные аминокислоты Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат)
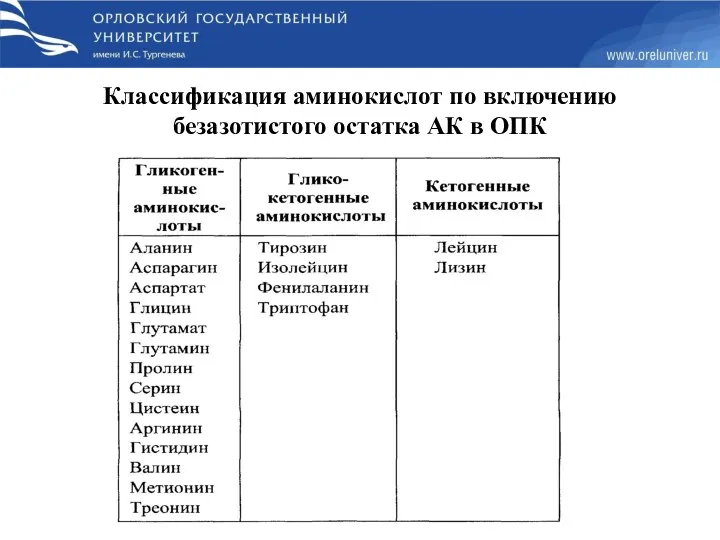
- 33. Классификация аминокислот по включению безазотистого остатка АК в ОПК
- 34. Анаплеротические реакции- это реакции, которые используются для восполнения метаболитов ОПК при затрате их на синтез БАВ.
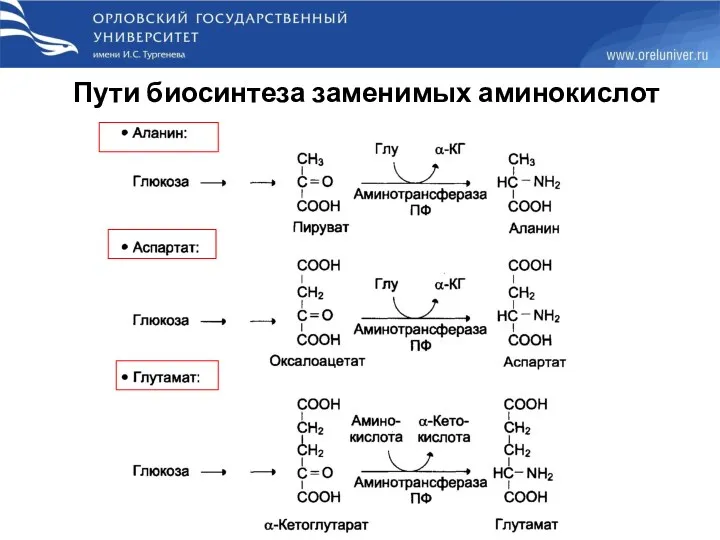
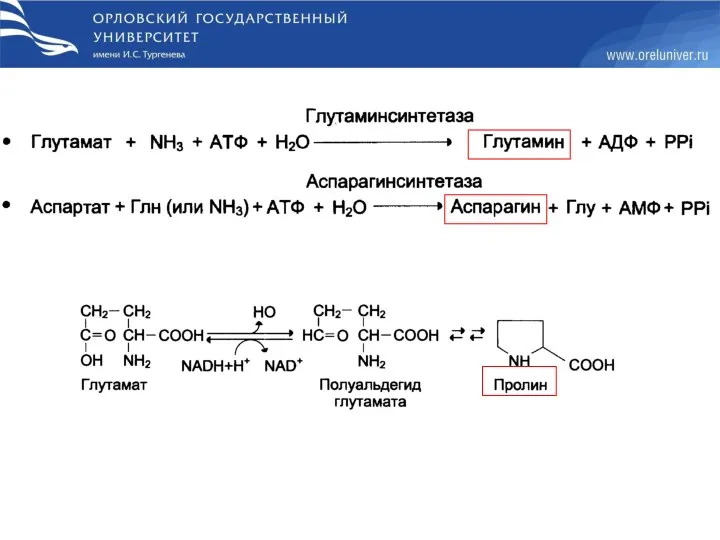
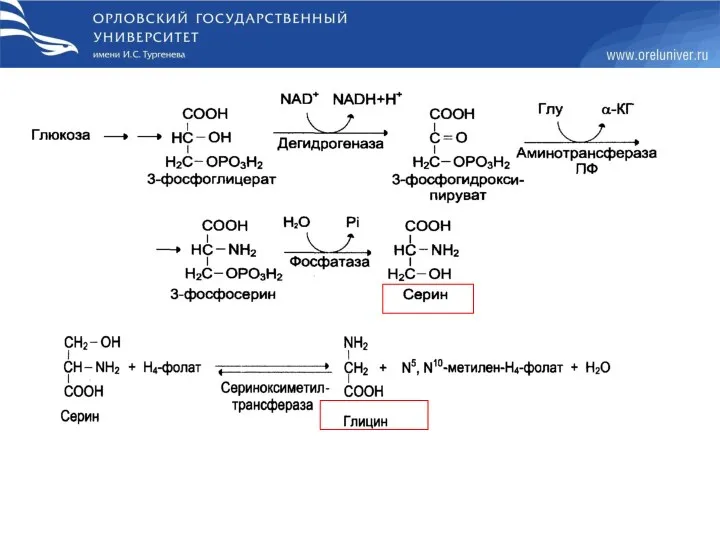
- 35. Пути биосинтеза заменимых аминокислот
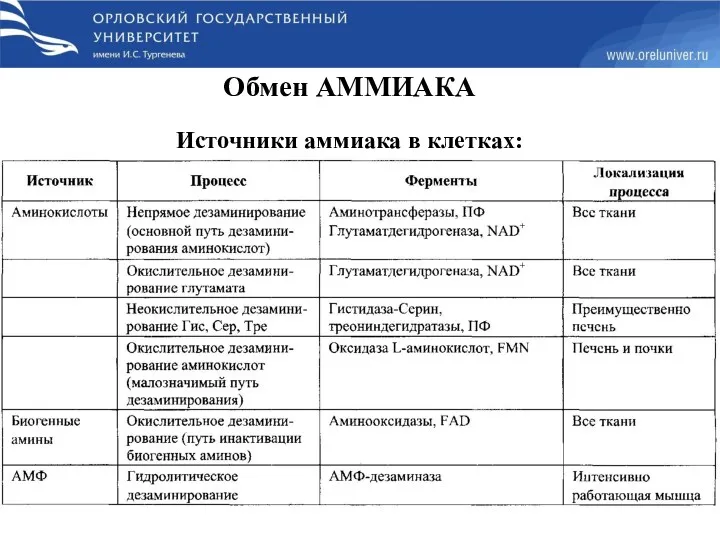
- 38. Обмен аммиака
- 39. Содержание аммиака в крови в норме 0,4-0,7 мг/л или 25-40 мкмоль/л. Причины токсичности аммиака. Увеличение концентрации
- 40. Обмен АММИАКА Источники аммиака в клетках:
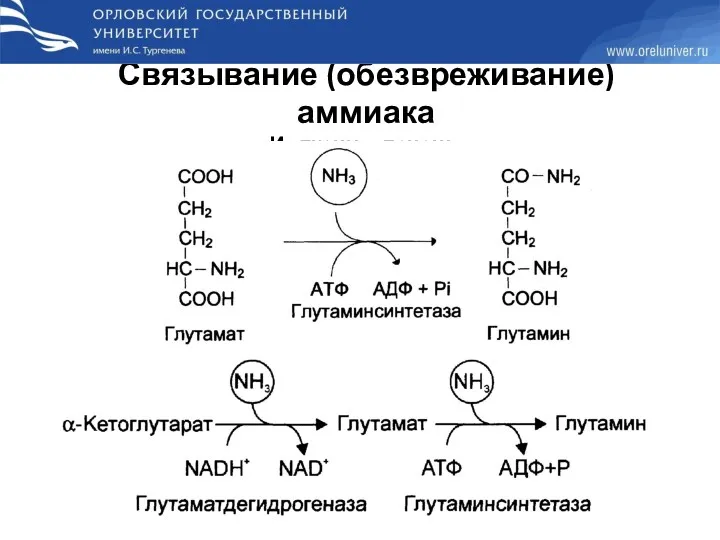
- 41. Связывание (обезвреживание) аммиака Из ткани в печень:
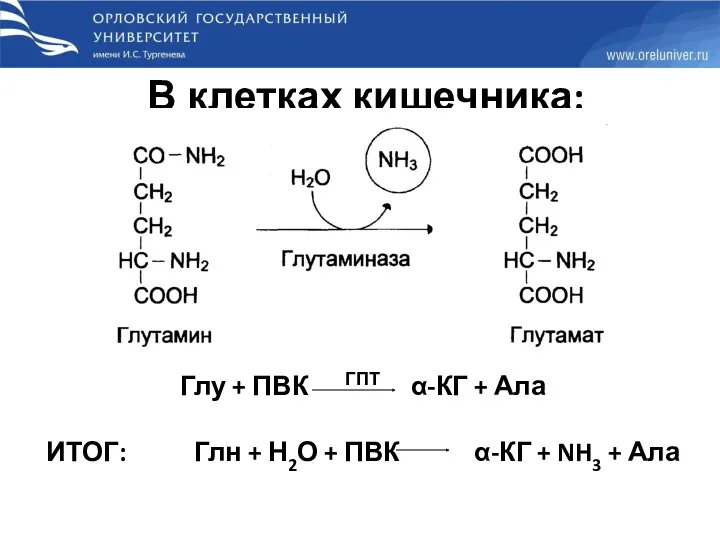
- 42. В клетках кишечника: Глу + ПВК ГПТ α-КГ + Ала ИТОГ: Глн + Н2О + ПВК
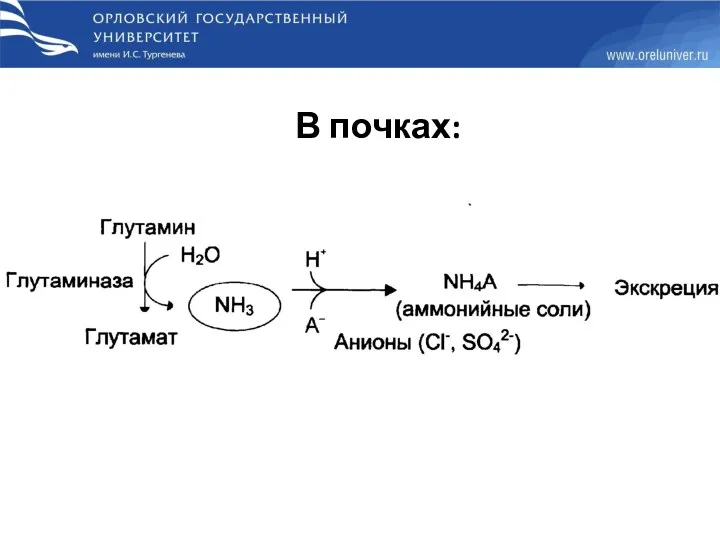
- 43. В почках:
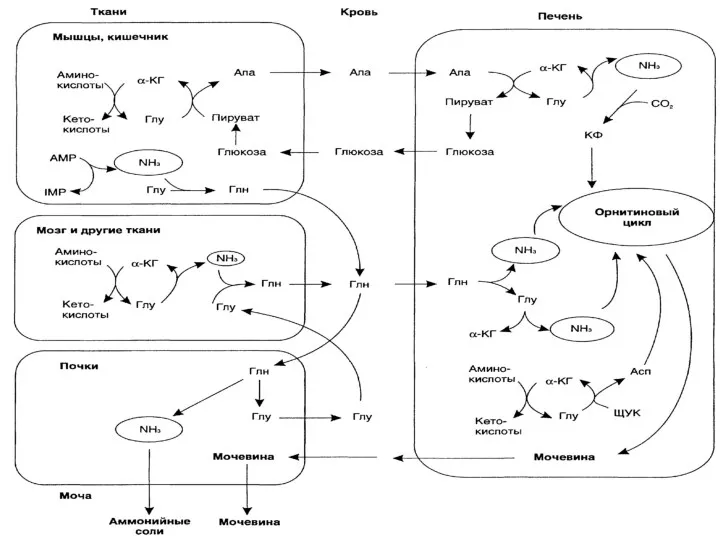
- 45. Биосинтез мочевины
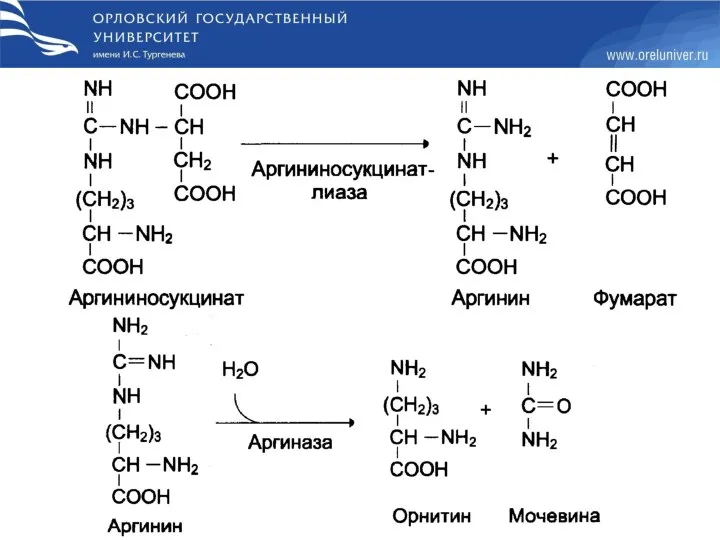
- 47. Пути азота аминокислот в орнитиновый цикл Кребса-Гензелейта Карбамоилфосфатсинтетаза I (мит.) Орнитинкарбамоилтрансфераза Аргининосукцинатсинтетаза Аргининосукцинатлиаза Аргиназа малатгедиррогеназа Аминотрансфераза
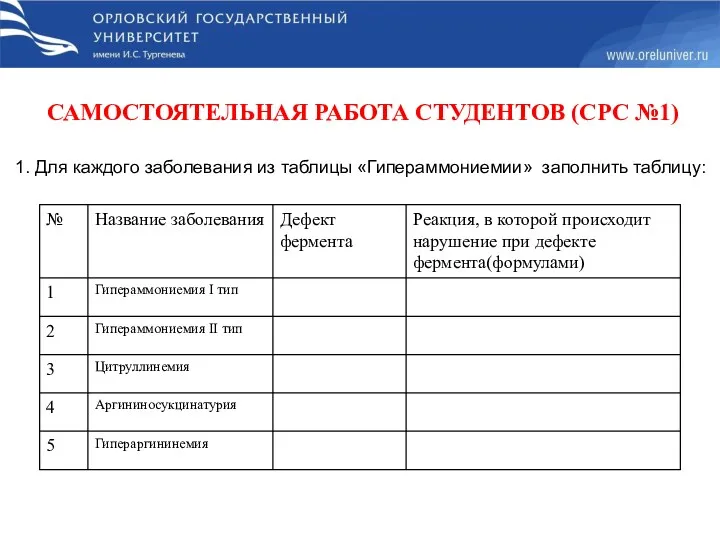
- 48. Гипераммониемии – повышенное содержание аммиака в крови, вызванное заболеваниями печени или наследственным дефектом ферментов обезвреживания. NH3
- 49. САМОСТОЯТЕЛЬНАЯ РАБОТА СТУДЕНТОВ (СРС №1) 1. Для каждого заболевания из таблицы «Гипераммониемии» заполнить таблицу:
- 50. Клиническая картина недостаточности карбамоилфосфатсинтетазы I проявляется при рождении (летальная форма) или позже (более мягкое течение): гипотрофия;
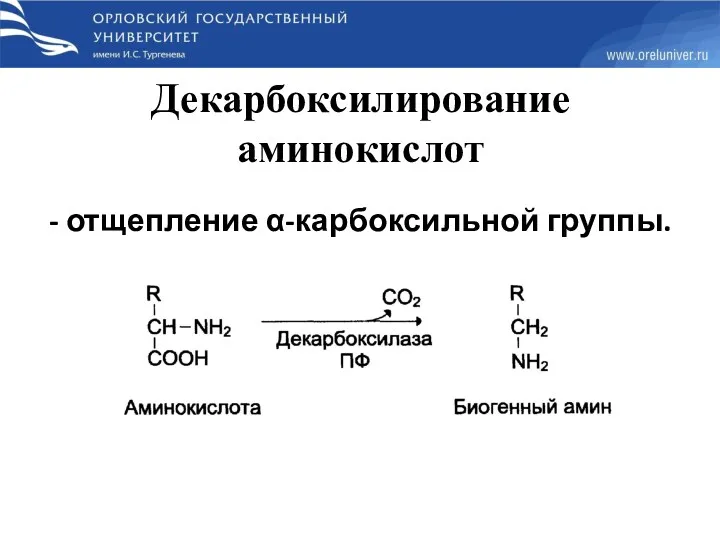
- 51. Декарбоксилирование аминокислот - отщепление α-карбоксильной группы.
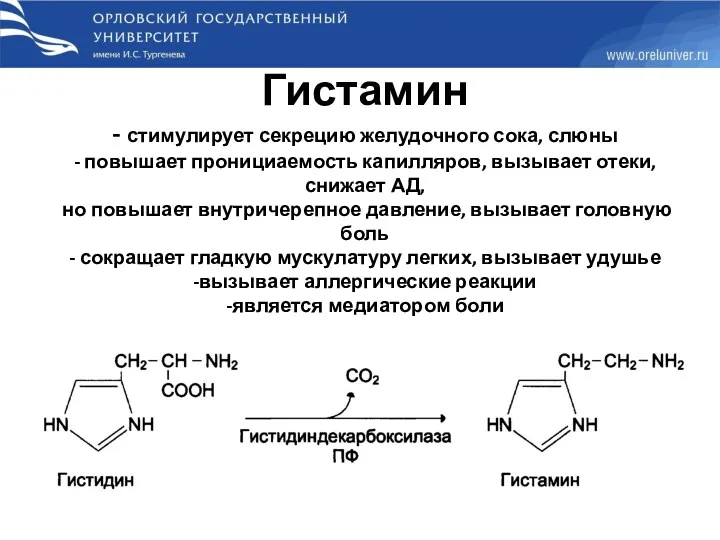
- 52. Биогенные амины Биогенные амины — вещества, обычно образующиеся в организме животных или растений из аминокислот при
- 53. Гистамин - стимулирует секрецию желудочного сока, слюны - повышает пронициаемость капилляров, вызывает отеки, снижает АД, но
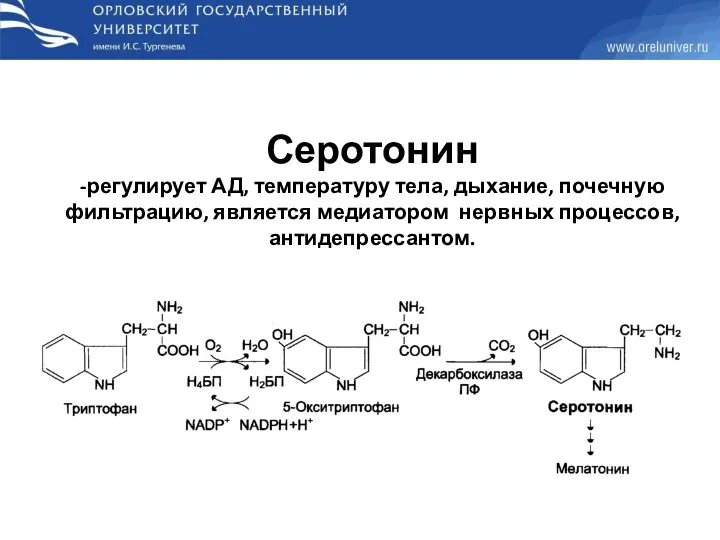
- 54. Серотонин -регулирует АД, температуру тела, дыхание, почечную фильтрацию, является медиатором нервных процессов, антидепрессантом.
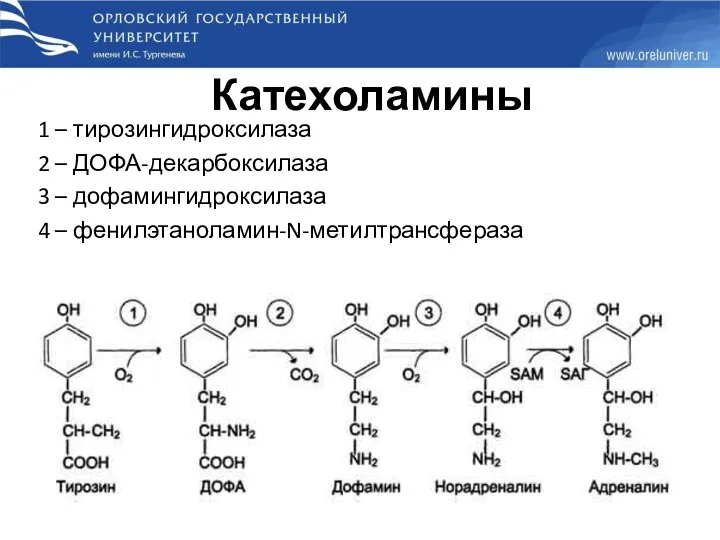
- 55. Катехоламины 1 – тирозингидроксилаза 2 – ДОФА-декарбоксилаза 3 – дофамингидроксилаза 4 – фенилэтаноламин-N-метилтрансфераза
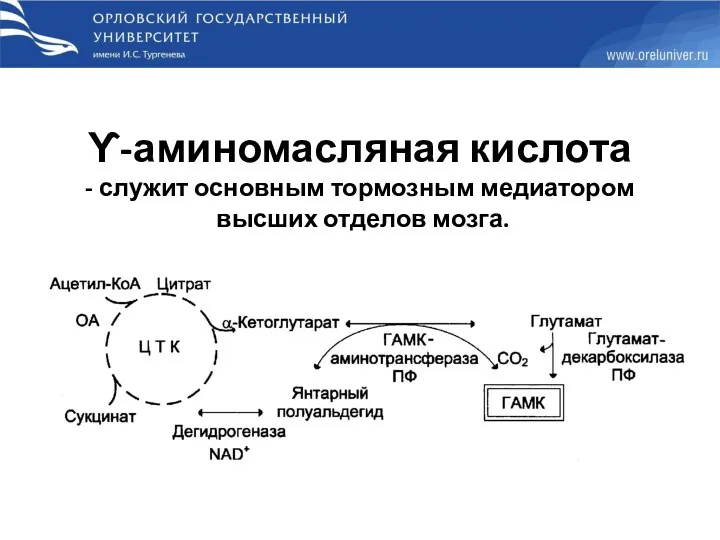
- 56. ϒ-аминомасляная кислота - служит основным тормозным медиатором высших отделов мозга.
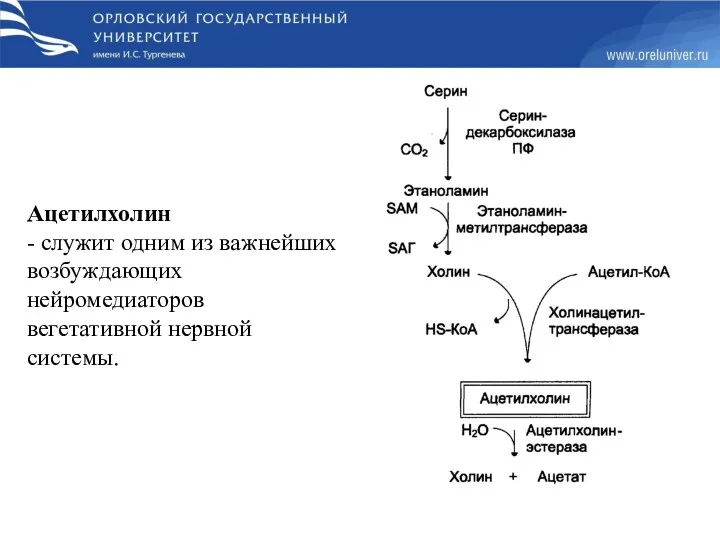
- 57. Ацетилхолин - служит одним из важнейших возбуждающих нейромедиаторов вегетативной нервной системы.
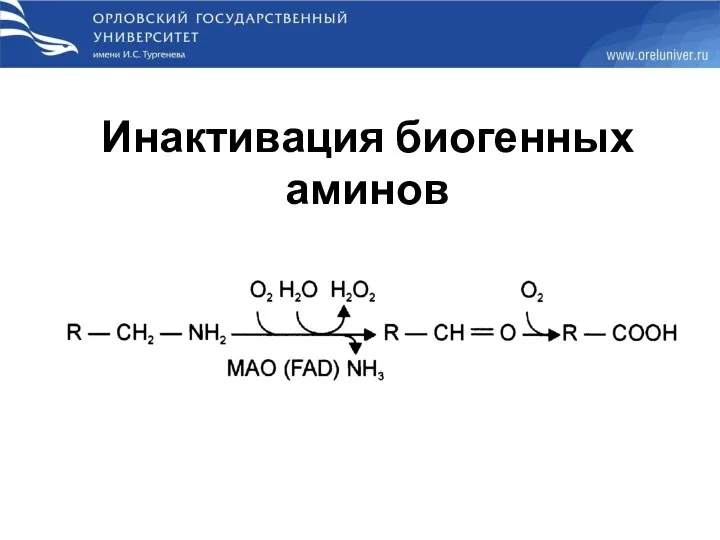
- 58. Инактивация биогенных аминов
- 59. Полиамины синтезируются из орнитина и S-аденозилметионина. Метионин - незаменимая аминокислота. Необходима для синтеза белков организма, участвует
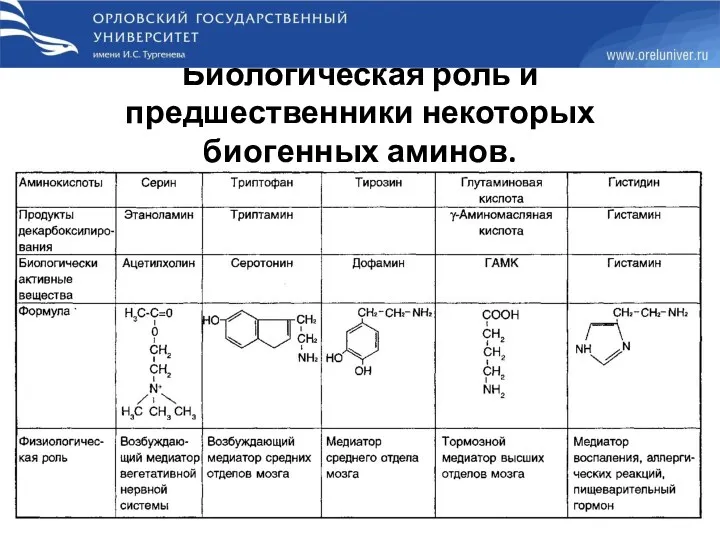
- 60. Биологическая роль и предшественники некоторых биогенных аминов.
- 61. ОБМЕН ОТДЕЛЬНЫХ АМИНОКИСЛОТ
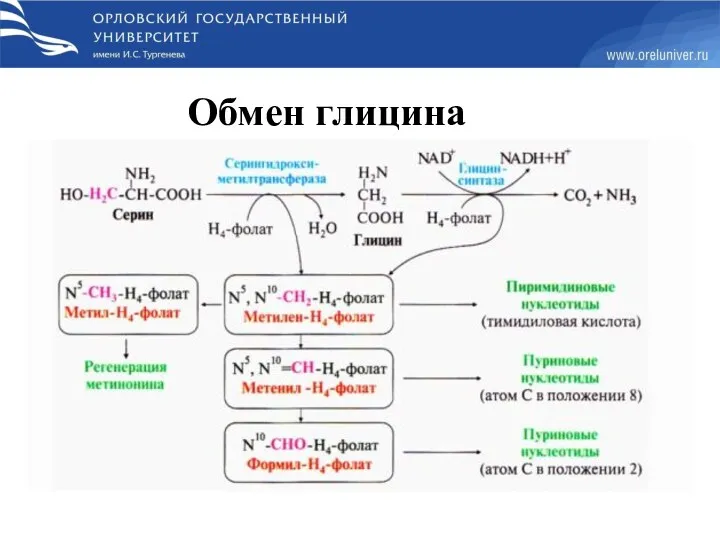
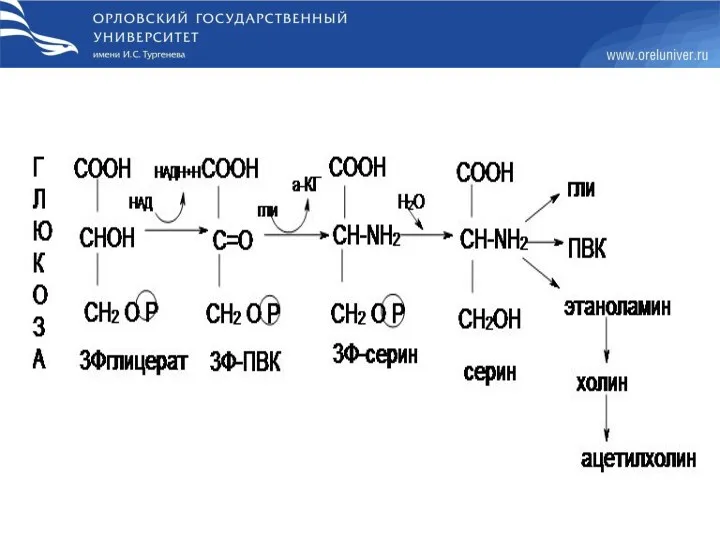
- 62. Обмен глицина
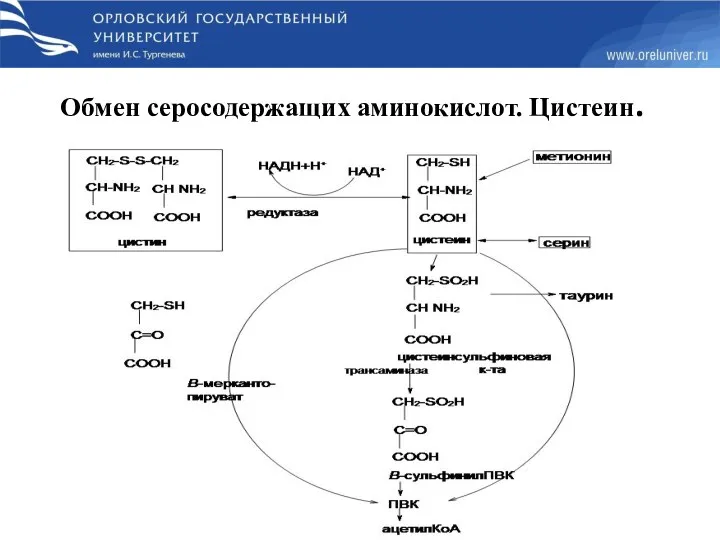
- 64. Обмен серосодержащих аминокислот. Цистеин.
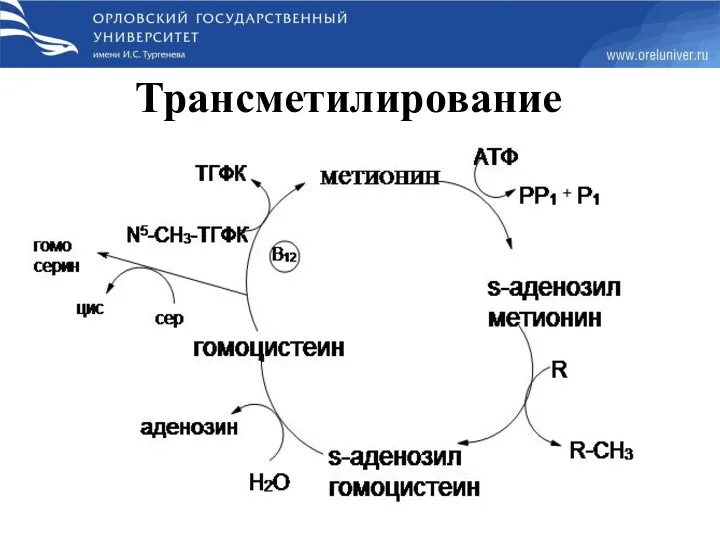
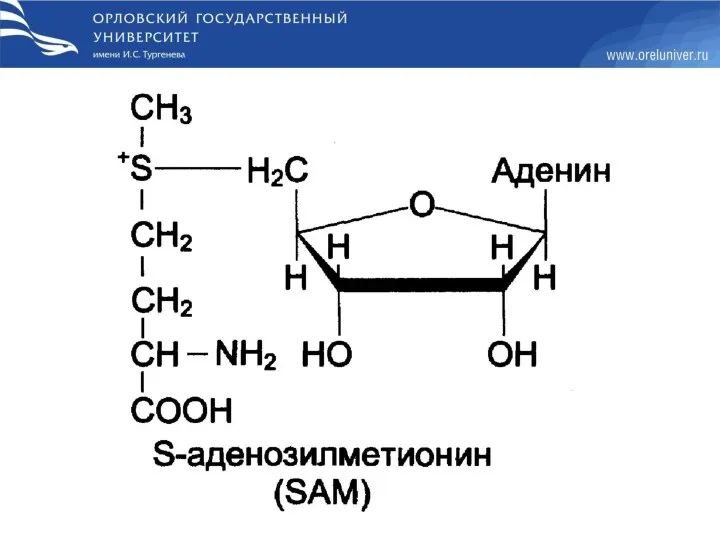
- 65. Трансметилирование
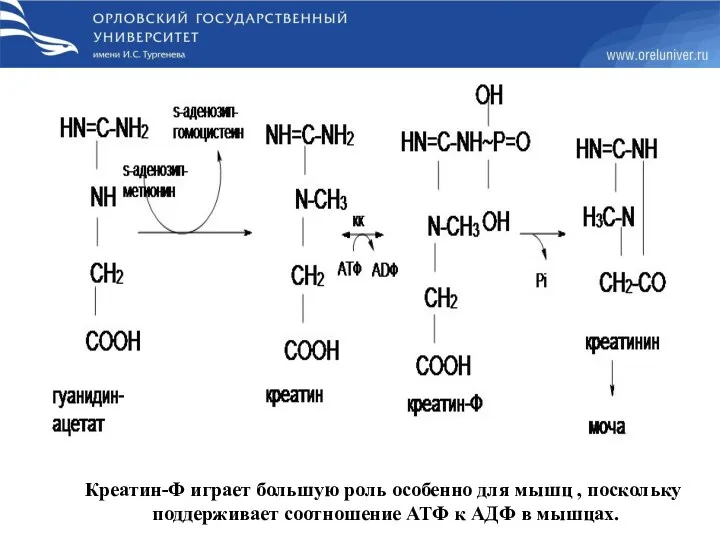
- 67. Синтез креатина Протекает в 2х органах : почках и печени
- 68. Креатин-Ф играет большую роль особенно для мышц , поскольку поддерживает соотношение АТФ к АДФ в мышцах.
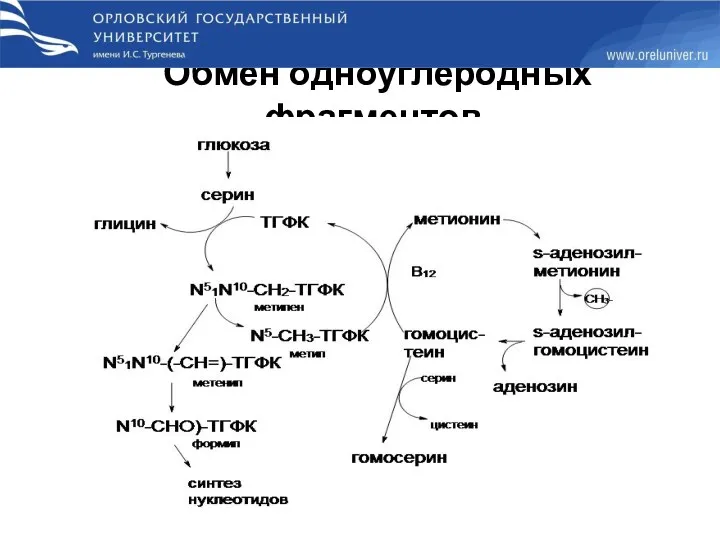
- 69. Обмен одноуглеродных фрагментов.
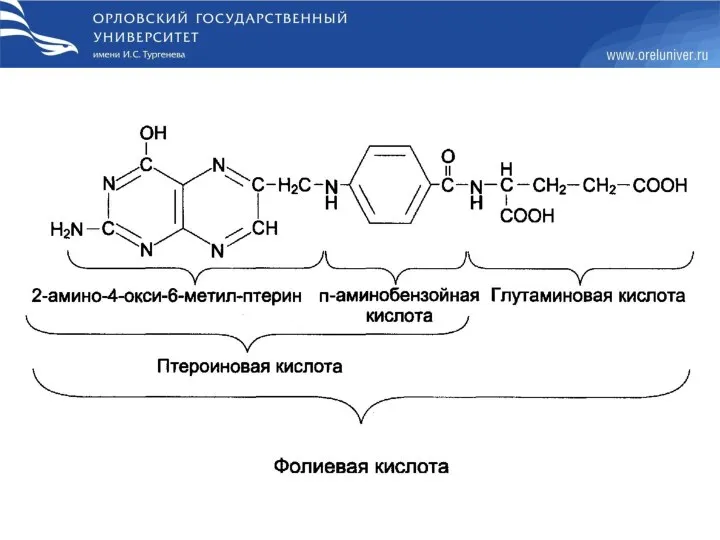
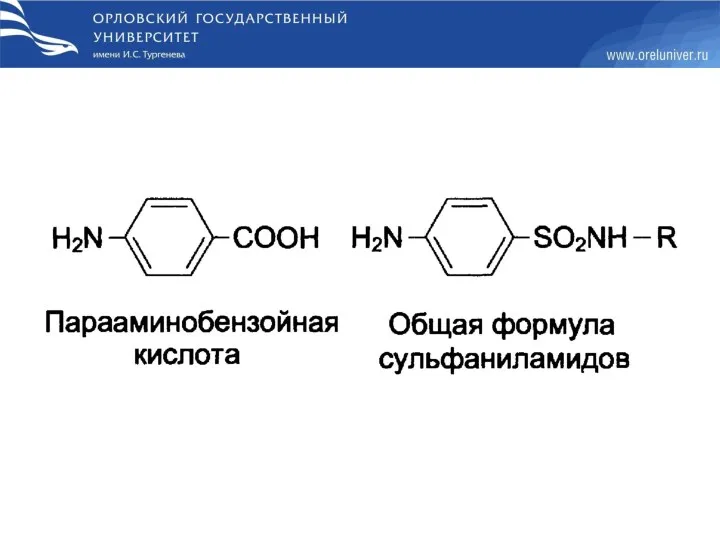
- 71. Недостаточность фолиевой кислоты Недостаточность фолиевой кислоты у человека возникает редко. Гиповитаминоз фолиевой кислоты приводит к нарушению
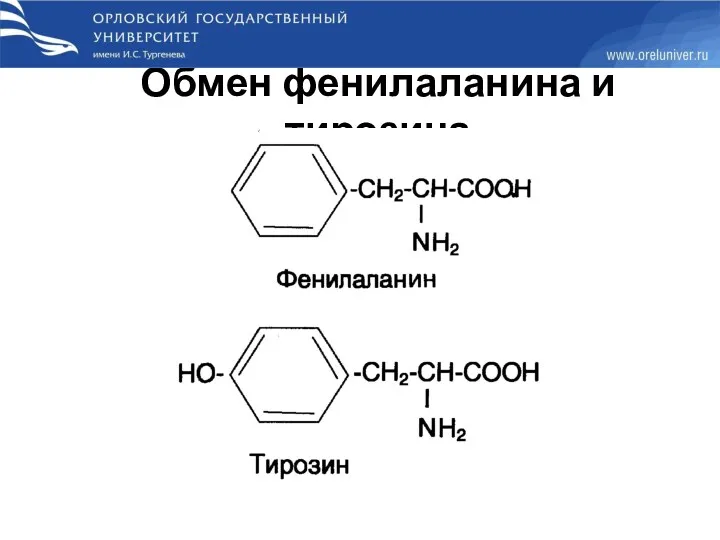
- 73. Обмен фенилаланина и тирозина
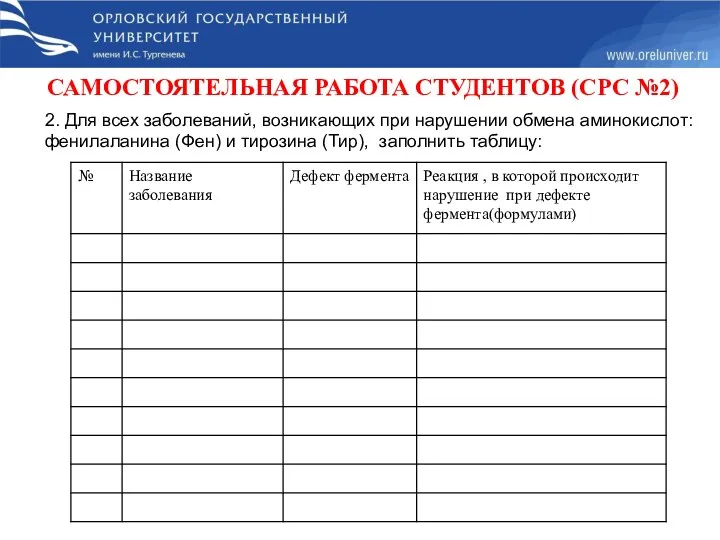
- 75. САМОСТОЯТЕЛЬНАЯ РАБОТА СТУДЕНТОВ (СРС №2) 2. Для всех заболеваний, возникающих при нарушении обмена аминокислот: фенилаланина (Фен)
- 76. Фенилкетонурия Классическая ФКУ - наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы, которые приводят к снижению
- 77. Симптомы фенилкетонурии: Ребенок умственно отсталый, возбудим, своеобразная походка, осанка и поза при сидении, конечности находятся в
- 78. Тирозинемии Тирозинемия типа I (тирозиноз). Причиной заболевания является, вероятно, дефект фермента фумарилацетоацетатгидролазы, катализирующего расщепление фумарилацетоа-цетата на
- 79. Тирозинемия типа II (синдром Рихнера-Ханхорта). Причина - дефект фермента тирозинаминотрансферазы. Концентрация тирозина в крови больных повышена.
- 80. Алкаптонурия ("чёрная моча") Причина заболевания - дефект диоксигеназы гомогентизиновой кислоты. Для этой болезни характерно выделение с
- 81. Альбиниз Причина метаболического нарушения - врождённый дефект тирозиназы. Этот фермент катализирует превращение тирозина в ДОФА в
- 82. Болезнь Паркинсона Заболевание развивается при недостаточности дофамина в чёрной субстанции мозга. При этой патологии снижена активность
- 84. Болезнь мочи кленового сиропа БМКС вызвана дефицитом комплекса дегидрогеназы альфа-кетокислот с разветвленной цепью, вследствие чего в
- 85. Болезнь Вильсона-Коновалова - врождённое нарушение метаболизма меди, приводящее к тяжелейшим наследственным болезням центральной нервной системы и
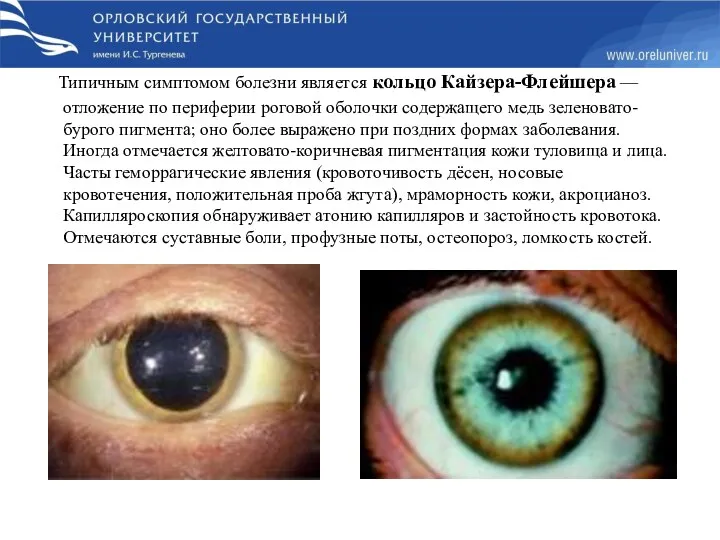
- 86. Типичным симптомом болезни является кольцо Кайзера-Флейшера — отложение по периферии роговой оболочки содержащего медь зеленовато-бурого пигмента;
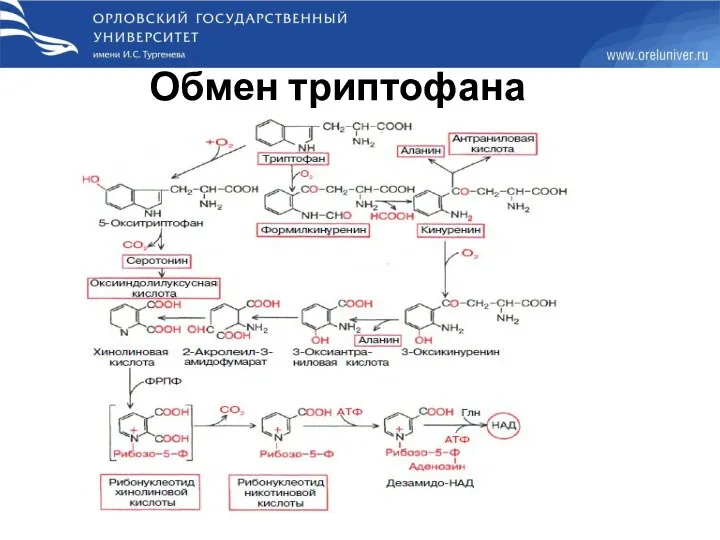
- 87. Обмен триптофана
- 89. Скачать презентацию





































 Весенние цветы. Занятия по развитию речи (начальная школа)
Весенние цветы. Занятия по развитию речи (начальная школа) Биология, как наука. Методы исследования
Биология, как наука. Методы исследования Биология развития
Биология развития Лист - часть побега. Внешнее и внутреннее строение листа
Лист - часть побега. Внешнее и внутреннее строение листа Лекции по нормальной физиологии
Лекции по нормальной физиологии Готовимся к ВПР по биологии в 6 классе №4 Свойства живых организмов
Готовимся к ВПР по биологии в 6 классе №4 Свойства живых организмов Реактивність та резистентність. Поняття про імунітет. Імунопрофілактика
Реактивність та резистентність. Поняття про імунітет. Імунопрофілактика Многолетние сухоцветы
Многолетние сухоцветы Строение и свойства белков
Строение и свойства белков Молекулярно-генетические механизмы. Постэмбриональный онтогенез
Молекулярно-генетические механизмы. Постэмбриональный онтогенез Приспособительные особенности строения, окраски тела и поведения животных
Приспособительные особенности строения, окраски тела и поведения животных Строение вещества
Строение вещества Регуляция обменных процессов. Гормоны
Регуляция обменных процессов. Гормоны Игра Найти лишнее. 6 класс
Игра Найти лишнее. 6 класс Особенности строения представителей надкласса Рыбы. 2
Особенности строения представителей надкласса Рыбы. 2 Суган кабыгы ярысыннан препарат әзерләү һәм аны микроскоп аша карау
Суган кабыгы ярысыннан препарат әзерләү һәм аны микроскоп аша карау Железы внешней секреции
Железы внешней секреции Наследование признаков, сцепленных с полом. (Задачи № 326, 340, 353)
Наследование признаков, сцепленных с полом. (Задачи № 326, 340, 353) Физиология сенсорных рецепторов. Лекция № 26
Физиология сенсорных рецепторов. Лекция № 26 Биотические экологические факторы
Биотические экологические факторы Масло-какао
Масло-какао Ультраструктура бактериальной клетки
Ультраструктура бактериальной клетки Половое размножение. Оплодотворение, его значение (10 класс)
Половое размножение. Оплодотворение, его значение (10 класс) Ощущение и восприятие. Нейрофизиологические механизмы восприятия
Ощущение и восприятие. Нейрофизиологические механизмы восприятия Сонце. Чи всьому живому потрібно? Досліджуємо вплив світла. Урок №30. Я досліджую світ
Сонце. Чи всьому живому потрібно? Досліджуємо вплив світла. Урок №30. Я досліджую світ Интересные факты о птицах
Интересные факты о птицах Человек, как биологический вид. (Лекция 1)
Человек, как биологический вид. (Лекция 1) Тип Моллюски
Тип Моллюски