Содержание
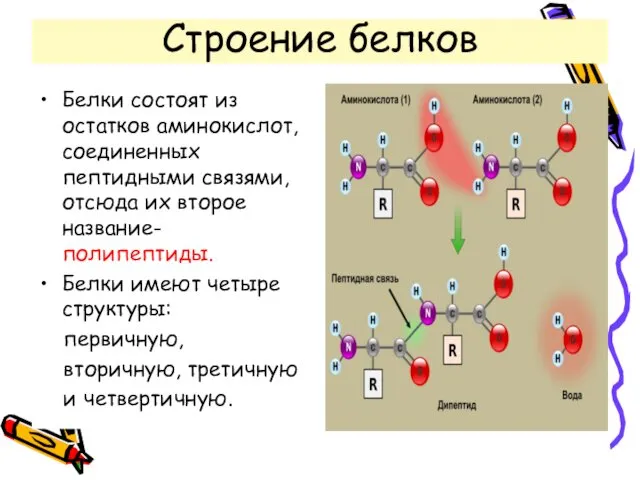
- 3. Строение белков Белки состоят из остатков аминокислот, соединенных пептидными связями, отсюда их второе название- полипептиды. Белки
- 4. В белке следующие химические элементы: углерод, водород, азот, кислород, сера. Некоторые белки содержат: фосфор, железо, цинк
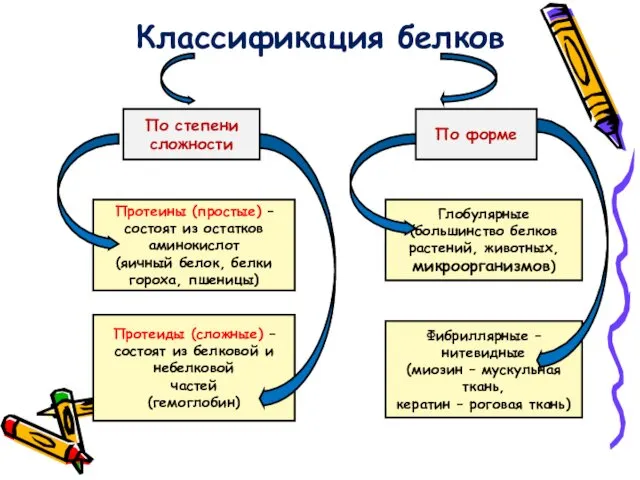
- 5. Классификация белков По степени сложности По форме Протеины (простые) – состоят из остатков аминокислот (яичный белок,
- 6. Функции белков 1) Структурная (пластическая) – белками образованы многие клеточные компоненты, а в комплексе с липидами
- 7. 3) Транспортная – белок гемоглобин транспортирует кислород, ряд других белков образуя комплекс с липидами транспортируют их
- 8. 5) Регуляторная – ряд гормонов и других биологически активных веществ имеют белковую природу, например, инсулин 6)Защитная
- 9. 7) Опорная – сухожилия, поверхности суставов соединения костей образованы в значительной степени белковыми веществами, например, коллаген,
- 10. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20
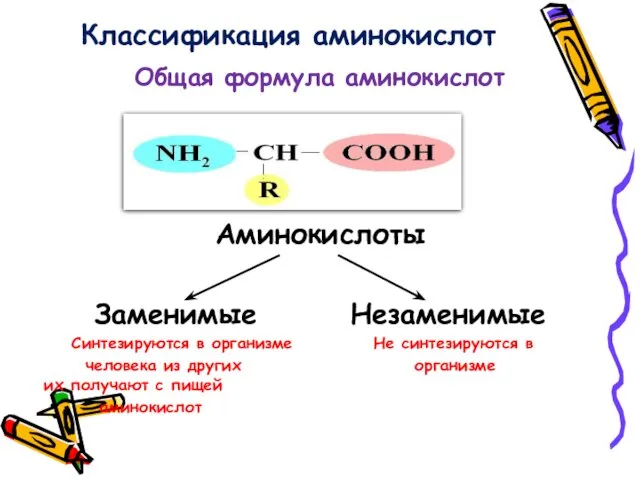
- 11. Общая формула аминокислот Аминокислоты Заменимые Незаменимые Синтезируются в организме Не синтезируются в человека из других организме
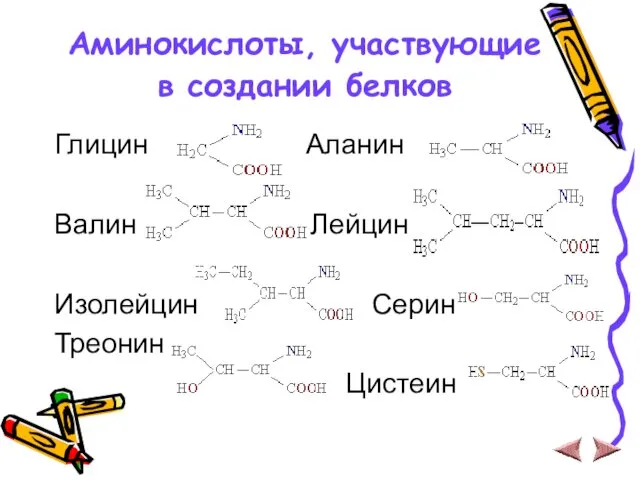
- 12. Аминокислоты, участвующие в создании белков Глицин Аланин Валин Лейцин Изолейцин Серин Треонин Цистеин
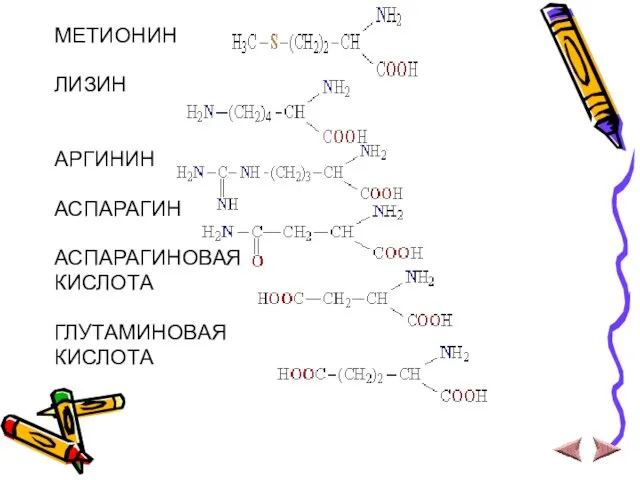
- 13. МЕТИОНИН ЛИЗИН АРГИНИН АСПАРАГИН АСПАРАГИНОВАЯ КИСЛОТА ГЛУТАМИНОВАЯ КИСЛОТА
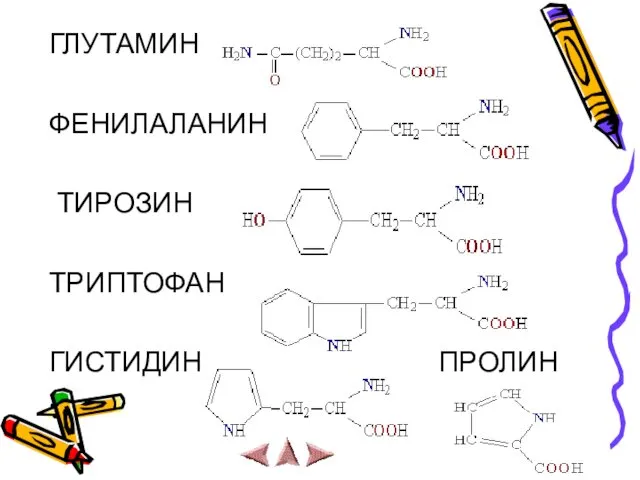
- 14. ГЛУТАМИН ФЕНИЛАЛАНИН ТИРОЗИН ТРИПТОФАН ГИСТИДИН ПРОЛИН
- 15. Строение полипептидной цепи Эта цепь имеет неразветвленное строение и состоит из чередующихся метиновых (CH) и пептидных
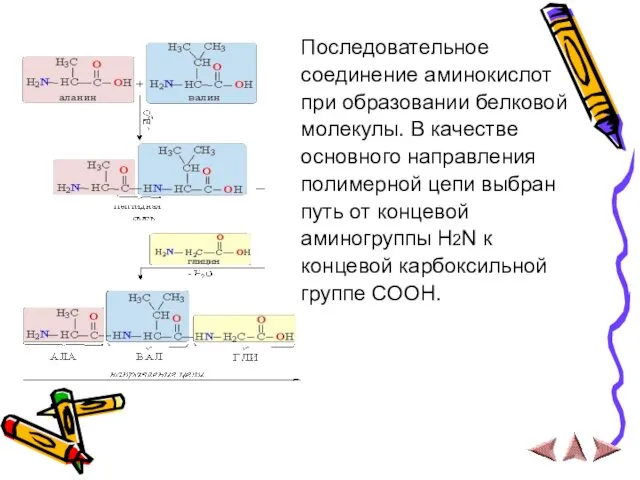
- 16. Последовательное соединение аминокислот при образовании белковой молекулы. В качестве основного направления полимерной цепи выбран путь от
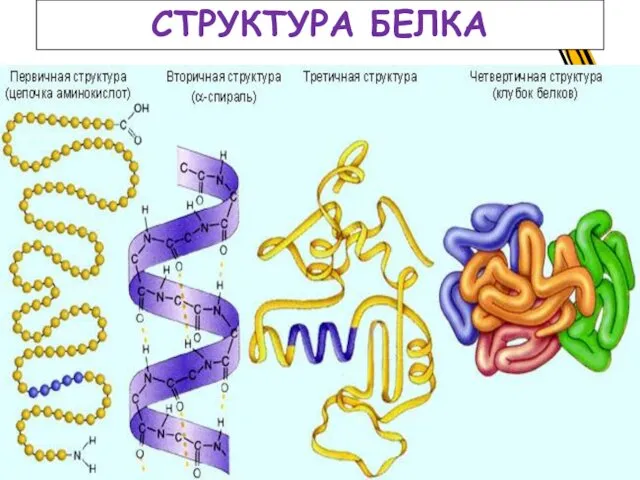
- 17. СТРУКТУРА БЕЛКА
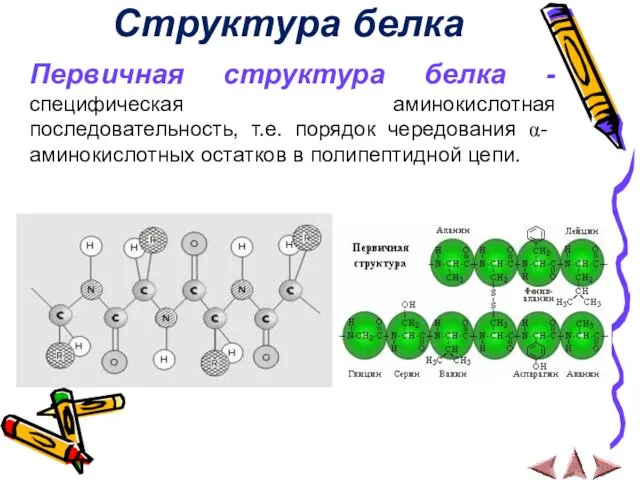
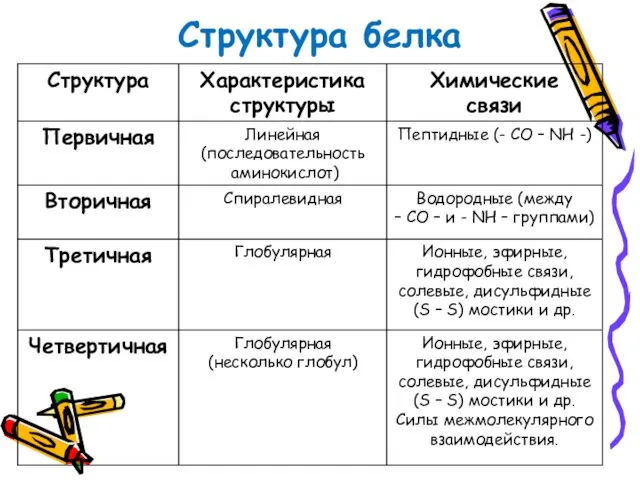
- 18. Структура белка Первичная структура белка - специфическая аминокислотная последовательность, т.е. порядок чередования α- аминокислотных остатков в
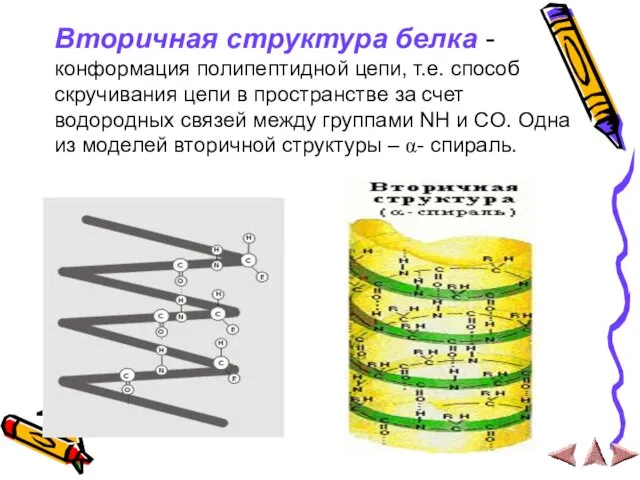
- 19. Вторичная структура белка - конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных
- 20. Третичная структура белка (глобула) - форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных
- 21. Четвертичная структура белка (глобулы) – агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных
- 22. Структура белка
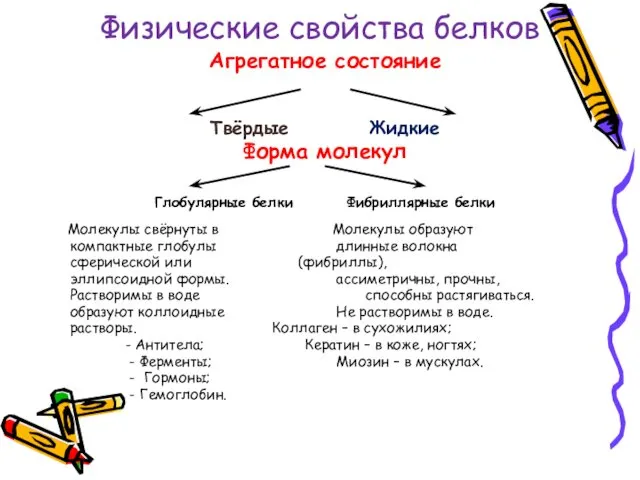
- 23. Агрегатное состояние Твёрдые Жидкие Форма молекул Глобулярные белки Фибриллярные белки Молекулы свёрнуты в Молекулы образуют компактные
- 24. Химические свойства 1) Амфотерность, т.е. способность белков проявлять в зависимости от условий как кислотные, так и
- 25. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно
- 26. 2) Денатурация – это разрушение природной структуры белка под влиянием определённых факторов или раскручивание белка. С
- 27. При действии органических растворителей, продуктов жизнедеятельности некоторых бактерий (молочнокислое брожение) или при повышении температуры происходит разрушение
- 28. Первичная структура белка при денатурации сохраняется. Денатурация может быть обратимой (так называемая, ренатурация) и необратимой. Пример
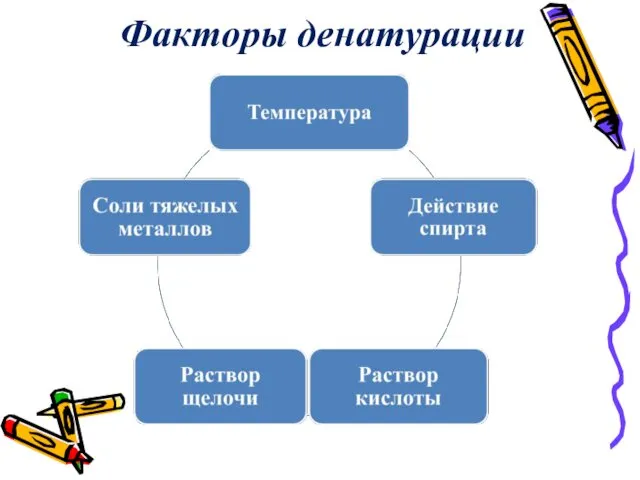
- 29. Факторы денатурации
- 30. Факторы, вызывающие денатурацию Спирт Высокая температура Соли тяжелых металлов
- 31. Денатурация белка сульфатом меди
- 32. Действие серной кислоты на белок
- 33. 3) Гидролиз белков – разрушение первичной структуры белка под действием кислот, щелочей или ферментов, приводящее к
- 34. 4) Качественные реакции на белок: а) Биуретовая реакция – фиолетовое окрашивание при действии солей меди (II)
- 35. б) Ксантопротеиновая реакция – появление желтого окрашивания при действии концентрированной азотной кислоты на белки, содержащие остатки
- 36. 5) Гидратация - способность белков прочно связывать значительное количество влаги; при этом они набухают, их масса
- 37. 6) Пенообразование – способность белков образовывать системы высокой концентрации «жидкость – газ». Их называют пенами.
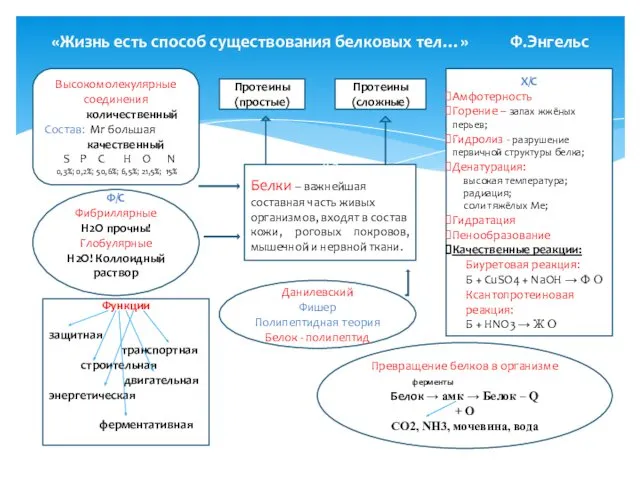
- 38. «Жизнь есть способ существования белковых тел…» Ф.Энгельс Аа Белки – важнейшая составная часть живых организмов, входят
- 39. ПРОДУКТЫ, СОДЕРЖАЩИЕ ЖИВОТНЫЕ БЕЛКИ
- 40. ПРОДУКТЫ, СОДЕРЖАЩИЕ РАСТИТЕЛЬНЫЕ БЕЛКИ
- 41. Превращения белков в организме
- 42. Белки в живом организме постоянно расщепляются на исходные аминокислоты (с непременным участием ферментов), одни аминокислоты переходят
- 44. Скачать презентацию


























 Genetic enginnering
Genetic enginnering Генетика. Наследственность. Изменчивость
Генетика. Наследственность. Изменчивость Строение периферического отдела: скелет верхних и нижних конечностей
Строение периферического отдела: скелет верхних и нижних конечностей Elektrofiziologiy
Elektrofiziologiy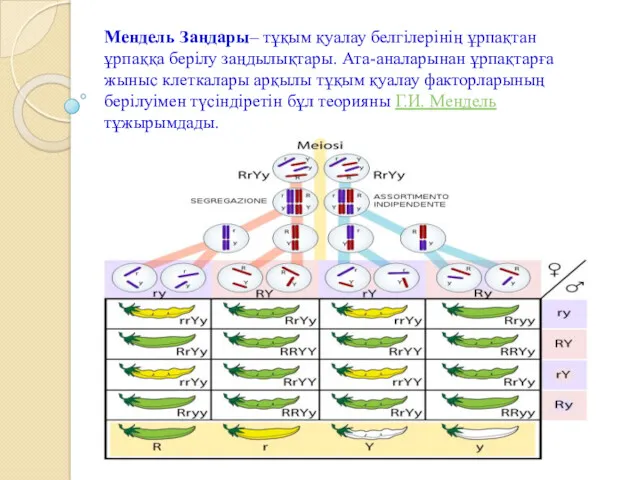 Мендель заңдары
Мендель заңдары Презентация по теме Биоритмы человека
Презентация по теме Биоритмы человека Віддалена гібридизація рослин
Віддалена гібридизація рослин Медузы. Характеристика медуз
Медузы. Характеристика медуз Обмен веществ организмов
Обмен веществ организмов Изо всех земных чудес нам милее русский лес
Изо всех земных чудес нам милее русский лес Питание и пищеварение. Пищеварительная система. Роль ферментов в пищеварении
Питание и пищеварение. Пищеварительная система. Роль ферментов в пищеварении Органы цветкового растения. Корень
Органы цветкового растения. Корень Презентация к уроку Вегетативное размножение растений 6 класс
Презентация к уроку Вегетативное размножение растений 6 класс Факторы патогенности микроорганизмов
Факторы патогенности микроорганизмов Кости и топография черепа. Виды соединения костей
Кости и топография черепа. Виды соединения костей Сенсорні функції організму
Сенсорні функції організму Презентация к внеклассному мероприятию Муравьи- общественные насекомые
Презентация к внеклассному мероприятию Муравьи- общественные насекомые Отличие одноклеточных организмов от многоклеточных. Общая характеристика типа губки
Отличие одноклеточных организмов от многоклеточных. Общая характеристика типа губки Основные белки плазмы крови и диагностическое значение их определения
Основные белки плазмы крови и диагностическое значение их определения Классификация млекопитающих
Классификация млекопитающих 20231023_rasteniya_v_interere_doma
20231023_rasteniya_v_interere_doma Животные весной
Животные весной Формы естественного отбора
Формы естественного отбора Теория эволюции Ч. Дарвина. Формы естественного отбора
Теория эволюции Ч. Дарвина. Формы естественного отбора Метаболизм белков и аминокислот. Образование и обезвреживание аммиака. Тема 13.а
Метаболизм белков и аминокислот. Образование и обезвреживание аммиака. Тема 13.а Кислотно-основні рівноваги в біологічних системах. (Лекція 2)
Кислотно-основні рівноваги в біологічних системах. (Лекція 2) Мой домашний питомец
Мой домашний питомец Урок в 8кл Алкоголь и здоровье
Урок в 8кл Алкоголь и здоровье