Содержание
- 2. Білки Білки – біологічні полімерні молекули, мономерами яких є амінокислоти, з'єднані пептидними зв'язками. Індивідуальність білкових молекул
- 3. Функції білків Каталітична – ферменти Пластична – структурні білки Регуляторна – гормони, ферменти Скорочувальна – білки
- 4. Вміст білків у тканинах, % Тварини Організм – 18-21 М'язи – 19-23 Печінка – 18-19 Нирки
- 5. Прості білки 1) альбуміни 2) глобуліни 3) гістони 4) протаміни 5) глютеліни 6) проламіни 7) склеропротеїни
- 6. Складні білки 1) нуклеопротеїни 2) хромопротеїни 3) фосфопротеїни 4) глікопротеїни 5) ліпопротеїни 6) металопротеїни
- 7. Амінокислоти Замінні Гліцин Аланін Серин Цистеїн Аспарагінова кислота Глутамінова кислота Тирозин Пролін Аспарагін Глютамін Незамінні Треонін
- 8. Класифікація білків за їх повноцінністю Повноцінні білки містять всі незамінні амінокислоти. До них відносять білки тваринного
- 9. АЗОТИСТИЙ БАЛАНС Азотистий баланс — відношення між кількістю азоту, засвоєного організмом, і кількістю азоту, що виділяється
- 10. Види азотистого балансу Позитивний: кількість засвоєного азоту більше, ніж кількість виділеного азоту, тобто процеси анаболізму переважають
- 11. Негативний азотистий баланс: кількість виділеного азоту більше, ніж кількість засвоєного азоту, тобто процеси катаболізму в організмі
- 12. Азотиста рівновага (нульовий баланс): кількість засвоєного та виділеного азоту порівну. Це спостерігається у здорових непродуктивних тварин,
- 13. Білкова недостатність Відомо, що навіть тривале видалення з раціону людини жирів або вуглеводів не викликає важких
- 14. Білковий мінімум Це найменша кількість білку в раціоні, яка необхідна для забезпечення всіх його потреб, тобто
- 15. Норми протеїну в раціоні Вони розраховуються з урахуванням виду тварини, віку, напрямку продуктивності та інших факторів
- 16. В організмі людини за добу розпадається на амінокислоти приблизно 400 г білків, майже така ж кількість
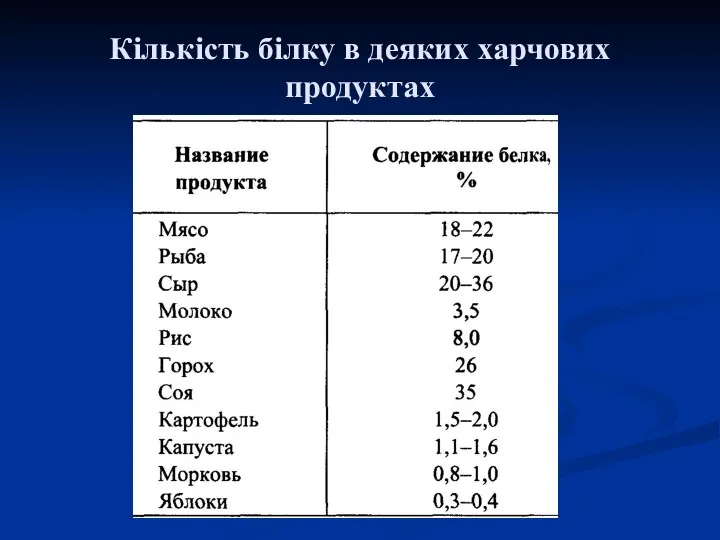
- 17. Кількість білку в деяких харчових продуктах
- 19. Переварювання білків Основним сенсом перетравлення білків є їх гідроліз до вільних амінокислот, в результаті чого вони
- 20. Переварювання білків здійснюється комплексом травних ферментів, які називаються протеолітичними або протеазами. Протеази відносять до класу Гідролази,
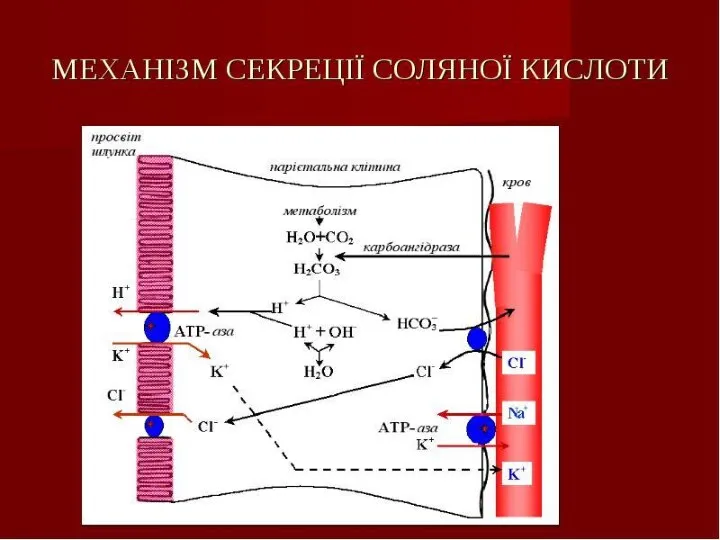
- 21. Переварювання білків у шлунку Шлунковий сік – продукт декількох типів клітин. Обкладаючі (парієтальні) клітини стінок шлунку
- 22. Під дією НСl відбувається денатурація білків корму, які не підлягали термічній обробці, що підвищує доступність пептидних
- 24. Механізм активації пепсину При дії гастринів у головних клітинах шлункових залоз стимулюються синтез і секреція пепсиногену
- 25. Особливості травлення білків у шлунку молодих тварин У молочний період згодовування тварин в сичузі (шлунку) знаходиться
- 26. Механізм дії пепсину Білки раціону + НОН → високомолекулярні поліпептиди Пепсин гідролізує внутрішні пептидні зв'язки, в
- 27. Активація панкреатичних ферментів У підшлунковій залозі синтезуються проферменти ряду протеаз: трипсиноген, хімотрипсиноген, проеластаза, прокарбокси-пептидази А і
- 28. Активація трипсиногену відбувається під дією ферменту епітелію кишечнику ентеропептидази (ентерокінази): Ентеропептидаза Трипсиноген + НОН → Трипсин
- 29. Трипсин, що утворився, активує хімотрипсиноген: трипсин Хімотрипсиноген + НОН → Хімотрипсин (неактивна форма) (активна форма) -
- 30. Інші проферменти панкреатичних протеаз (проеластаза і прокарбоксипептидази А і В) також активуються трипсином шляхом часткового протеолізу.
- 31. Карбоксипептидази А и В − цинквмісні ферменти, які відщеплюють С-кінцеві залишки амінокислот. Причому карбоксипептидаза А відщеплює
- 32. Амінопептидази послідовно відщеплюють N-кінцеві амінокислоти пептидного ланцюгу. Найбільш відома лейцинамінопептидаза − Zn2+ - або Мn2+ -
- 33. Механізм дії екзопептидаз
- 34. Білок яйця та білки молока, звільнені від жиру, переварюються на 100% М'ясо – 92-98 % Рослинні
- 35. Захист клітин від дії протеаз Клітини підшлункової залози захищені від дії травних ферментів тим, що: ці
- 36. У порожнині шлунку і кишечнику протеази не контактують з білками клітин, оскільки слизова оболонка вкрита шаром
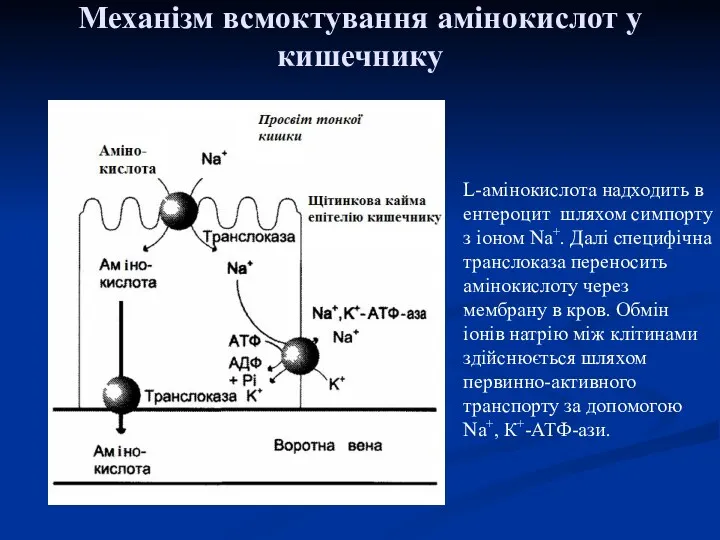
- 37. Механізм всмоктування амінокислот у кишечнику L-амінокислота надходить в ентероцит шляхом симпорту з іоном Nа+. Далі специфічна
- 38. На сьогодні відомо принаймні п'ять специфічних транспортних систем, кожна з яких функціонує для перенесення певної групи
- 39. Гниття білків у товстому відділі кишечнику БІЛКИ АМІНОКИСЛОТИ гнилісні бактерії ОТРУЙНІ РЕЧОВИНИ амоніак, сірководень, путресцин, кадаверин,
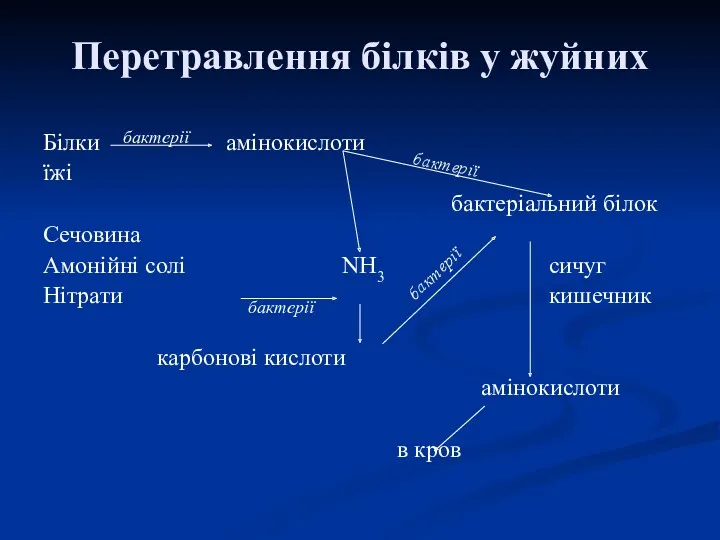
- 40. Перетравлення білків у жуйних Білки амінокислоти їжі бактеріальний білок Сечовина Амонійні солі NH3 сичуг Нітрати кишечник
- 41. Стінка рубця не синтезує ферменти, які можуть розщеплювати білки. В 1 мл рубцевого вмісту міститься 80
- 43. Скачать презентацию




































 Органи дихання людини
Органи дихання людини Актинидия. Особенности
Актинидия. Особенности Здоровый сад – основные правила и типичные ошибки
Здоровый сад – основные правила и типичные ошибки Значення бульбочкових бактерій у сільському господарстві
Значення бульбочкових бактерій у сільському господарстві Скелетные мышцы. Физиология возбудимых тканей
Скелетные мышцы. Физиология возбудимых тканей Как разные животные готовятся к зиме
Как разные животные готовятся к зиме Генетика. Наследственность. Изменчивость
Генетика. Наследственность. Изменчивость Тип членистоногие (arthropoda)
Тип членистоногие (arthropoda) Царство грибы
Царство грибы Тип Кишечнополостные
Тип Кишечнополостные Основы морфологии растений
Основы морфологии растений презентация к уроку биологии 7 класс
презентация к уроку биологии 7 класс Кубанские умельцы
Кубанские умельцы Презентация к внеклассному мероприятию Биология в профессиях
Презентация к внеклассному мероприятию Биология в профессиях Общие принципы организации тканей. Эпителиальные ткани
Общие принципы организации тканей. Эпителиальные ткани Ферментные препараты, используемые в молочной промышленности
Ферментные препараты, используемые в молочной промышленности Тонкая кишка
Тонкая кишка Деление клетки. Митоз
Деление клетки. Митоз Почвы горных областей Казахстана
Почвы горных областей Казахстана Сибиоз. Лишайники
Сибиоз. Лишайники Селекция. Современные методы селекции
Селекция. Современные методы селекции Митохондрии. Строение, функции, происхождение митохондрий
Митохондрии. Строение, функции, происхождение митохондрий Систематика пресмыкающихся
Систематика пресмыкающихся Зрительный анализатор. Анатомия и физиология глаза
Зрительный анализатор. Анатомия и физиология глаза Физиология сосудов. (Лекция 5.2)
Физиология сосудов. (Лекция 5.2) Мужская половая система
Мужская половая система Красная книга. Животные
Красная книга. Животные Селекция животных
Селекция животных