Содержание
- 2. Полимеры Полиме́ры - вещества, состоящие из «мономерных звеньев», соединённых в макромолекулы. Полимер — это высокомолекулярное соединение:
- 3. Углеводы Липиды Пептиды (в т.ч. Белки) Нуклеиновые кислоты
- 4. Углеводы Органические вещества, содержащие углерод, водород и кислород в примерном соотношении 1C:2H:1O Важный источник питательных веществ
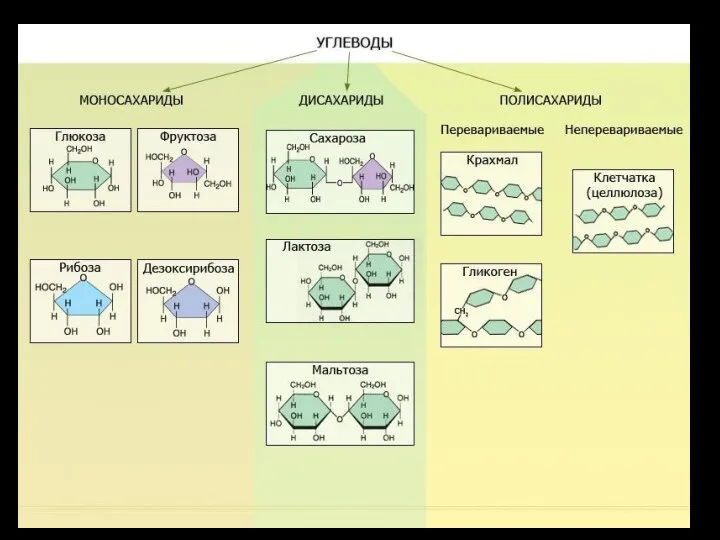
- 5. Углеводы Моносахариды Простые сахара Сложные сахара: Олигосахариды (в т.ч. Дисахариды) Несколько (две) моносахаридные субъединицы Полисахариды Много
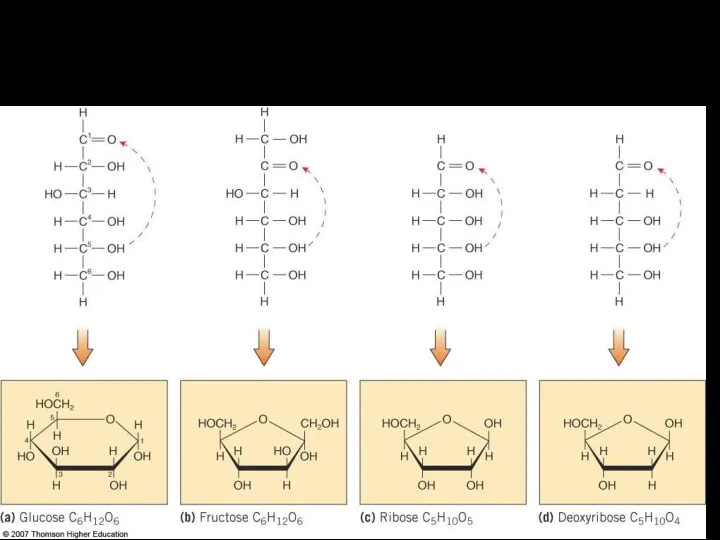
- 6. Распространенные моносахариды Глюкоза Фруктоза Рибоза Дезоксирибоза
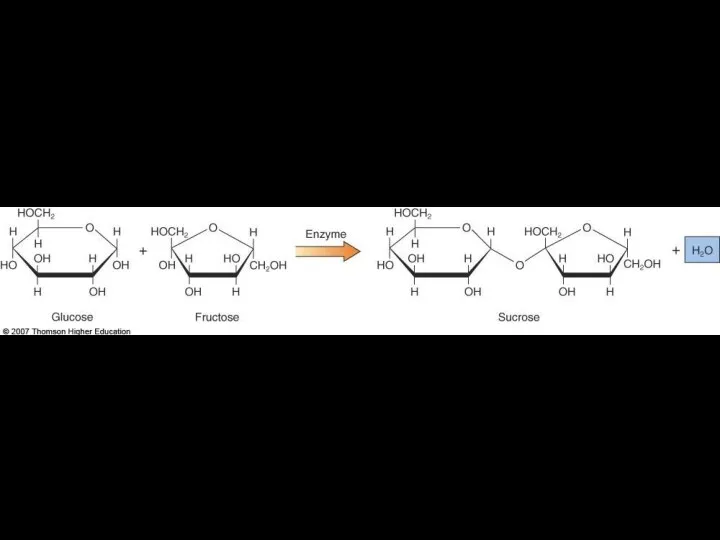
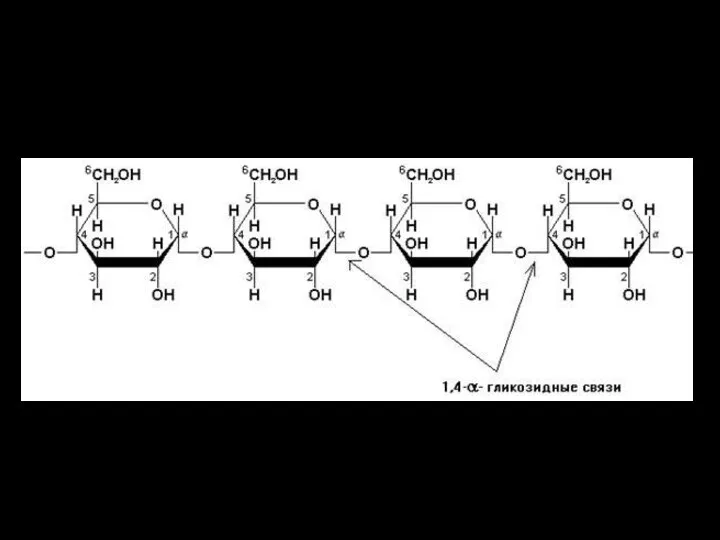
- 7. Образование гликозидной связи на примере синтеза сахарозы
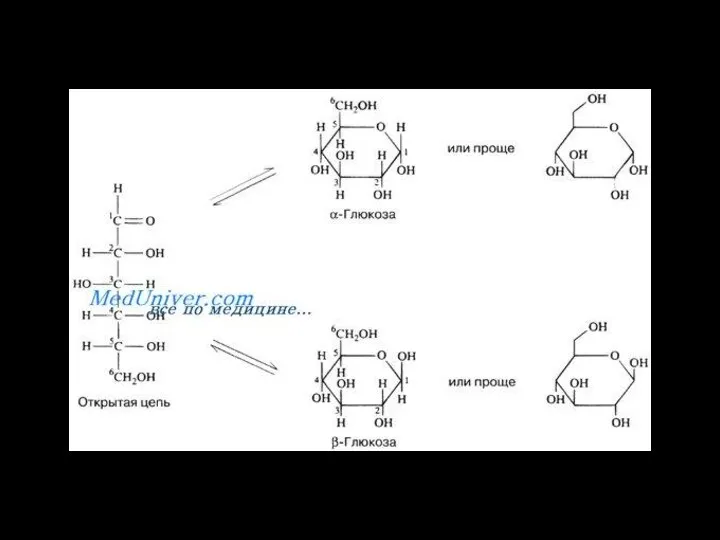
- 8. Изомерия углеводов
- 9. Изомерия углеводов
- 10. Моносахариды: «Простые» сахара У нескольких основных формула C6H12O6 Примеры – фруктоза, глюкоза, галактоза Глюкоза – самый
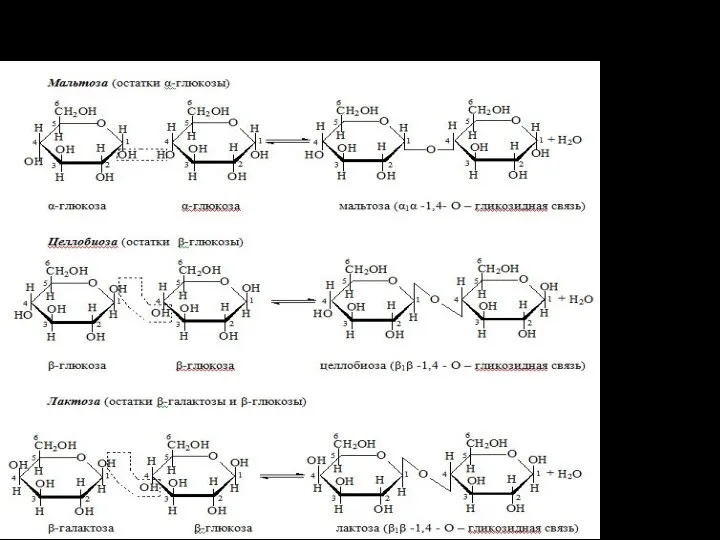
- 11. Углеводы
- 12. Полисахариды: крахмал
- 13. Полисахариды Примеры: крахмалкрахмал — основной полисахарид, откладываемый как энергетический запас у растительных организмов; растительный полисахарид со
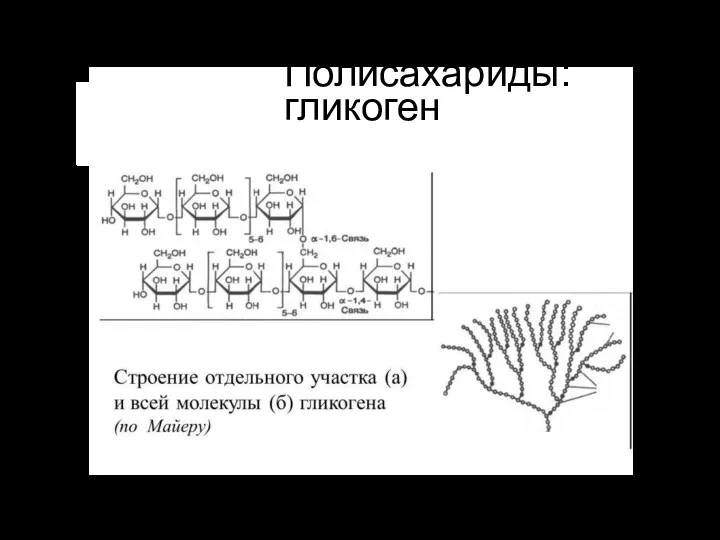
- 14. Полисахариды: гликоген
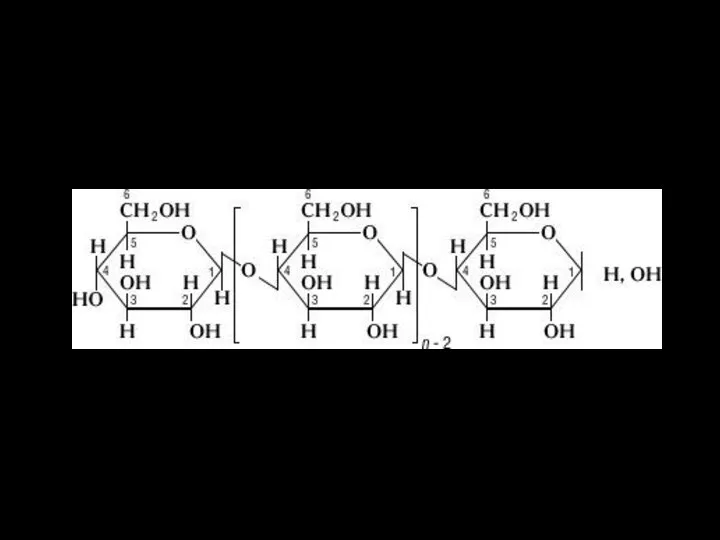
- 15. Полисахариды: целлюлоза
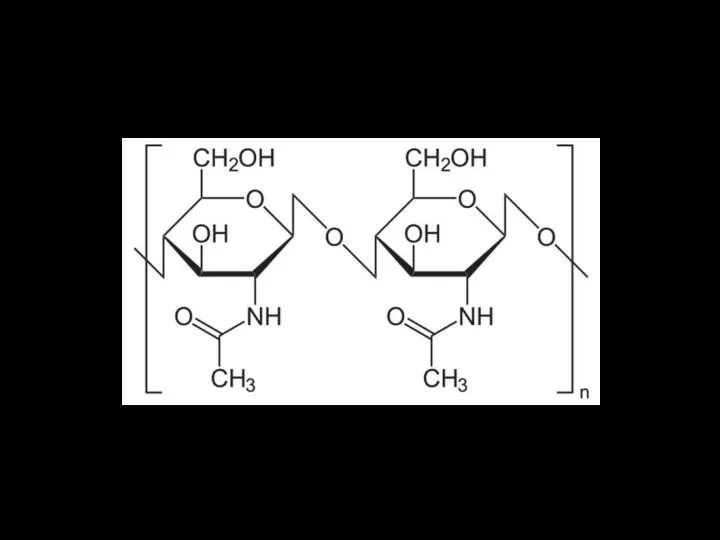
- 16. Полисахариды: хитин
- 17. Полисахариды гликогенгликоген — полисахарид, откладываемый как энергетический запас в клетках животных организмов, но встречается в малых
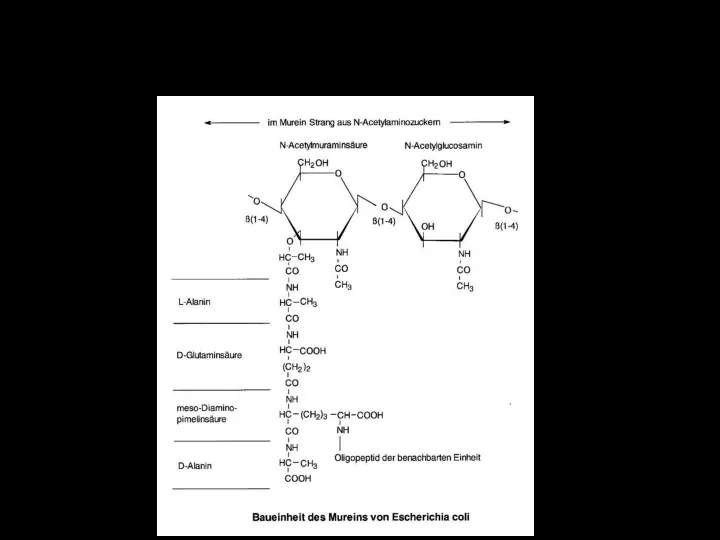
- 18. Пептидогликан (муреин) E.coli
- 19. Функции углеводов ● ● ● ● ● ● ● ● Энергетическая Запасающая Структурная Осморегуляторная Пластическая Защитная
- 20. Липиды Жироподобные органические вещества, не растворимые в воде. Важный источник энергии и способ запасать ее, компоненты
- 21. Основные типы липидов: Нейтральные жиры (жиры и масла - твердые и жидкие при комнатной температуре) Воски
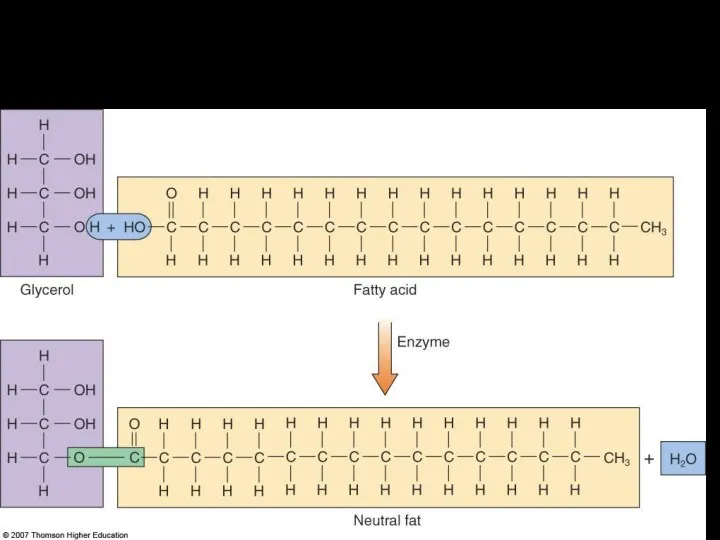
- 22. Образование триглицеридов - нейтральных жиров (как правило из насыщенных жирных кислот – жиров, а из ненасыщенных
- 23. Воски Подобны триглицеридам, только вместо глицерола жирные кислоты присоединены к многоатомным спиртам Водостойкое внешнее покрытие у
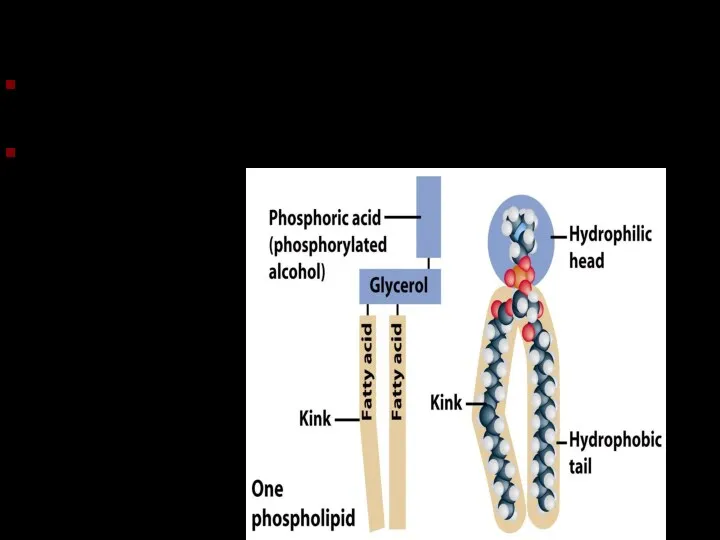
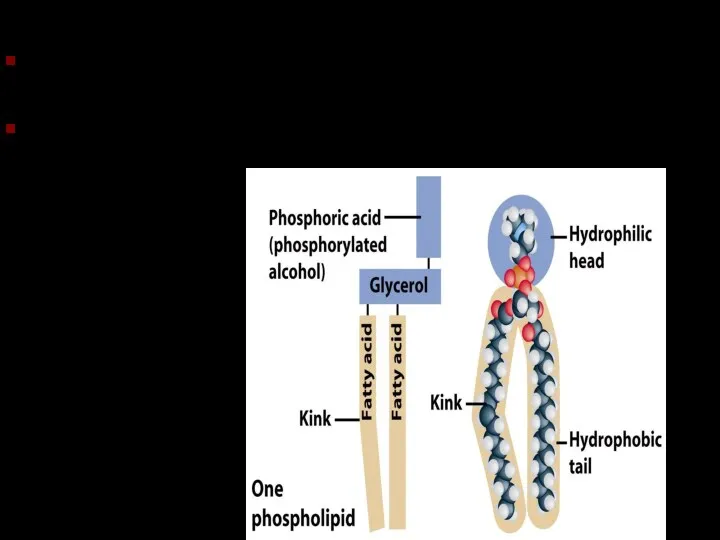
- 24. Фосфолипиды Подобны триглицеридам, но одна из жирных кислот замещена фосфатной группой Конец с фосфатной группой гидрофильный.
- 25. Фосфолипиды Подобны триглицеридам, но одна из жирных кислот замещена фосфатной группой Конец с фосфатной группой гидрофильный.
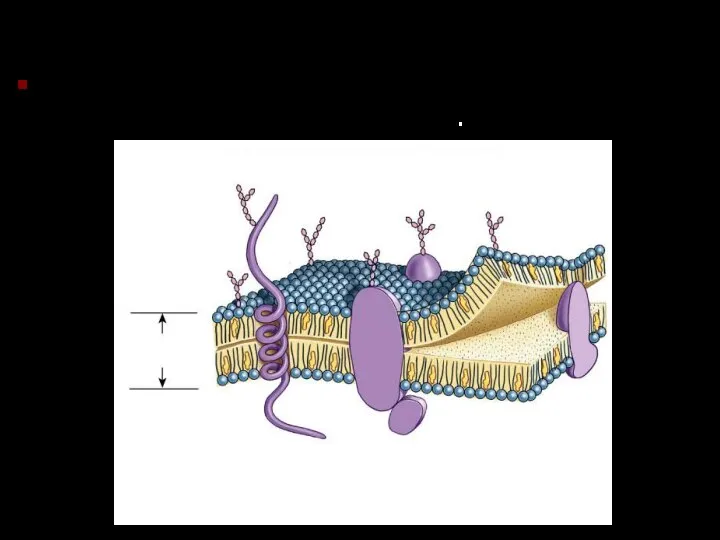
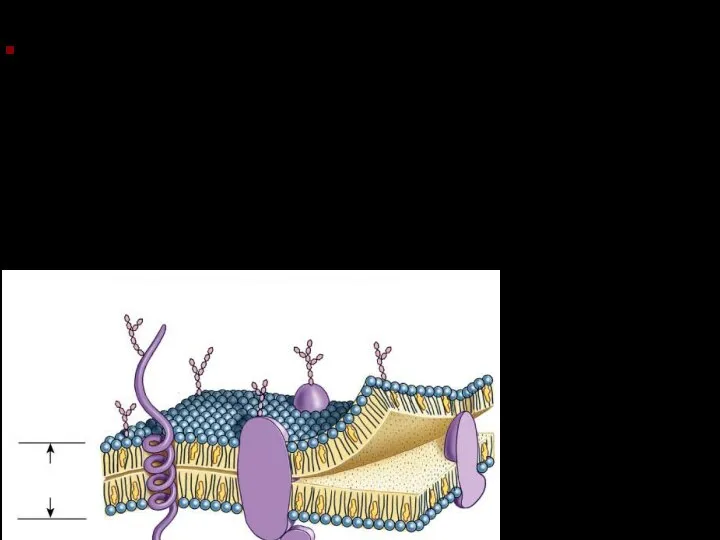
- 26. Фосфолипиды Фосфолипидный бислой – основа клеточной мембраны..
- 27. Стероиды Стероиды – сложные циклические молекулы Встречаются у растений и животных Примеры
- 28. Стероиды Стероиды – сложные циклические молекулы Встречаются у растений и животных Примеры:
- 29. Холестерин
- 30. Пептиды, включая белки Высокомолекулярные органические соединения, состоящие из аминокислотных субъединиц Аминокислотные остатки соединены пептидными связями Порядок
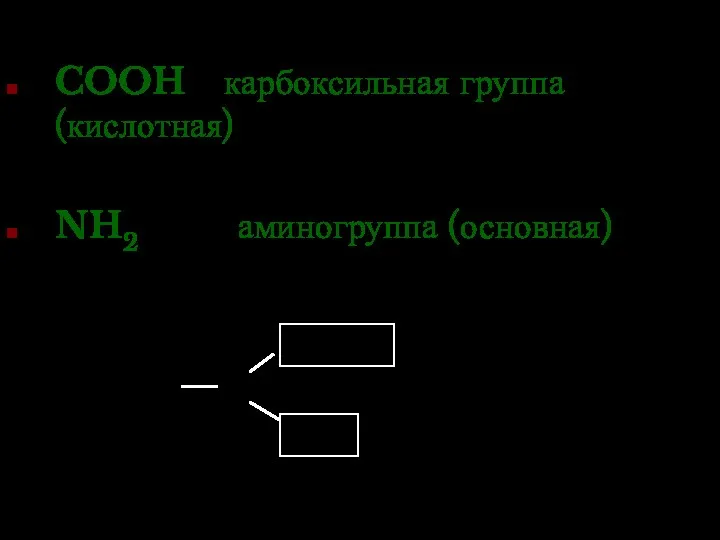
- 31. COOH карбоксильная группа (кислотная) NH2 аминогруппа (основная)
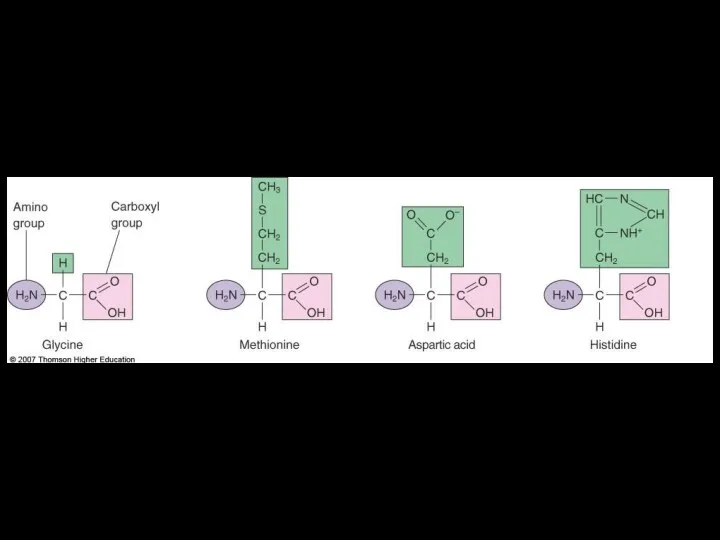
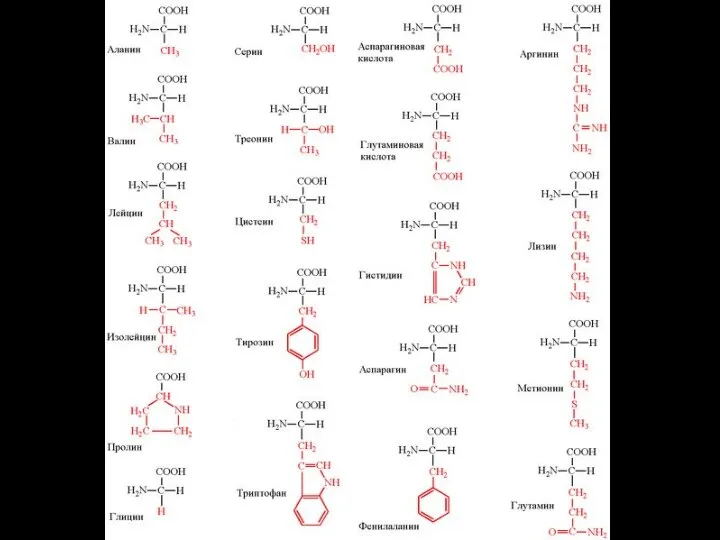
- 32. Строение аминокислот
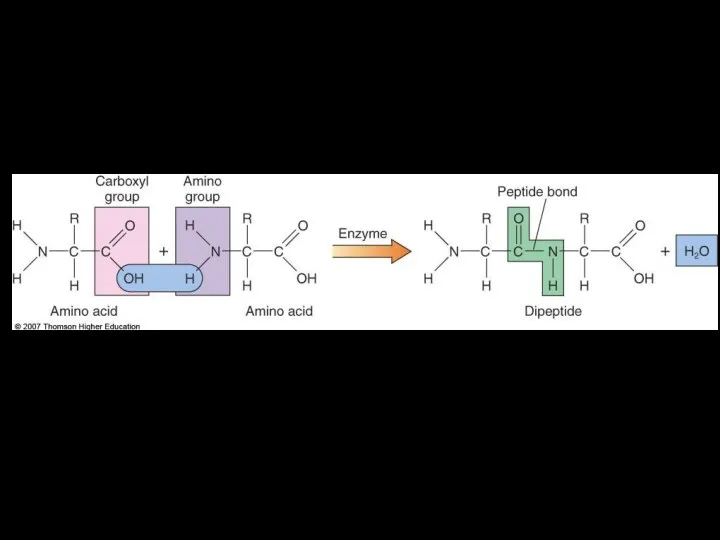
- 33. Пептидная связь
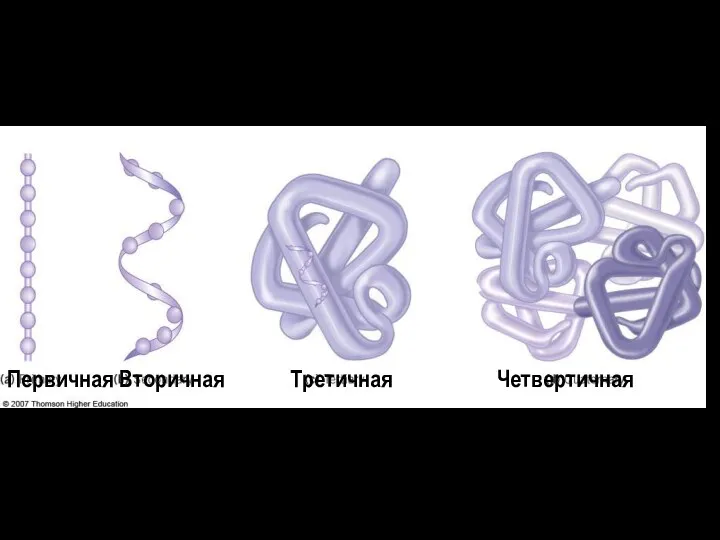
- 35. Структура белков Первичная Вторичная Третичная Четвертичная
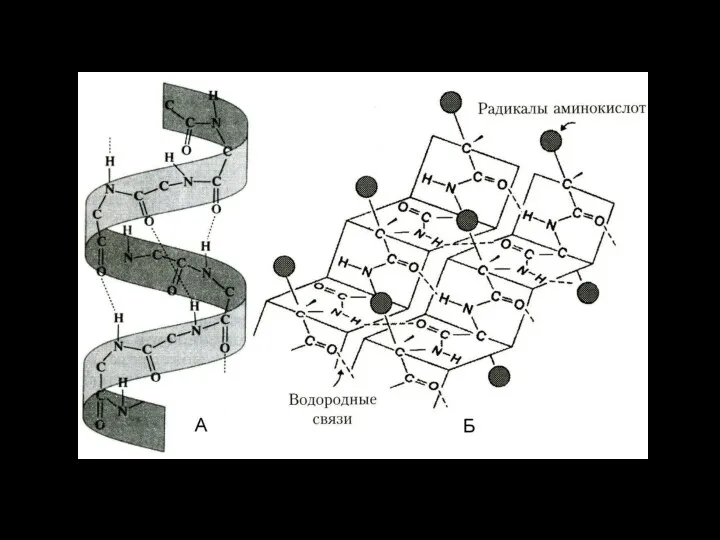
- 36. Примеры вторичной структуры белков Вторичная структура (наиболее распространенные варианты): А - α-спираль, Б - β-структура (β-слои,
- 37. Денатурация белка – разрушение пространственной структуры белка (четвертичной, третичной, вторичной) при внешнем воздействии (например повышении температуры,
- 38. Белки являются амфотерными соединениями, сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот. Различают кислые,
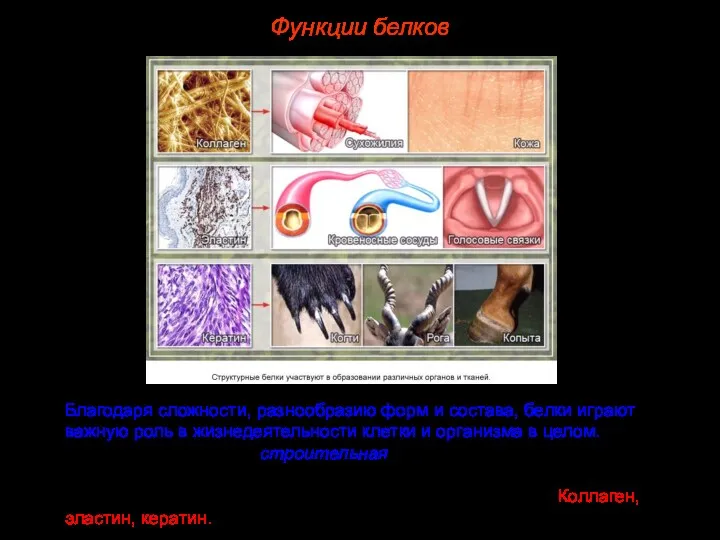
- 39. Благодаря сложности, разнообразию форм и состава, белки играют важную роль в жизнедеятельности клетки и организма в
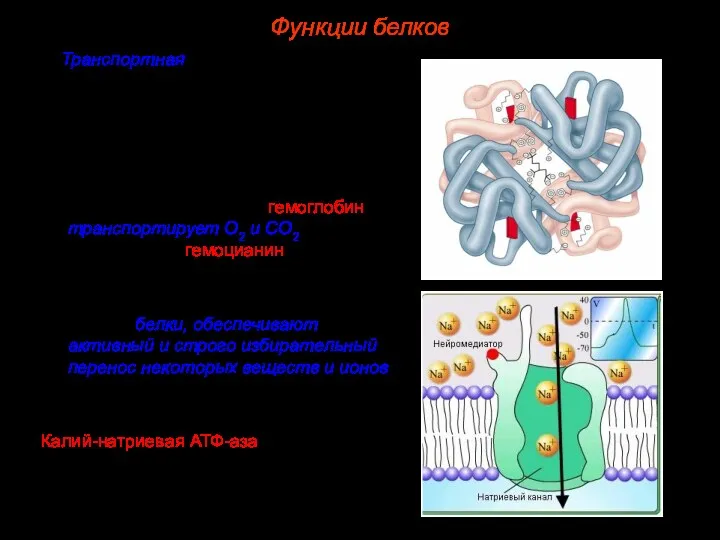
- 40. 2. Транспортная. А) Некоторые белки способны присоединять различные вещества и переносить их к различным тканям и
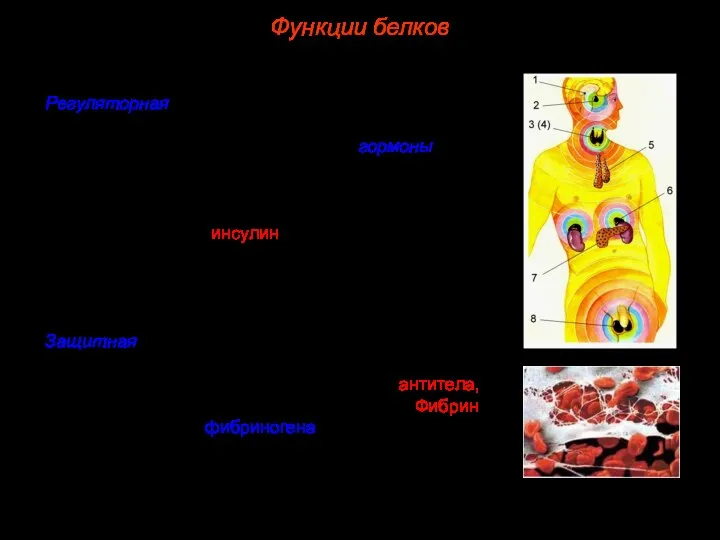
- 41. 3. Регуляторная. Большая группа белков организма принимает участие в регуляции процессов обмена веществ. Такими белками являются
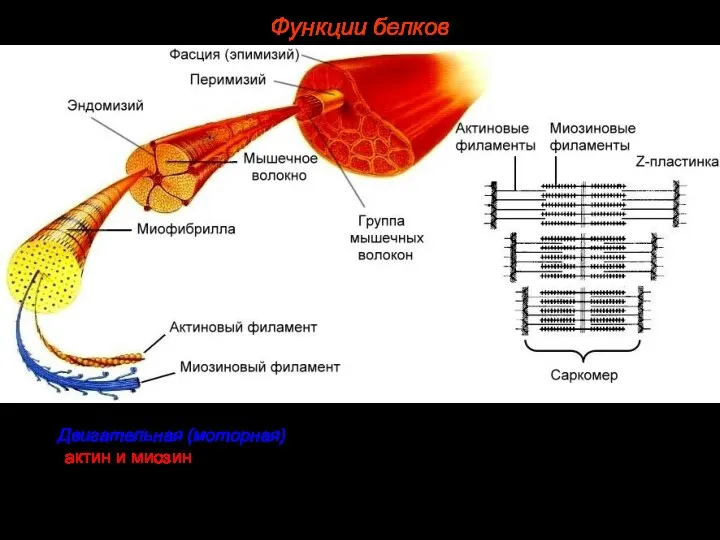
- 42. 5. Двигательная (моторная). Особые сократительные белки (например, актин и миозин) участвуют во всех видах движения клетки
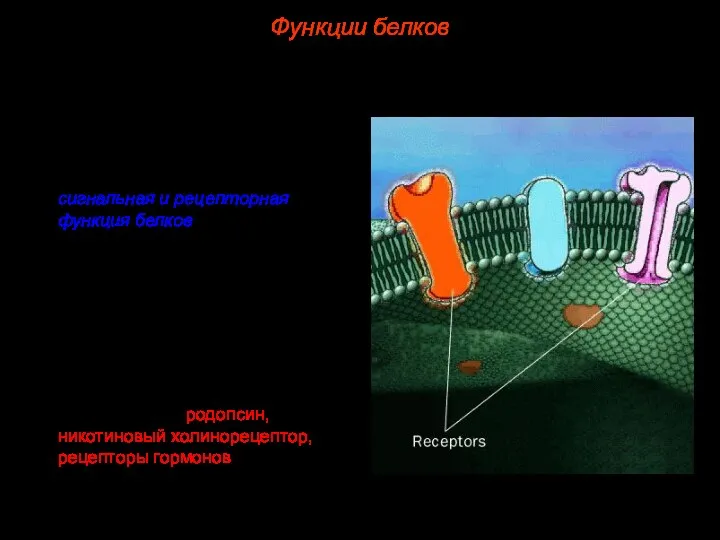
- 43. 6. Весьма важна для жизни клетки сигнальная и рецепторная функция белков. В поверхностную мембрану клетки встроены
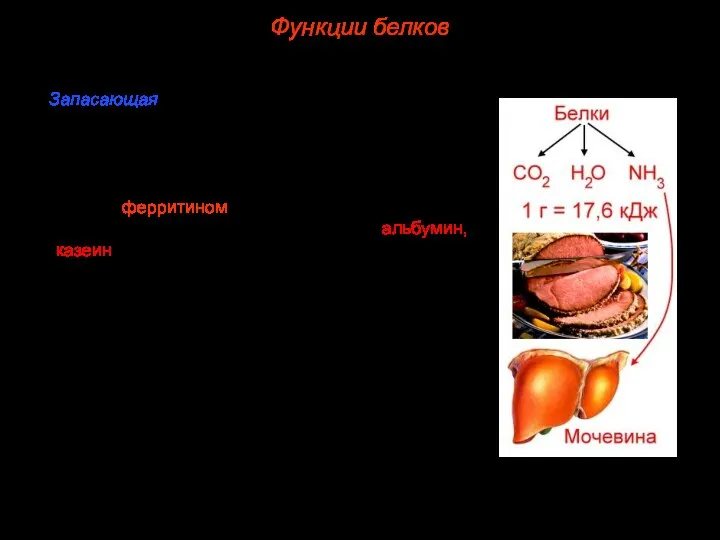
- 44. 7. Запасающая. Благодаря белкам в организме могут откладываться про запас некоторые вещества. Например, при распаде гемоглобина
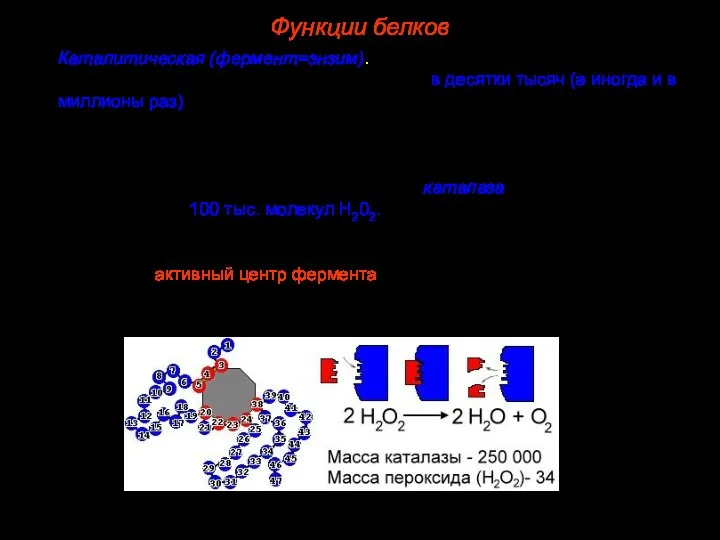
- 45. 8. Каталитическая (фермент=энзим). Одна из важнейших функций белков. Скорость ферментативных реакций в десятки тысяч (а иногда
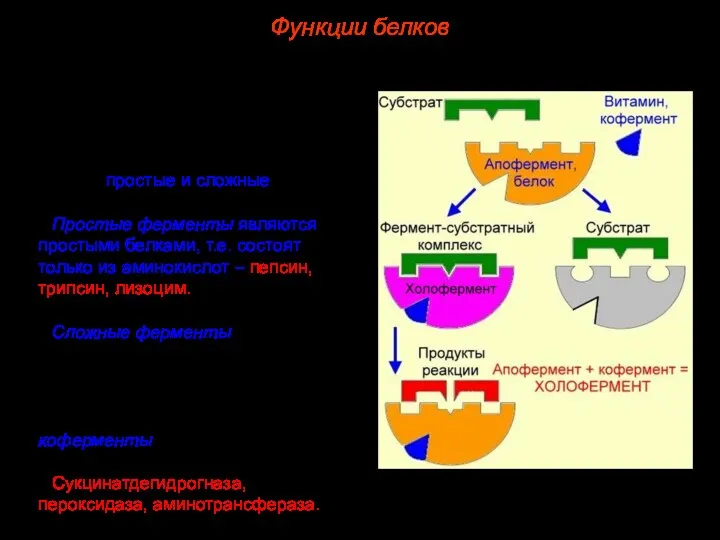
- 46. Ферменты – обычно глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и
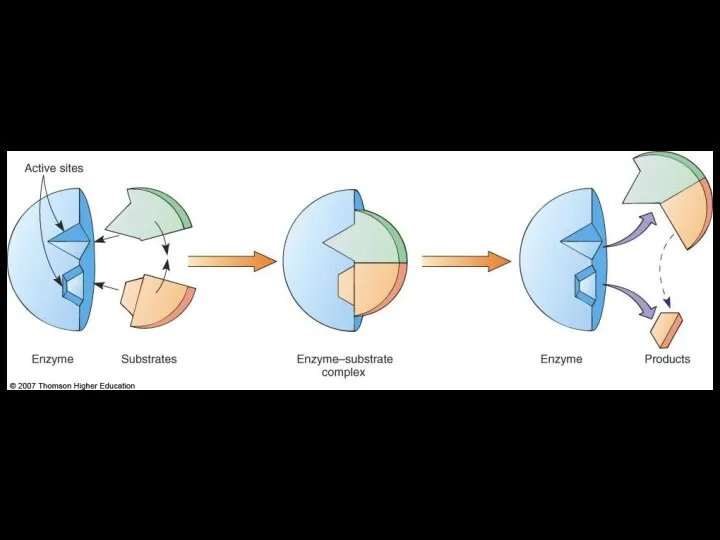
- 47. Энзим-субстратный комплекс
- 49. Скачать презентацию















 Слагаемые успеха
Слагаемые успеха презентация к уроку Пресмыкающиеся, особенности строения, многообразие
презентация к уроку Пресмыкающиеся, особенности строения, многообразие Уход за комнатными растениями
Уход за комнатными растениями Липиды: обмен, переваривание, окисление
Липиды: обмен, переваривание, окисление Процесс развития организмов эволюция
Процесс развития организмов эволюция Презентация по биологии
Презентация по биологии Физиологические свойства скелетной мускулатуры и мышц внутренних органов. Движение
Физиологические свойства скелетной мускулатуры и мышц внутренних органов. Движение Пищеварительная система. Ротовая полость
Пищеварительная система. Ротовая полость Умники и умницы по биологии 6 класс
Умники и умницы по биологии 6 класс Культура растительных клеток
Культура растительных клеток Живая и неживая природа. Он-лайн школа Учимся играя
Живая и неживая природа. Он-лайн школа Учимся играя Физиология растений
Физиология растений Птицы Москвы
Птицы Москвы Соединения костей
Соединения костей Өсімдіктерді қорғаудағы зоофагтардың, гербифагтардың және микроорганизмдердің реттеуші ролі. (Лекция 9)
Өсімдіктерді қорғаудағы зоофагтардың, гербифагтардың және микроорганизмдердің реттеуші ролі. (Лекция 9) Новые подходы к ремедиации почв, загрязненных пестицидом Гезагард
Новые подходы к ремедиации почв, загрязненных пестицидом Гезагард Закономерности влияния окружающей среды на развитие фенотипа животных. (Лекция 1)
Закономерности влияния окружающей среды на развитие фенотипа животных. (Лекция 1) Экологические основы паразитизма в типе Членистоногие
Экологические основы паразитизма в типе Членистоногие Презентации к урокам
Презентации к урокам Особенности строения и жизнедеятельности Ракообразных. Значение их в природе и жизни человека
Особенности строения и жизнедеятельности Ракообразных. Значение их в природе и жизни человека Основные понятия генетики
Основные понятия генетики Внутреннее строение, размножение и развитие рыб
Внутреннее строение, размножение и развитие рыб Пезентация.
Пезентация. Влияние синтетических моющих средств на рост и развитие растений
Влияние синтетических моющих средств на рост и развитие растений Насекомые – самый большой класс животных
Насекомые – самый большой класс животных Презентация к уроку по биологии по теме Высшая нервная деятельность
Презентация к уроку по биологии по теме Высшая нервная деятельность Использование цифрового микроскопа на уроках
Использование цифрового микроскопа на уроках Птичьи посиделки
Птичьи посиделки