Содержание
- 2. Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких
- 3. Класс – земноводные
- 4. Чернофигурная амфора (6 в. до н.э.)
- 5. Античный амфитеатр (г. Эфес, Турция)
- 7. Вещества, которые в зависимости от условий реакций проявляют кислотные или основные свойства, называют амфотерными. Амфотерность
- 8. Амфотерные вещества Оксиды
- 9. Амфотерные вещества Оксиды Амфотерные оксиды реагируют с сильными кислотами, образуя соли этих кислот. Такие реакции являются
- 10. Амфотерные вещества Оксиды Они также реагируют с сильными щелочами, проявляя этим свои кислотные свойства, например: ZnO
- 11. Амфотерные вещества Оксиды Амфотерные оксиды могут реагировать со щелочами двояко: в растворе и в расплаве. При
- 12. Амфотерные вещества Оксиды Амфотерные оксиды обычно при нормальных условиях не растворяются в воде и не реагируют
- 13. Амфотерные вещества Гидроксиды Be(OH)2 – гидроксид бериллия Al(OH)3 – гидроксид алюминия Cr(OH)3 – гидроксид хрома (III)
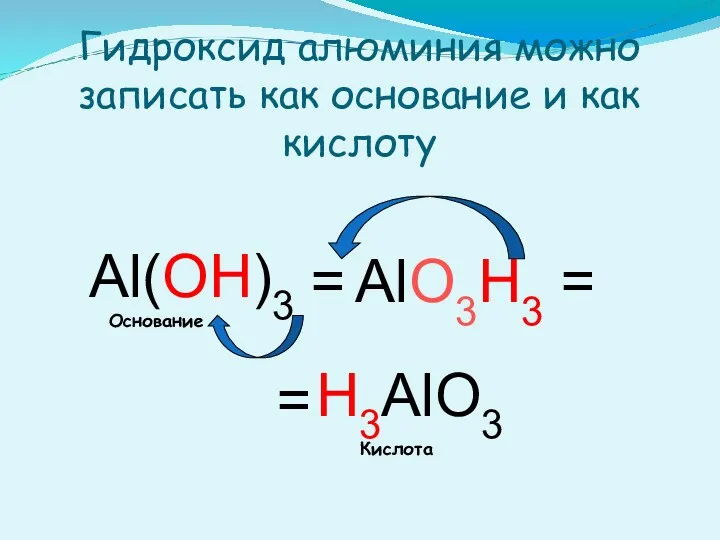
- 14. Гидроксид алюминия можно записать как основание и как кислоту Al(OH)3 = H3AlO3 AlO3H3 = = Кислота
- 15. Амфотерные вещества Гидроксиды Соответствующий оксиду цинка гидроксид цинка также способен реагировать и с кислотами, и со
- 16. Амфотерные вещества Гидроксиды С сильным основанием, например, с гидроксидом натрия, гидроксид цинка реагирует как кислота H2ZnO2:
- 17. Амфотерные вещества Гидроксиды При сплавлении гидроксида цинка со щелочью образуется безводный цинкат натрия и выделяется вода
- 18. Амфотерные вещества Как же распознать, что соединение является амфотерным? Опытным путем проверить является ли вещество амфотерным.
- 19. Практическая работа Цель работы: получить амфотерный гидроксид и изучить его свойства
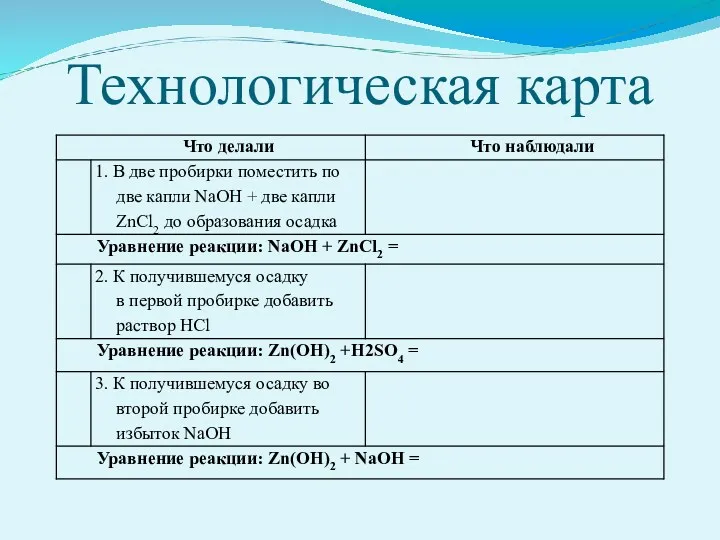
- 21. Технологическая карта
- 22. Реакции
- 23. Вывод Гидроксид цинка Zn(OH)2, взаимодействуя со щелочью (NaOH), проявляет ______________ свойства, а взаимодействуя с кислотой, проявляет
- 24. «Третий лишний» Al2O3, ZnO, CaO, K2O, , Al(OH)3, Cu(OH)2 Na2O Cr2O3 NaOH
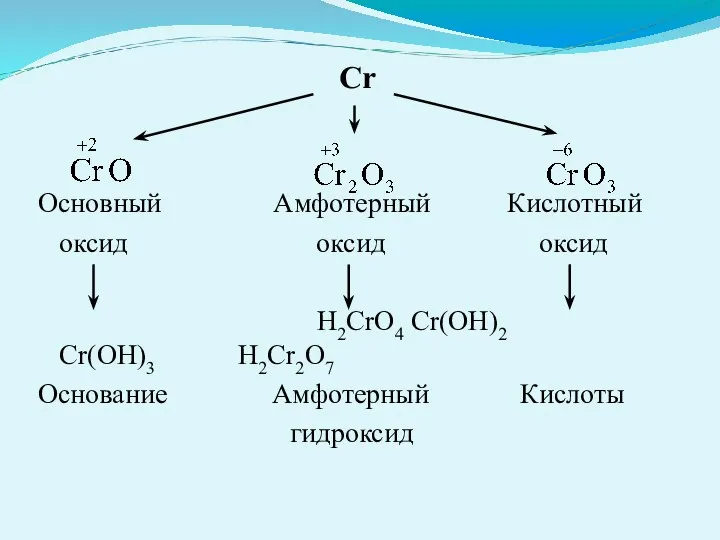
- 25. Cr Основный Амфотерный Кислотный оксид оксид оксид H2CrO4 Сr(OH)2 Cr(OH)3 H2Cr2O7 Основание Амфотерный Кислоты гидроксид
- 27. Скачать презентацию





















 Диены (диолефины, алкадиены)
Диены (диолефины, алкадиены) Застосування неметалів
Застосування неметалів Строение вещества. Химические элементы
Строение вещества. Химические элементы Простые вещества. Сложные вещества
Простые вещества. Сложные вещества Степень окисления элементов
Степень окисления элементов Химические основы жизни
Химические основы жизни Химическая связь и ее типы. Кристаллические решётки
Химическая связь и ее типы. Кристаллические решётки Периодический закон Менделеева
Периодический закон Менделеева Железо, его характеристики, свойства и соединения
Железо, его характеристики, свойства и соединения Строение атома. Периодическая таблица Менделеева. Химическая связь
Строение атома. Периодическая таблица Менделеева. Химическая связь Химический состав водоотталкивающих средств
Химический состав водоотталкивающих средств Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C
Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C Фазовое равновесие
Фазовое равновесие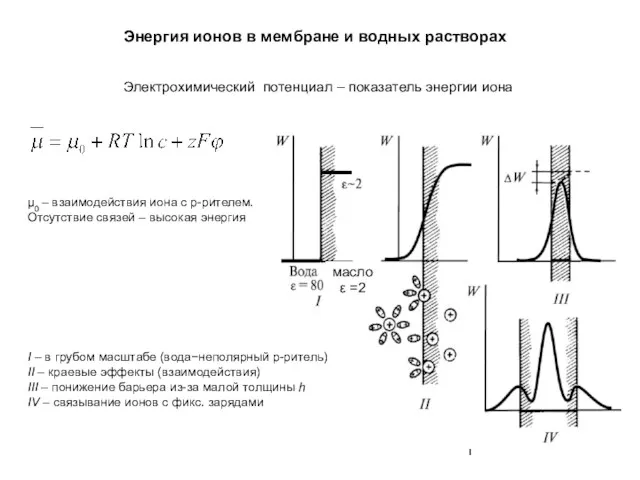 Энергия ионов в мембране и водных растворах
Энергия ионов в мембране и водных растворах Обмен сложных липидов
Обмен сложных липидов Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Этиловый спирт в жизни человека
Этиловый спирт в жизни человека Основні класи неорганічних сполук
Основні класи неорганічних сполук Органические соединения серы
Органические соединения серы Галогены. Строение атомов фтора и хлора
Галогены. Строение атомов фтора и хлора Главная подгруппа IV группы. Общая характеристика элементов
Главная подгруппа IV группы. Общая характеристика элементов Естествознание для всех. Викторина
Естествознание для всех. Викторина Дисперсные системы
Дисперсные системы Галогены. Получение и применение галогенов
Галогены. Получение и применение галогенов Автомобильные пластичные смазки
Автомобильные пластичные смазки Нітроген
Нітроген Химическая технология. Введение
Химическая технология. Введение