Содержание
- 2. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
- 3. , Строение атомов фтора и хлора + 9 F 2 7 2 7 Cl + 17
- 4. Строение атома Степени окисления: F: только -1;0 Cl, Br, I:-1; 0; +1; +3; +5; +7
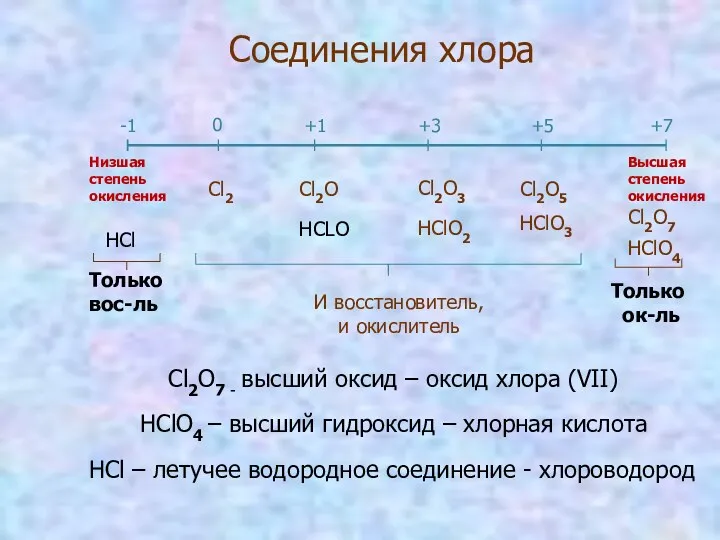
- 5. Соединения хлора -1 0 +1 +3 +5 +7 HCl Cl2 Cl2O HCLO Cl2O3 HClO2 Cl2O5 HClO3
- 6. Молекулы галогенов состоят из двух атомов F2; Cl2; Br2; I2 Связь – ковалентная неполярная
- 7. Существуют только в связанном состоянии стр.172
- 8. Простые вещества - галогены
- 9. Химические свойства Сильные окислители (+е) 1. Взаимодействуют с металлами: 2Na + Cl2 = 2NaCl Zn +
- 10. Химические свойства 2. Взаимодействуют с неметаллами: Cl2 + H2 = Cl2 + S = Cl2 +
- 11. Химические свойства 3. Взаимодействуют со сложными веществами: а) с растворами солей Cl2 + 2NaI = 2NaCl
- 12. Химические свойства б) с водой 2F2 + 2H2O = 4HF + O2 Cl20 + H2O =
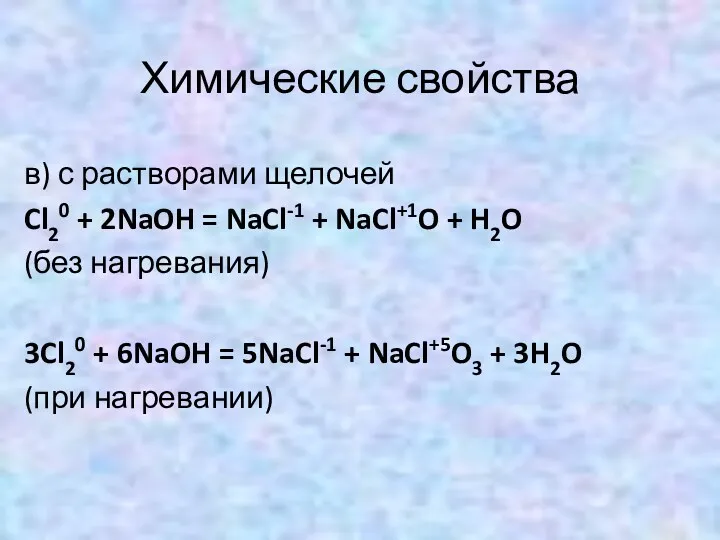
- 13. Химические свойства в) с растворами щелочей Cl20 + 2NaOH = NaCl-1 + NaCl+1O + H2O (без
- 14. Качественные реакции на галогенид-ионы: NaCl + AgNO3 = AgCl + NaNO3 NaBr + AgNO3 = AgBr
- 15. В промышленности: электролиз расплава или раствора хлорида натрия В лаборатории: 4 HСl + MnO2 → MnCl2
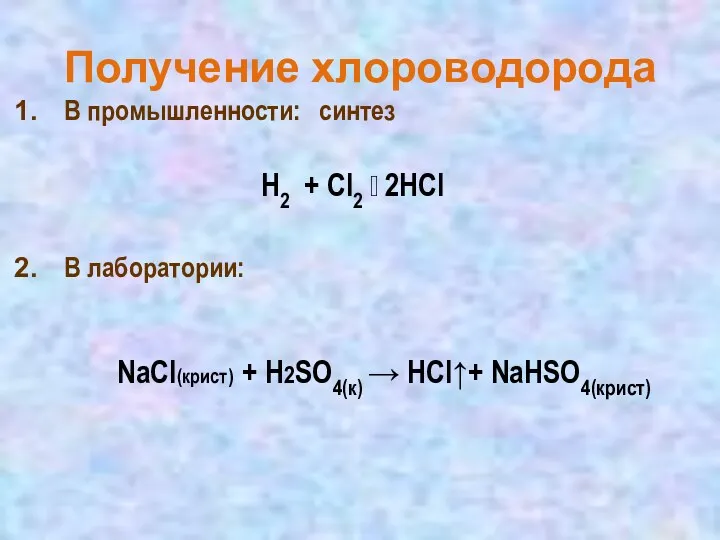
- 16. В промышленности: синтез В лаборатории: NaСl(крист) + H2SO4(к) → HСl↑+ NaHSO4(крист) H2 + Cl2 ? 2HСl
- 17. Галогеноводородные кислоты Увеличение длины связи, усиление кислотных св-в; HIр-р – самая сильная из всех известных к-т
- 18. Свойства плавиковой кислоты: SiO2 + 4HF = SiF4 + 2H2O
- 20. Скачать презентацию














 Применение алканов
Применение алканов Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни
Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни Геохимические барьеры
Геохимические барьеры Сплав золота и серебра - электрум
Сплав золота и серебра - электрум Спирты
Спирты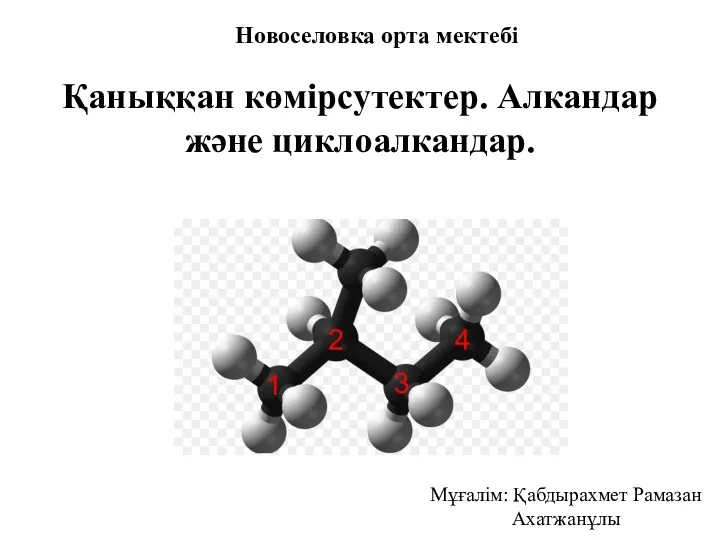 Қаныққан көмірсутектер. Алкандар және циклоалкандар
Қаныққан көмірсутектер. Алкандар және циклоалкандар Свойства воды
Свойства воды Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева
Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева Атомно-молекулярное учение. (Лекция 1)
Атомно-молекулярное учение. (Лекция 1) Коллоидная химия
Коллоидная химия Фосфор и его соединения
Фосфор и его соединения Электролиз: опыты к заданиям ЕГЭ
Электролиз: опыты к заданиям ЕГЭ Окислительно-восстановительные реакции. Лабораторная работа
Окислительно-восстановительные реакции. Лабораторная работа Радикальные реакции. (Лекция 9)
Радикальные реакции. (Лекция 9) Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс
Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс Изучение зависимости между химическим составом, структурой и свойствами чугунов
Изучение зависимости между химическим составом, структурой и свойствами чугунов 20231009_zhyostkost_vody
20231009_zhyostkost_vody Ерітінділер туралы ілім. Буферлік ерітінділер
Ерітінділер туралы ілім. Буферлік ерітінділер Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Чипсы: вред или польза
Чипсы: вред или польза Органические вещества
Органические вещества Медь и сплавы на ее основе
Медь и сплавы на ее основе NaCl или поваренная соль (плюсы и минусы)
NaCl или поваренная соль (плюсы и минусы) Диазины. Общая характеристика диазинов
Диазины. Общая характеристика диазинов Химия в повседневной жизни
Химия в повседневной жизни Металдар
Металдар Химия. Интересные факты. Как Менделеев открыл периодический закон?
Химия. Интересные факты. Как Менделеев открыл периодический закон?