Содержание
- 2. Подготовка к К/Р На следующем уроке у нас будет контрольная! Она будет посвящена степеням окисления, окислительно-восстановительным
- 3. Последовательность действий на к/р: Проверяем является ли реакция окислительно-восстановительной (ОВР). Чем ОВР отличается от других реакций?
- 4. Последовательность действий на к/р: Проверяем является ли реакция окислительно-восстановительной (ОВР). Cl2 + O3 ? ClO3 NaBr
- 5. Последовательность действий на к/р: Проверяем является ли реакция окислительно-восстановительной (ОВР). Cl2 + O3 ? ClO3 NaBr
- 6. Последовательность действий на к/р: Проверяем является ли реакция окислительно-восстановительной (ОВР). Расставляем степени окисления над элементом-окислителем и
- 7. Последовательность действий на к/р: Проверяем является ли реакция окислительно-восстановительной (ОВР). Расставляем степени окисления над элементом-окислителем и
- 8. Кокс каменноу́гольный (от нем. Koks и англ. coke) — твёрдый пористый продукт серого цвета, получаемый путём
- 9. Последовательность действий на к/р: Проверяем является ли реакция окислительно-восстановительной (ОВР). Расставляем степени окисления над элементом-окислителем и
- 10. Последовательность действий на к/р: Проверяем является ли реакция окислительно-восстановительной (ОВР). Расставляем степени окисления над элементом-окислителем и
- 11. Последовательность действий на к/р: Проверяем является ли реакция окислительно-восстановительной (ОВР). Расставляем степени окисления над элементом-окислителем и
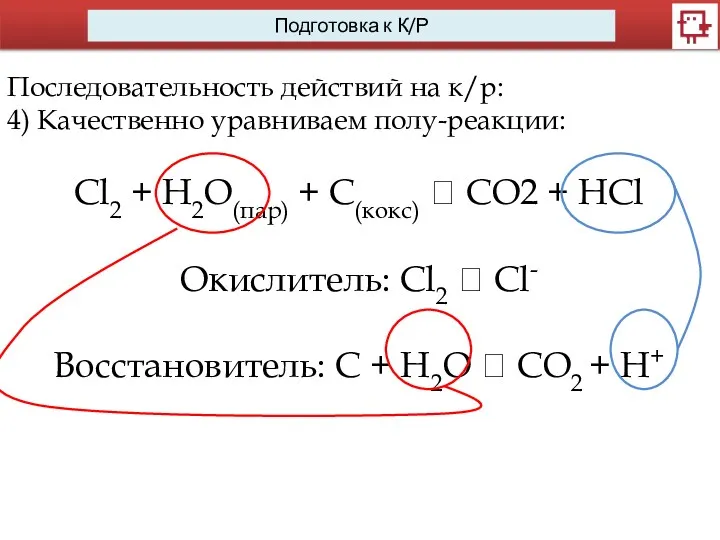
- 12. Последовательность действий на к/р: 4) Качественно уравниваем полу-реакции: Cl2 + H2O(пар) + С(кокс) ? CO2 +
- 13. Последовательность действий на к/р: 4) Качественно уравниваем полу-реакции: Cl2 + H2O(пар) + С(кокс) ? CO2 +
- 14. Последовательность действий на к/р: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции: Cl2 + H2O(пар) +
- 15. Последовательность действий на к/р: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции: Cl2 + H2O(пар) +
- 16. Последовательность действий на к/р: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции. 6) Считаем заряды и
- 17. Последовательность действий на к/р: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции. 6) Считаем заряды и
- 18. Последовательность действий на к/р: 4) Качественно уравниваем полу-реакции. 5) Количественно уравниваем полу-реакции. 6) Считаем заряды и
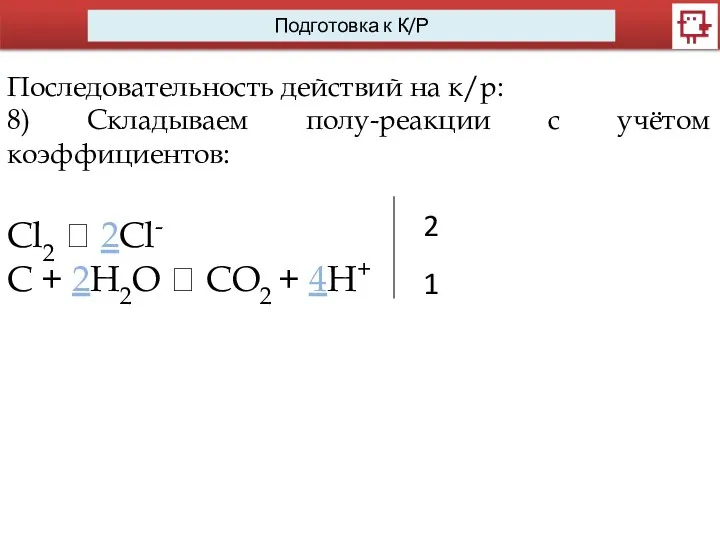
- 19. Последовательность действий на к/р: 8) Складываем полу-реакции с учётом коэффициентов: Сl2 ? 2Cl- С + 2H2O
- 20. Последовательность действий на к/р: 8) Складываем полу-реакции с учётом коэффициентов: Сl2 ? 2Cl- С + 2H2O
- 21. SO2 + SeO2 + H2O ? Se + H2SO4 Подготовка к К/Р
- 23. Скачать презентацию


















 Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Минералы и их свойства
Минералы и их свойства Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Сероводород, сульфиды
Сероводород, сульфиды Оксиды. Формулы оксидов ( 8 класс)
Оксиды. Формулы оксидов ( 8 класс) Дисперсные системы (продолжение)
Дисперсные системы (продолжение) Геометрическая кристаллография
Геометрическая кристаллография Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары Кислородные соединения азота
Кислородные соединения азота Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Контроль качества пищевых товаров
Контроль качества пищевых товаров Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Оксиды в минералогии
Оксиды в минералогии Общие сведения о гетероциклах
Общие сведения о гетероциклах Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Structural, substructural properties and chemical composition
Structural, substructural properties and chemical composition Нефелометрический анализ
Нефелометрический анализ Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс
Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды)
Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды) Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Химический анализ почв. Понятия и показатели
Химический анализ почв. Понятия и показатели Водород
Водород Альдольные реакции енолятов
Альдольные реакции енолятов Роль полимеров в нашей жизни
Роль полимеров в нашей жизни ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации
ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации Электролитическая диссоциация. Вещества в растворах
Электролитическая диссоциация. Вещества в растворах Типы химических реакций
Типы химических реакций Сұйықтардағы газ ерітінділері. Генри заңы. Сұйық-сұйық ерітінділердегі бу қысымы. Рауль заңынын ауытқу. Криометрия
Сұйықтардағы газ ерітінділері. Генри заңы. Сұйық-сұйық ерітінділердегі бу қысымы. Рауль заңынын ауытқу. Криометрия