Содержание
- 2. ЦЕЛИ УРОКА: 1. Сформировать понятия об оксидах; 2. Закрепить на оксидах значение химической номенклатуры для бинарных
- 3. БЕСЕДА ПО ВОПРОСАМ: дайте названия следующим соединениям: КСl, КН, Р2О5, СО2. какие соединения называют бинарными? -
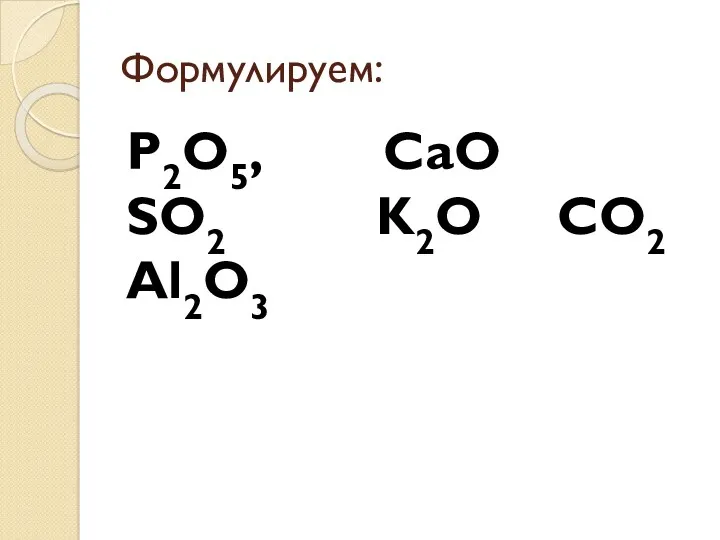
- 5. Формулируем: P2O5, CaО SO2 K2O CO2 Al2O3
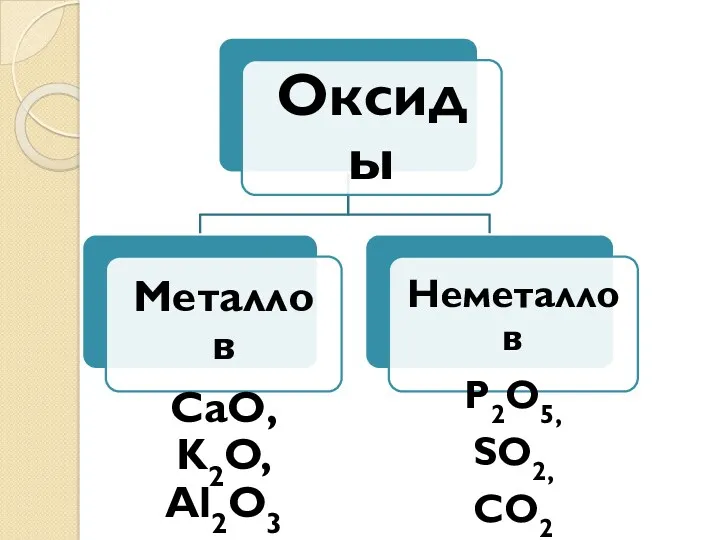
- 6. Оксиды - сложные вещества, состоящие из двух элементов, один из которых кислород. Общая формула - ЭхОу
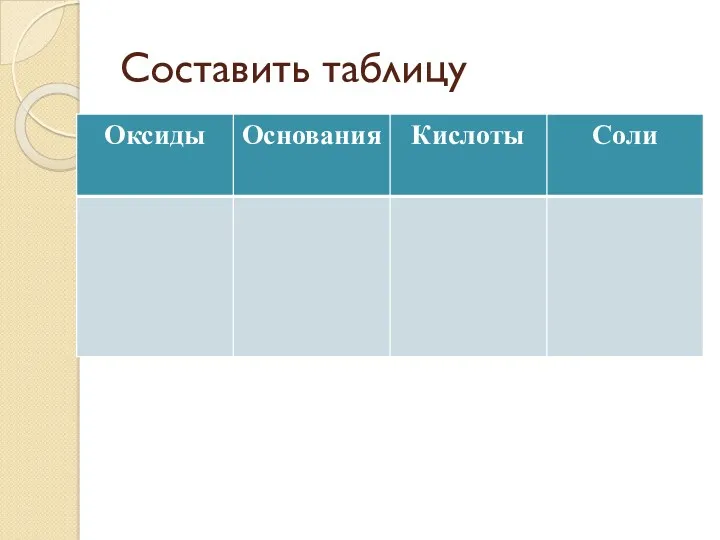
- 7. Составить таблицу
- 8. НАЗВАНИЕ ОКСИДА А) по международной номенклатуре: Название = «Оксид» + название элемента в родительном падеже +
- 9. ЗАДАНИЕ: Дать названия следующим веществам: I вариант II вариант PO3 K2O CuO CaO Al2O3 ZnO SiO2
- 10. ОТВЕТЫ: I вариант II вариант PO3 оксид фосфора K2O оксид калия CuO оксид меди CaO оксид
- 11. ЗАДАНИЕ: Напишите формулы оксидов I вариант II вариант Оксид меди (II) Оксид меди (I) Оксид железа
- 12. ОТВЕТЫ: I вариант II вариант Оксид меди (II) CuO Оксид меди (I) Cu2O Оксид железа (III)Fe2O3
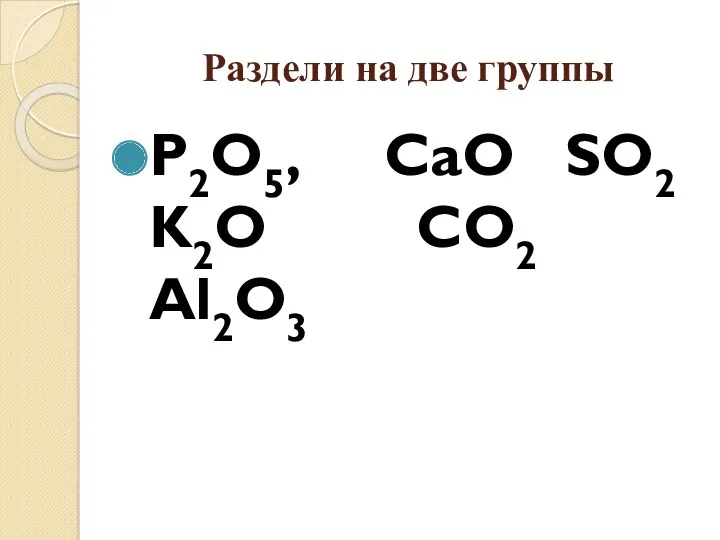
- 13. Раздели на две группы P2O5, CaО SO2 K2O CO2 Al2O3
- 15. Важнейшие оксиды Вода( оксид водорода) - Углекислый газ(оксид углерода(IV) - Негашенная известь(оксид кальция) – Песок( оксид
- 16. Важнейшие оксиды Вода( оксид водорода) - H2O Углекислый газ(оксид углерода(IV) - CO2 Негашенная известь(оксид кальция) –
- 17. Вода
- 18. Углекислый газ(оксид углерода(IV))
- 19. Негашенная известь(оксид кальция) -
- 20. Песок( оксид кремния (IV))
- 21. Изумруд - 2Al2O3 *P2O5 *5H2O
- 22. Рубин - Al2O3
- 23. Сапфир - Al2O3
- 24. Аметист - SiO2 (кремнезём)
- 25. Агат - SiO2 (кремнезём)
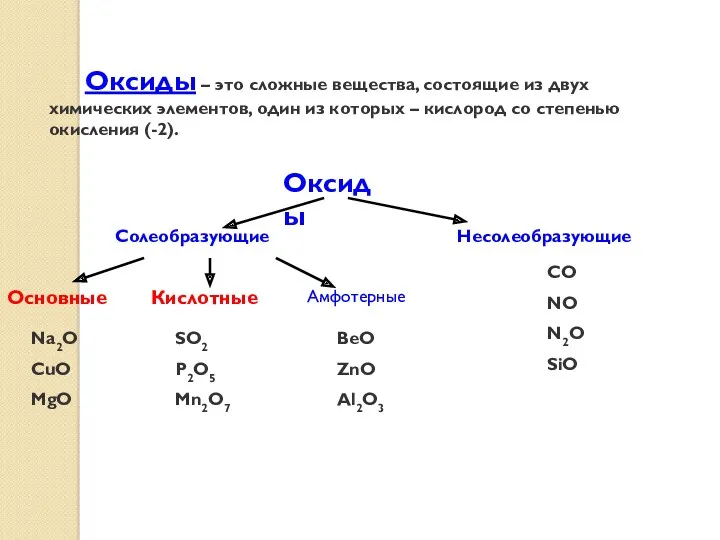
- 26. Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со
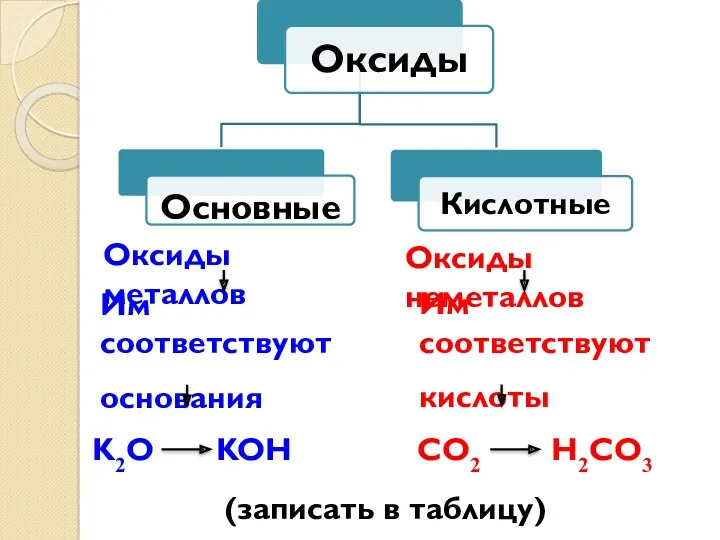
- 28. Оксиды металлов Оксиды неметаллов Им соответствуют основания Им соответствуют кислоты K2O KOH CO2 H2CO3 (записать в
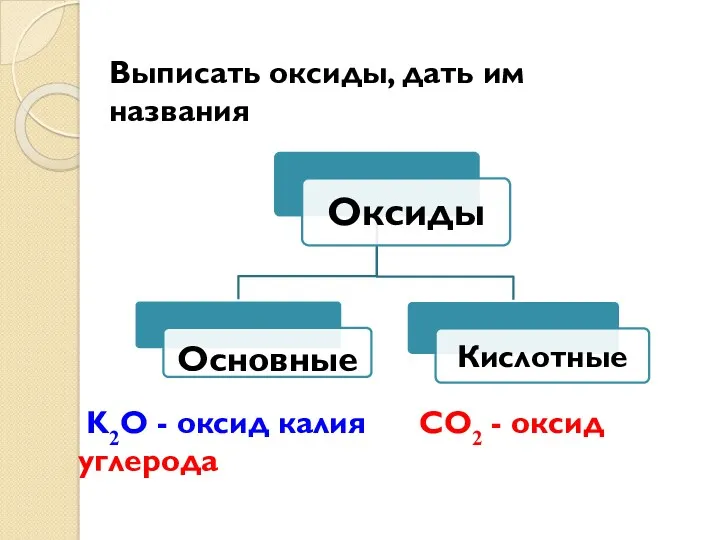
- 29. Выписать оксиды, дать им названия K2O - оксид калия CO2 - оксид углерода
- 30. Выпишите оксиды, 1 вариант CaO, NaOH, CO2, H2SO3, FeCl3, N2O5, Zn(OH)2, N2O, Li2O, Fe2O3, W(OH)2,SO2 Na2SO4,
- 31. Химические свойства оксидов Основные оксиды С кислотами С водой С кислотными оксидами Кислотные оксиды С растворимыми
- 32. Химические свойства основных оксидов 1) Взаимодействуют с кислотами выписать пример из учебника 2) с водой выписать
- 33. Химические свойства кислотных оксидов с растворимы основаниями (щелочами) выписать пример из учебника 2) с водой выписать
- 34. Домашнее задание Параграфы 14, 23
- 35. Выпишите оксиды, дайте им названия CaO, NaOH, CO2, H2SO3, CaCl2, FeCl3, Zn(OH)2, N2O5, Al2O3, Ca(OH)2, N2O,
- 36. Химические свойства основных оксидов 1) Взаимодействуют с кислотами CuO + H2SO4 = CuSO4 +H2O 2) с
- 38. Скачать презентацию

























 Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Соединения галогенов
Соединения галогенов Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования Химическая связь
Химическая связь Массовая доля вещества в растворе
Массовая доля вещества в растворе Визначення іонів лужних і лужноземельних іонів у природних водах
Визначення іонів лужних і лужноземельних іонів у природних водах Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Пищевые добавки
Пищевые добавки Коллигативные свойства растворов
Коллигативные свойства растворов Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Литий. Физические свойства лития
Литий. Физические свойства лития Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 20230419_izomery
20230419_izomery Растворы и растворители
Растворы и растворители Фосфор и его соединения
Фосфор и его соединения Общая характеристика неметаллов
Общая характеристика неметаллов Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Введение в аналитическую химию. Введение в качественный анализ
Введение в аналитическую химию. Введение в качественный анализ Алканы. Гомологи
Алканы. Гомологи Методы разделения и исследования состава нефти и газа
Методы разделения и исследования состава нефти и газа Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Хром. Элемент под № 24
Хром. Элемент под № 24 Аммиак. Состав вещества
Аммиак. Состав вещества Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Породообразующие минералы
Породообразующие минералы Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Взрывоопасные грузы
Взрывоопасные грузы