Поширеність в пророді
4
Літій досить широко розповсюджений. Кількість літію в земній корі
досягає 0,002 ат. %.
Рубідій, цезій і францій у чистому вигляді не зустрічаються. Рубідій і цезій у невеликих кількостях містяться в мінералах калію (у вигляді домішок). Францій — елемент, отриманий штучно, тому в природі не зустрічається.
Натрій входить до числа найпоширеніших елементів — 2,0 ат. %. Він входить до складу безлічі мінералів (у тому числі природних силікатів), серед яких найважливішими є кам'яна сіль, мірабіліт, кріоліт, бура та ін.
Найважливіші мінерали калію — сильвін, карналіт, каїніт.






 Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Растворы. Процесс растворения
Растворы. Процесс растворения Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Циклоалкандар
Циклоалкандар Гидродинамические свойства полимеров. Полиэлектролиты
Гидродинамические свойства полимеров. Полиэлектролиты Камни и Телец
Камни и Телец Physical and chemical properties of oil
Physical and chemical properties of oil Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение) Химическая связь в кластерах
Химическая связь в кластерах Кислоты. Классификация кислот по строению кислотного остатка
Кислоты. Классификация кислот по строению кислотного остатка Введение в химическую термодинамику
Введение в химическую термодинамику Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кристали. Їх вирощування і застосування
Кристали. Їх вирощування і застосування Вода. Практическая работа
Вода. Практическая работа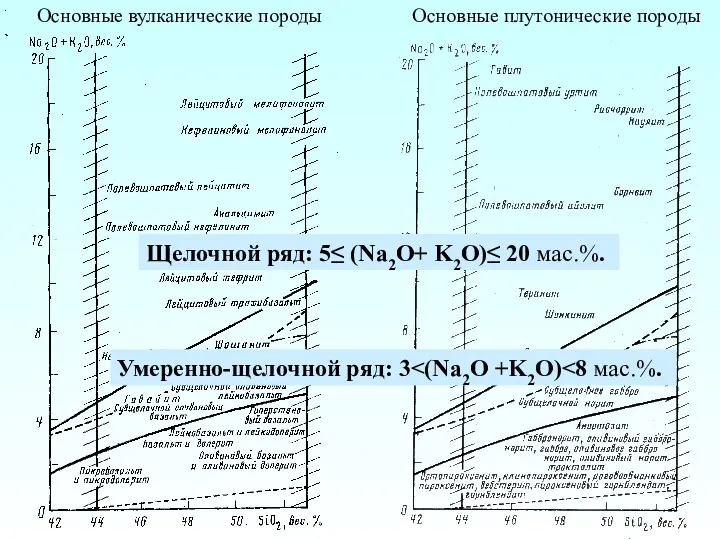 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Физико-химические процессы переработки нефти. Термические процессы
Физико-химические процессы переработки нефти. Термические процессы Азотная кислота
Азотная кислота Химия и косметика
Химия и косметика Химическая связь
Химическая связь Карбоновые кислоты
Карбоновые кислоты Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері
Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері Кристалічний і аморфний стани твердих речовин
Кристалічний і аморфний стани твердих речовин Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Мыло
Мыло Типы химических реакций
Типы химических реакций Классификация моторных масел
Классификация моторных масел