Содержание
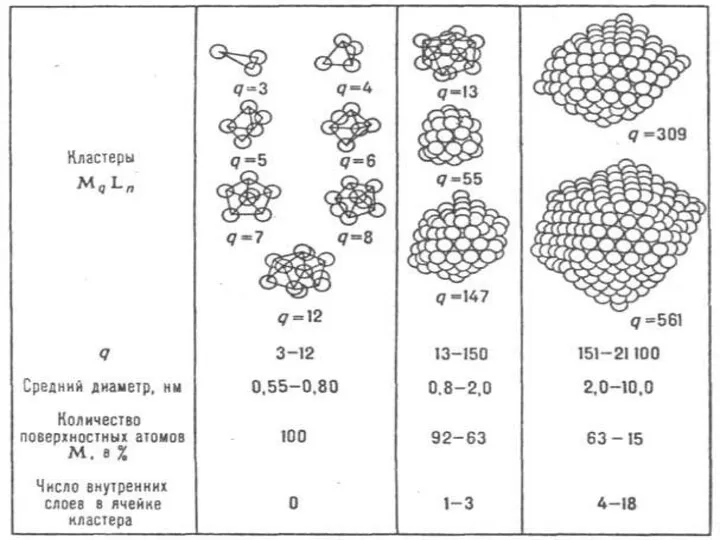
- 2. Кластерные соединения Кластер — химическое соединение, содержащее ковалентную связь между атомами или молекулами. Кластерв могут быть
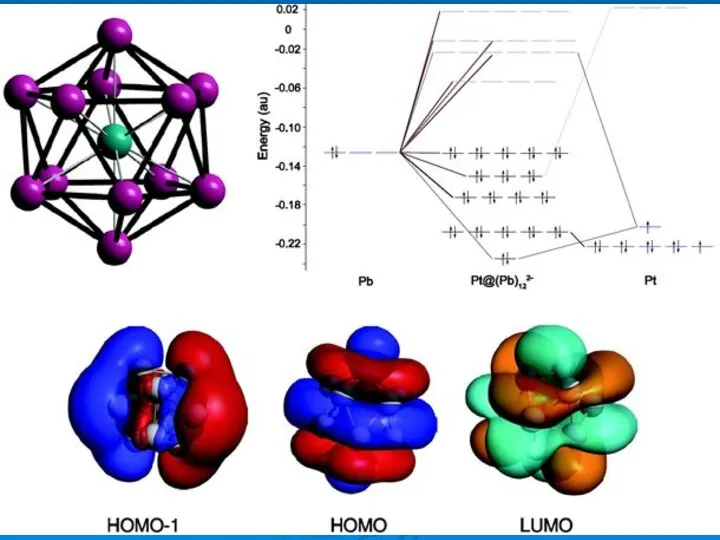
- 5. 13-atom Pt cluster
- 6. Примером карбонильного кластера с 60 валентными электронами может служить соединение состава Ir4(CO)12 . Атомы иридия образуют
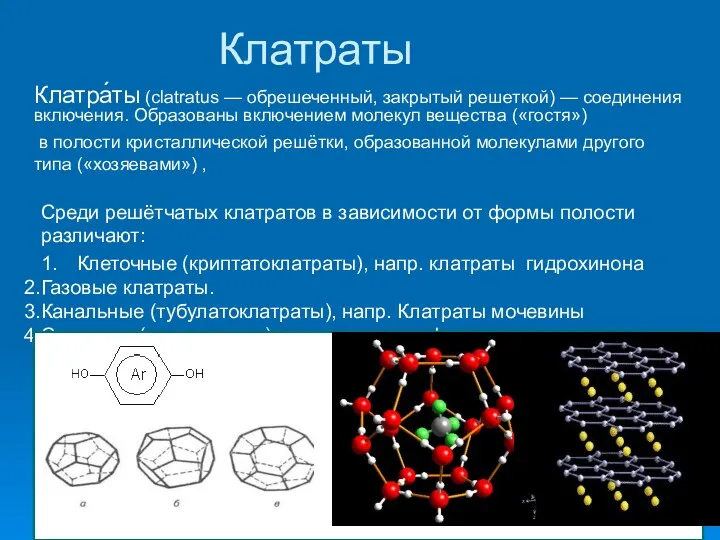
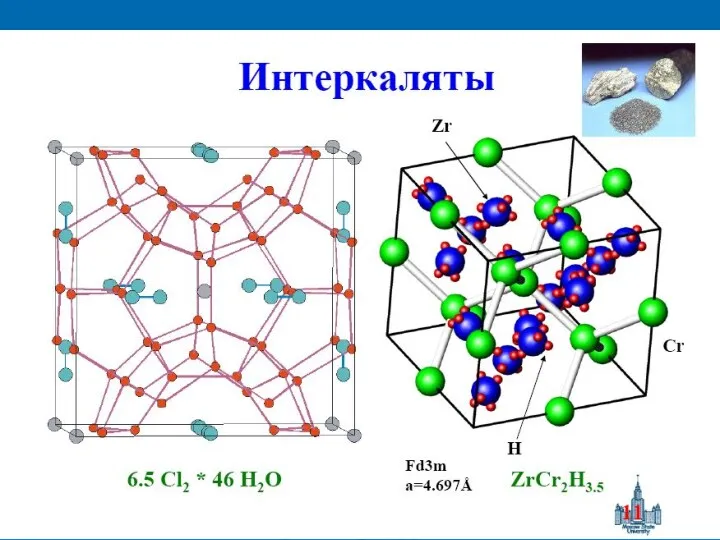
- 7. Клатраты Клатра́ты (clatratus — обрешеченный, закрытый решеткой) — соединения включения. Образованы включением молекул вещества («гостя») в
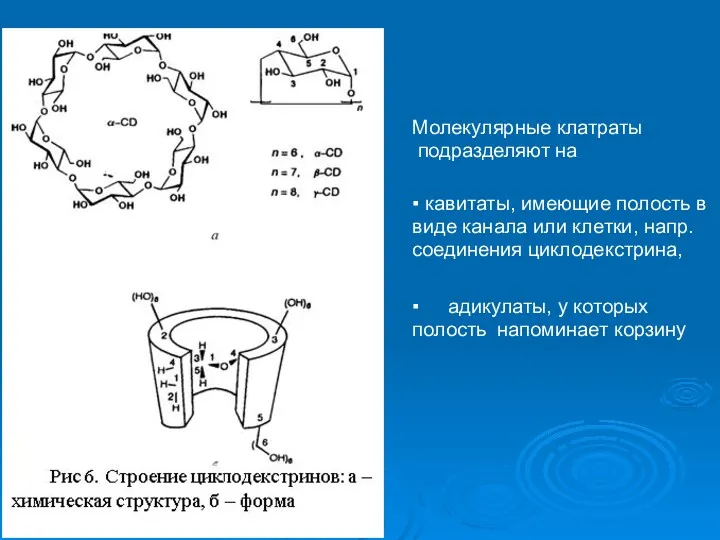
- 8. Молекулярные клатраты подразделяют на ▪ кавитаты, имеющие полость в виде канала или клетки, напр. соединения циклодекстрина,
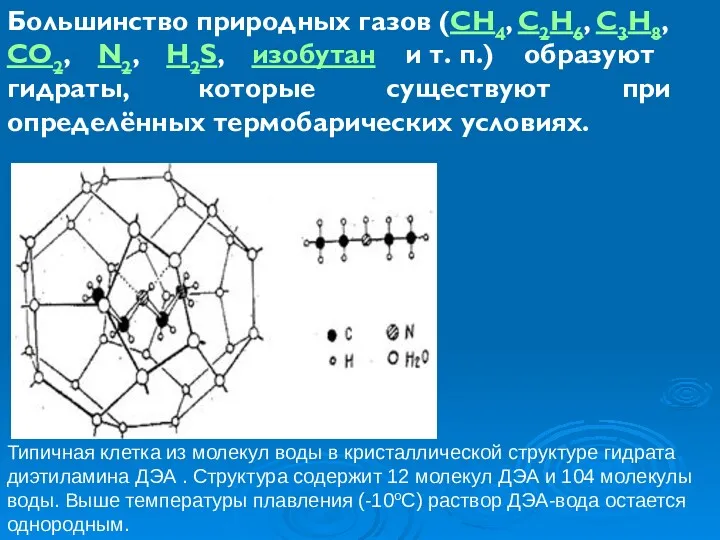
- 9. Большинство природных газов (CH4, C2H6, C3H8, CO2, N2, H2S, изобутан и т. п.) образуют гидраты, которые
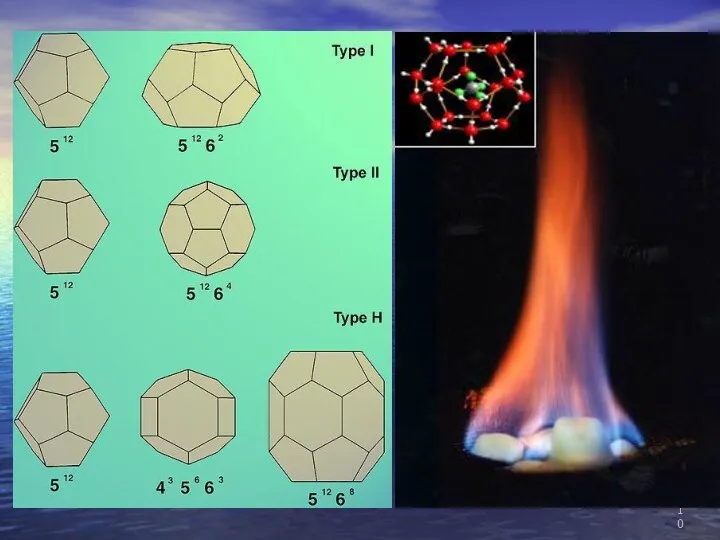
- 11. Благодаря своей клатратой структуре единичный объём газового гидрата может содержать до 160—180 объёмов чистого газа. Плотность
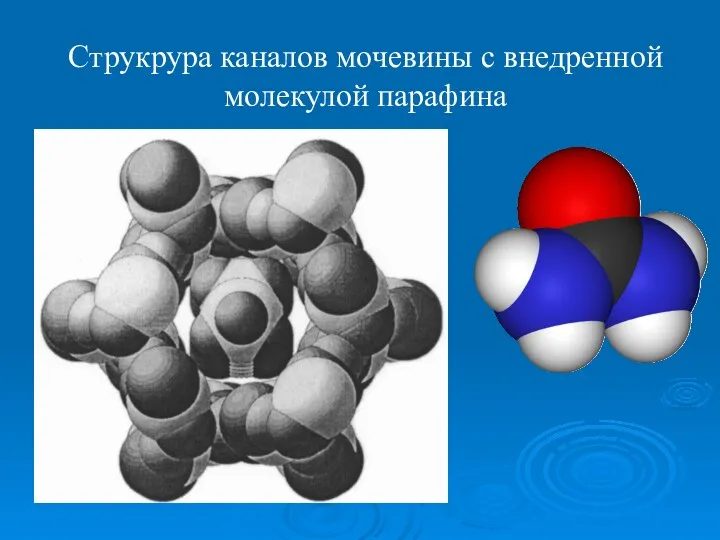
- 13. Струкрура каналов мочевины с внедренной молекулой парафина
- 14. Термодинамическая стабильность клатратов обеспечивается благоприятным расположением молекул в полостях каркаса, вследствие чего слабые межмолекулярные взаимодействия приводят
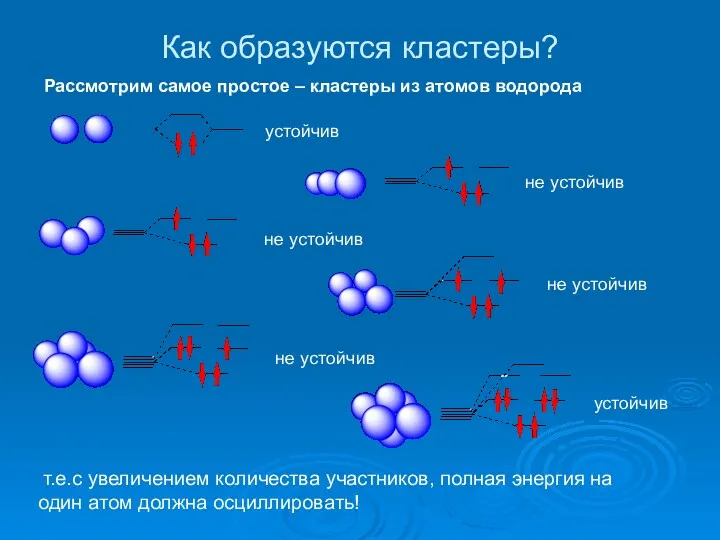
- 15. Как образуются кластеры? Рассмотрим самое простое – кластеры из атомов водорода устойчив не устойчив устойчив не
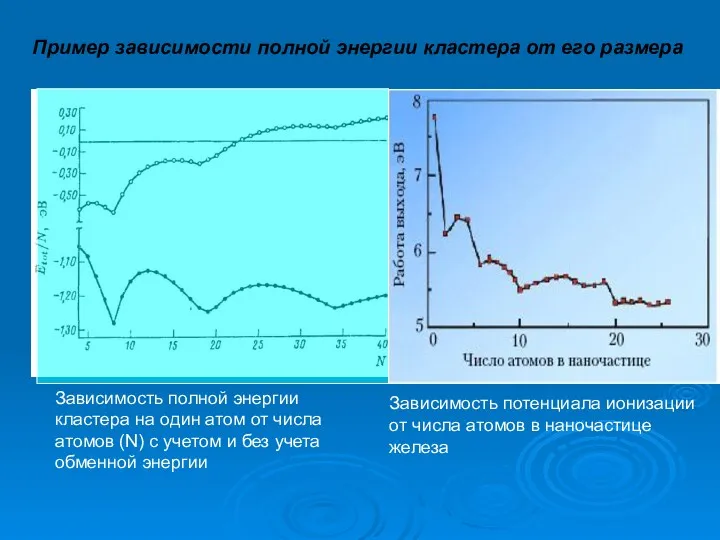
- 16. Зависимость потенциала ионизации от числа атомов в наночастице железа Пример зависимости полной энергии кластера от его
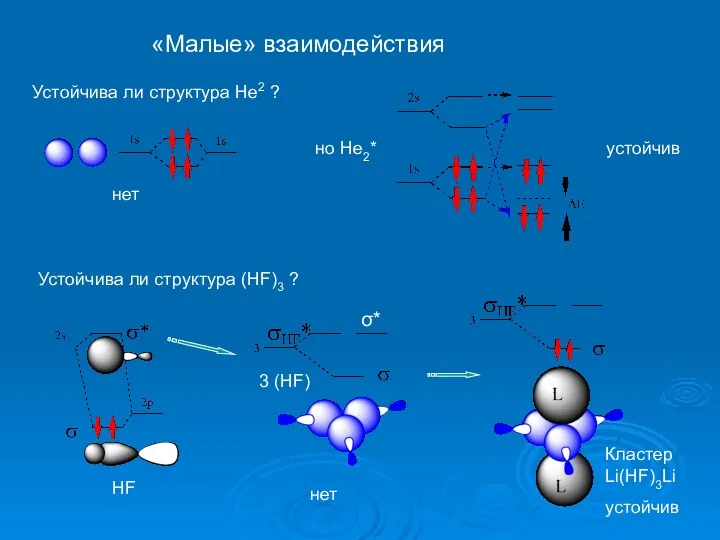
- 17. «Малые» взаимодействия Устойчива ли структура Не2 ? нет но Не2* устойчив Устойчива ли структура (НF)3 ?
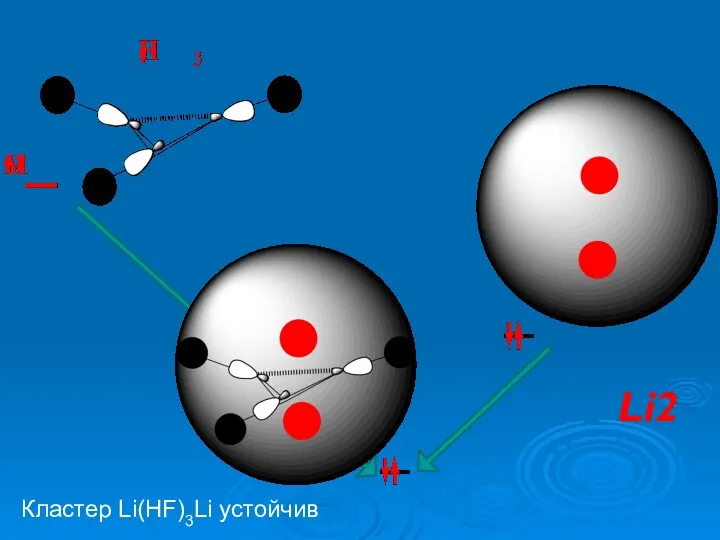
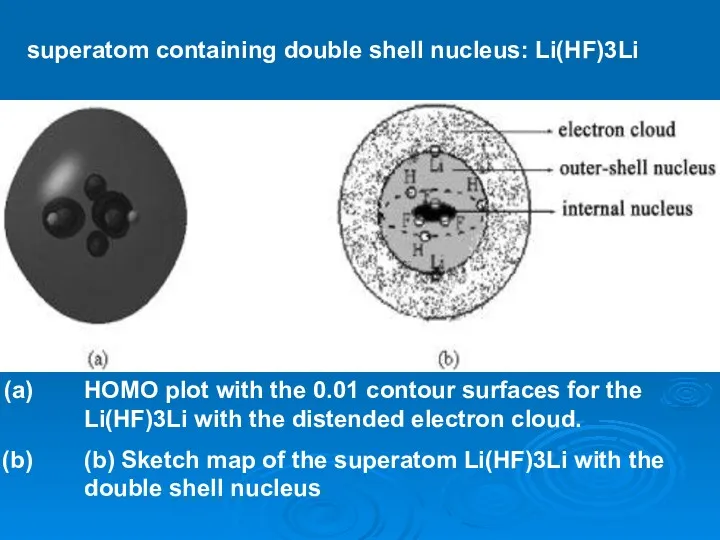
- 18. Кластер Li(HF)3Li устойчив Li2
- 19. HOMO plot with the 0.01 contour surfaces for the Li(HF)3Li with the distended electron cloud. (b)
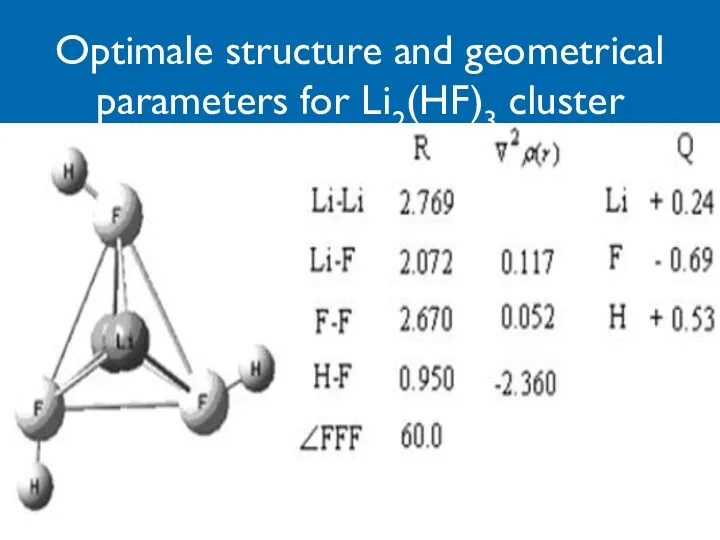
- 20. Optimale structure and geometrical parameters for Li2(HF)3 cluster
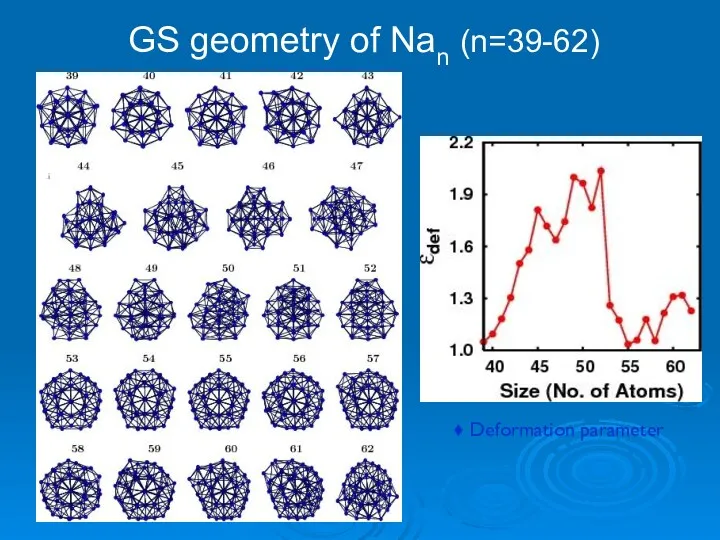
- 21. GS geometry of Nan (n=39-62) ♦ Deformation parameter
- 23. «Малые» взаимодействия Кластер (HF)3 стабилен в над-кластере Li(HF)3Li после получения двух электронов с образованием аниона [(HF)3]
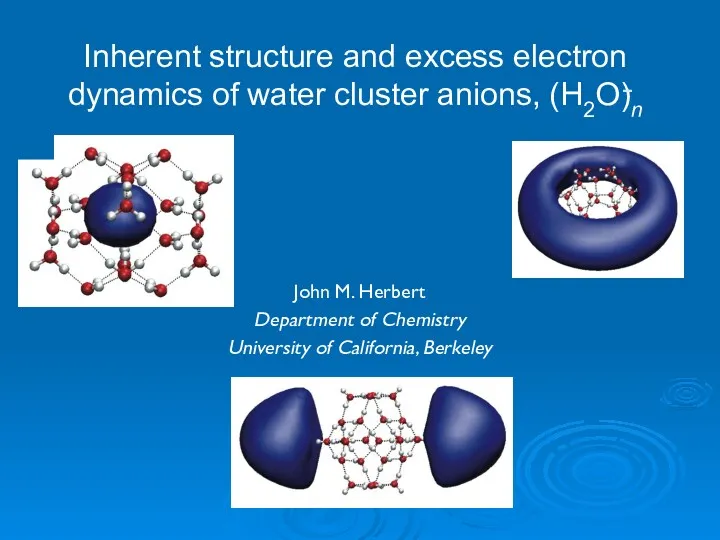
- 24. Inherent structure and excess electron dynamics of water cluster anions, (H2O)n – John M. Herbert Department
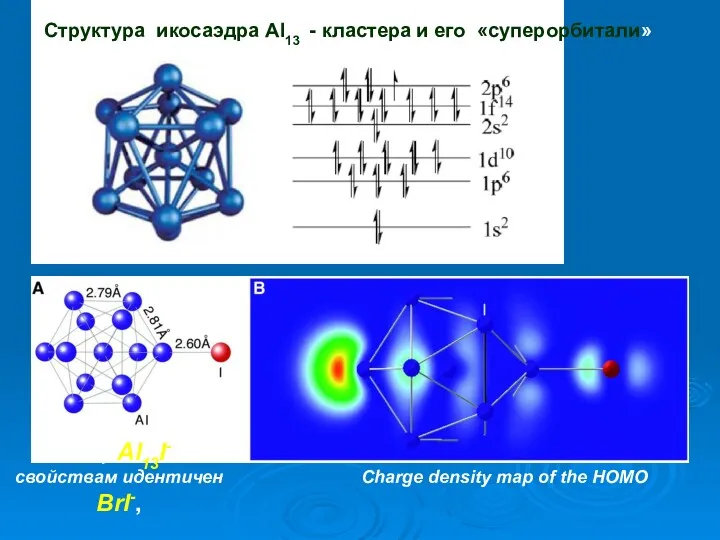
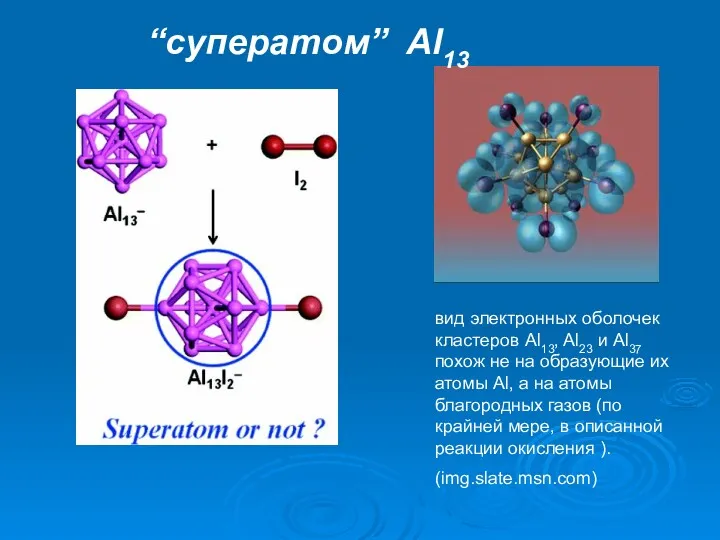
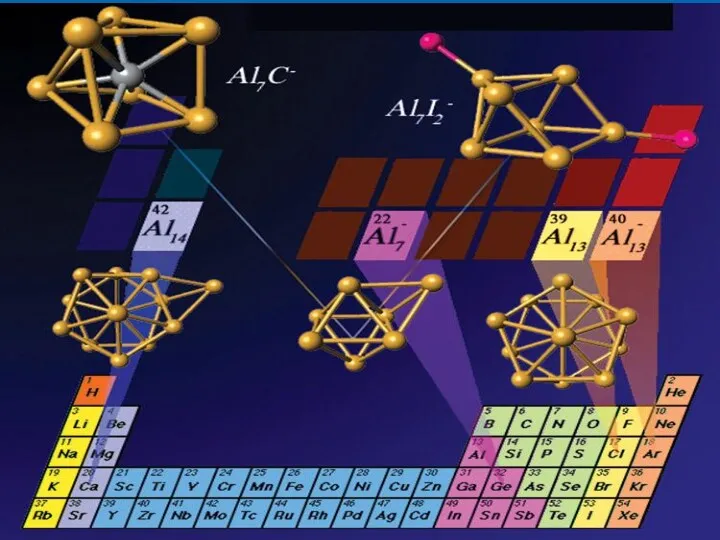
- 25. Структура икосаэдра Al13 - кластера и его «суперорбитали» Charge density map of the HOMO Кластер Al13I-
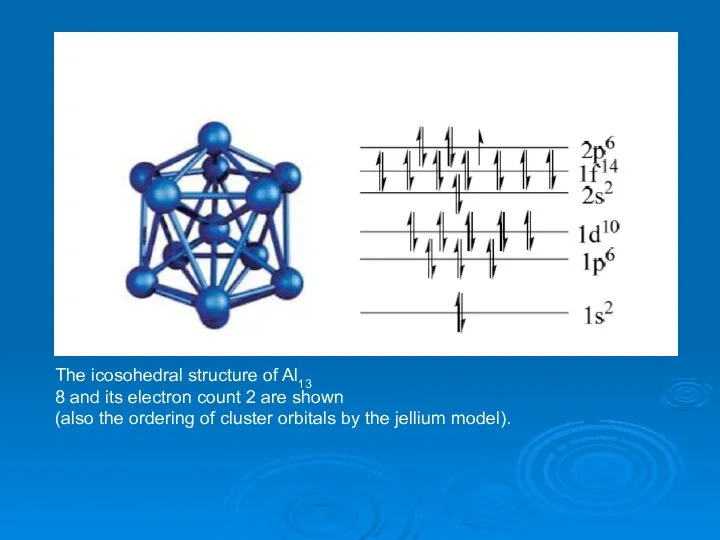
- 26. The icosohedral structure of Al13 8 and its electron count 2 are shown (also the ordering
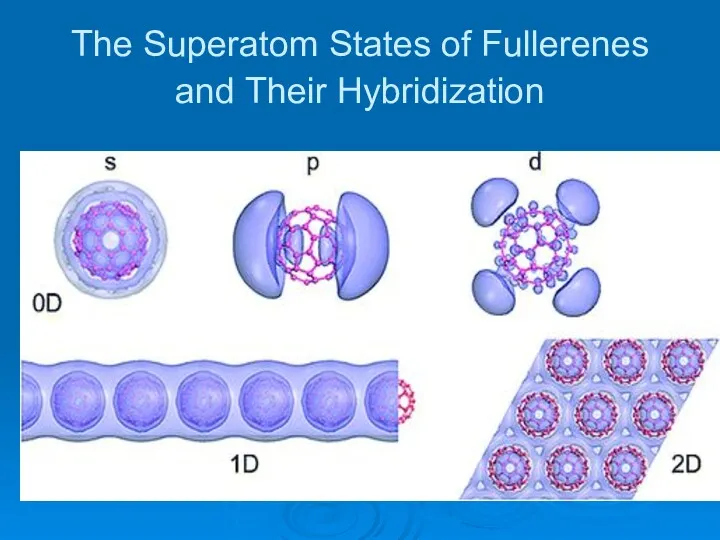
- 28. The Superatom States of Fullerenes and Their Hybridization
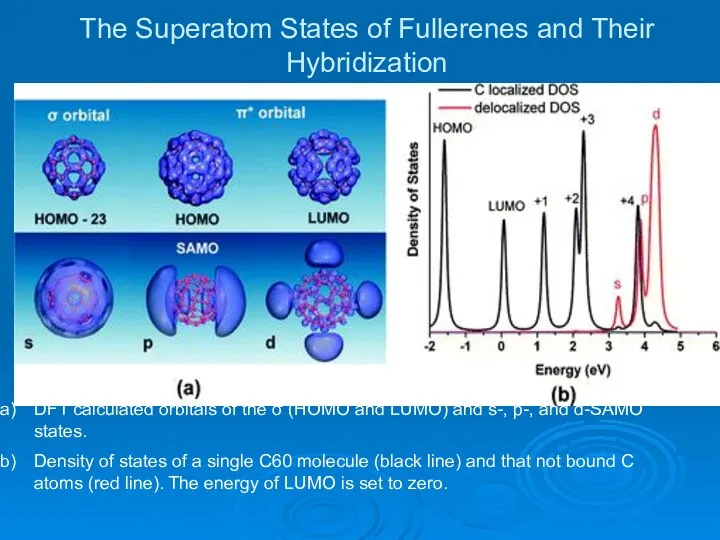
- 29. The Superatom States of Fullerenes and Their Hybridization DFT calculated orbitals of the σ (HOMO and
- 30. атомы алюминия могут соединяться в упорядоченные устойчивые кластеры, мимикрирующие под другие элементы периодической таблицы. Так, опыты
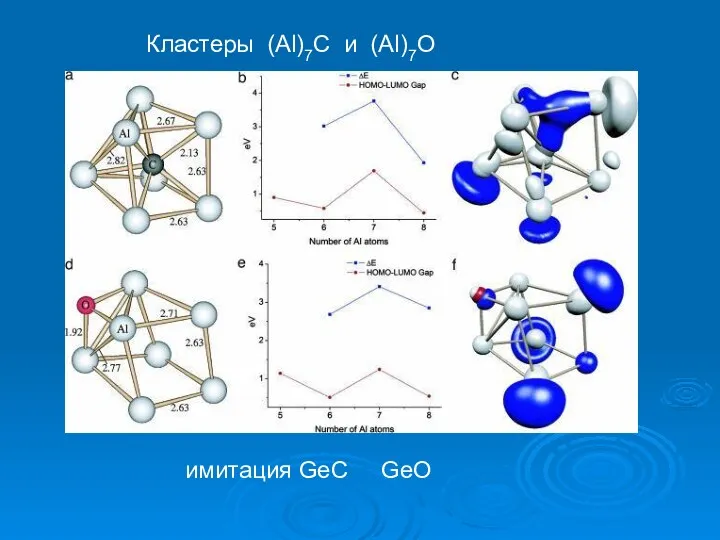
- 31. Кластеры (Al)7C и (Al)7O имитация GeC GeO
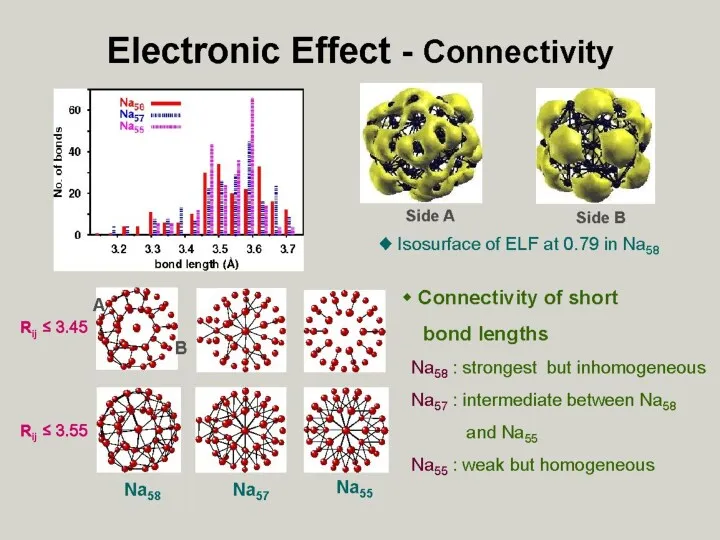
- 32. вид электронных оболочек кластеров Al13, Al23 и Al37 похож не на образующие их атомы Al, а
- 33. Cуператомы — кластеры, образованные атомами определенного элемента, свойства которых неожиданно оказываются похожими на свойства отдельных атомов
- 34. Группа профессора Андреаса Шмидта-Отта (Andreas Schmidt-OttГруппа профессора Андреаса Шмидта-Отта (Andreas Schmidt-Ott) и доктора Кристиана Пейнеке (Christian
- 35. Сравнение данных, полученных при изучении платины и "изоэлектронного" ей карбида вольфрама, показало, что перед учёными практически
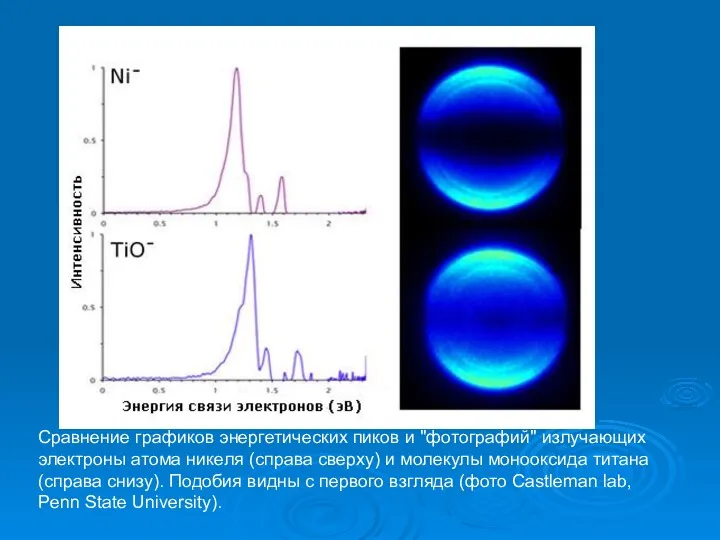
- 36. Сравнение графиков энергетических пиков и "фотографий" излучающих электроны атома никеля (справа сверху) и молекулы монооксида титана
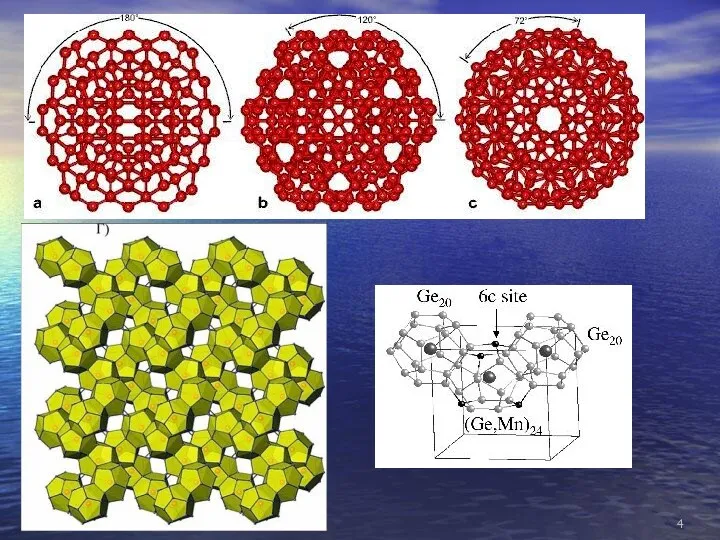
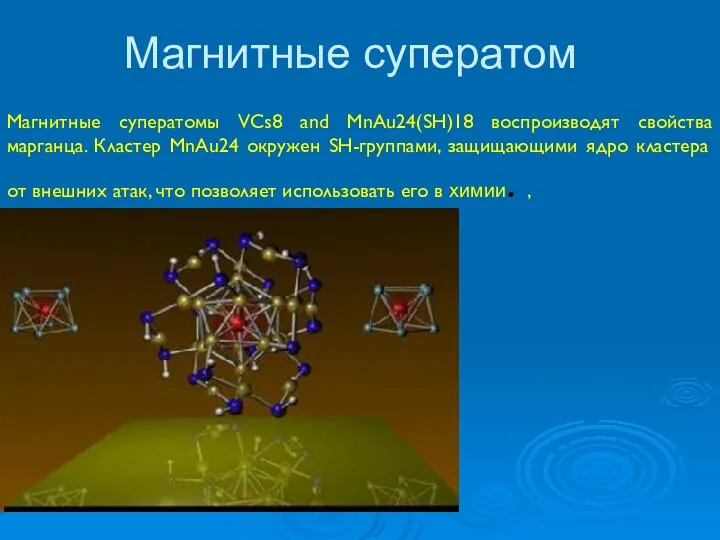
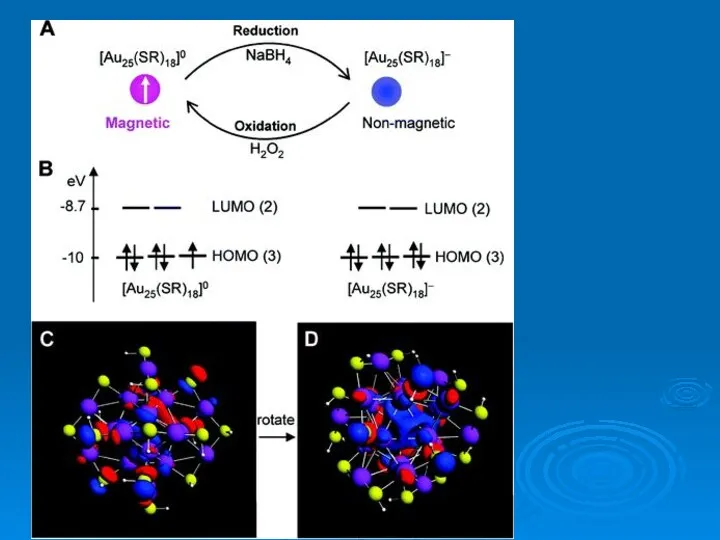
- 37. Магнитные суператом Магнитные суператомы VCs8 and MnAu24(SH)18 воспроизводят свойства марганца. Кластер MnAu24 окружен SH-группами, защищающими ядро
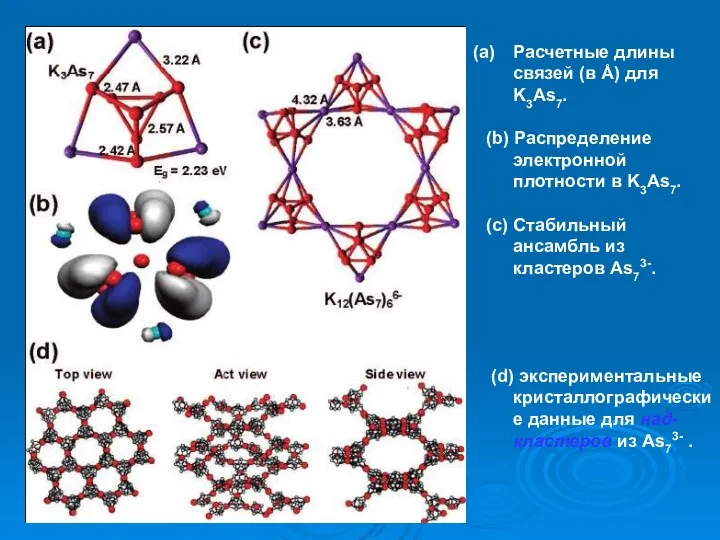
- 38. Расчетные длины связей (в Å) для K3As7. (b) Распределение электронной плотности в K3As7. (c) Стабильный ансамбль
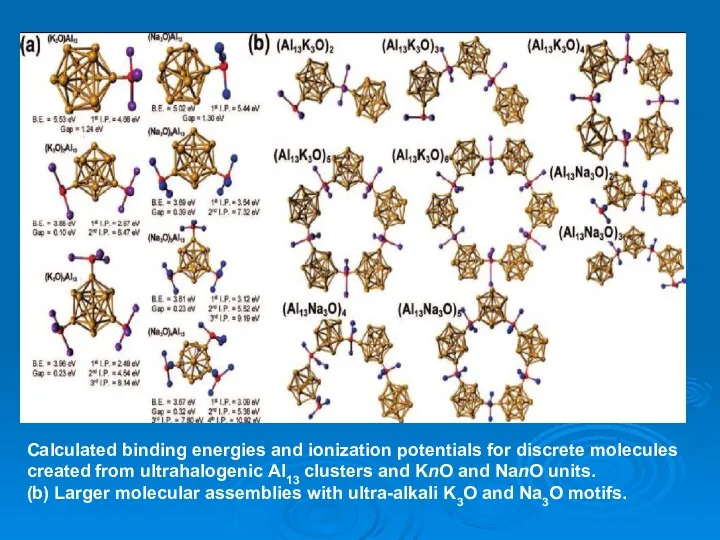
- 39. Calculated binding energies and ionization potentials for discrete molecules created from ultrahalogenic Al13 clusters and KnO
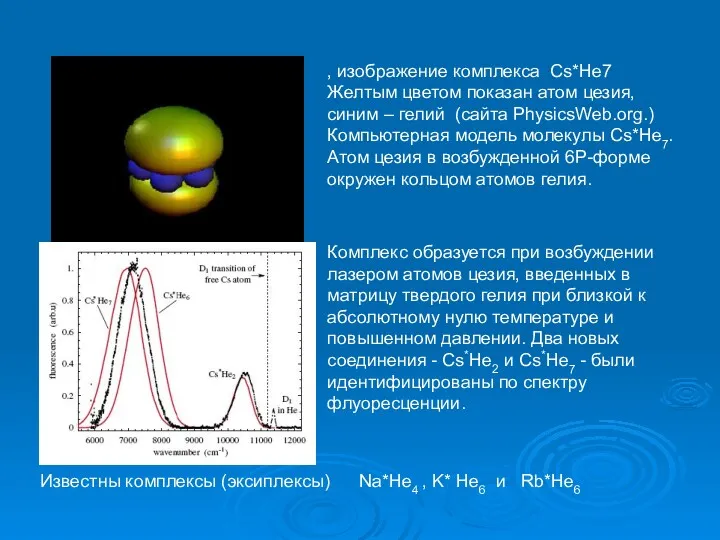
- 41. , изображение комплекса Cs*He7 Желтым цветом показан атом цезия, синим – гелий (сайта PhysicsWeb.org.) Компьютерная модель
- 42. Electronic distributions of free Cs in its lowest excited levels: spherical distribution of 6P1/2 level (|MJ|
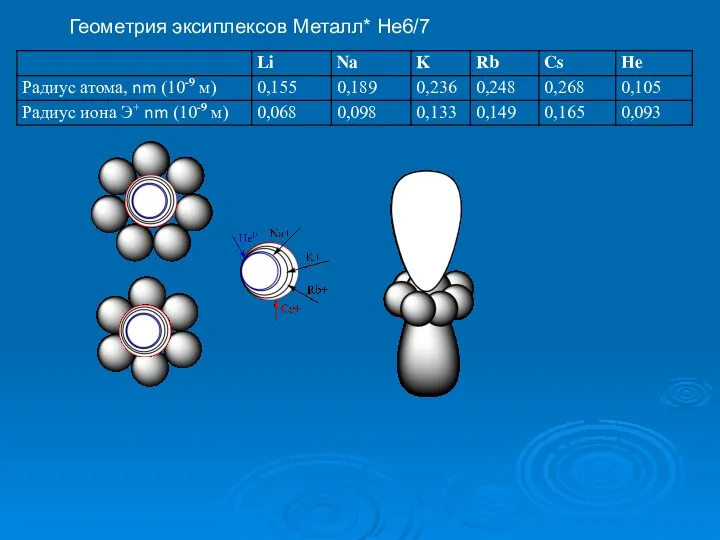
- 43. Геометрия эксиплексов Металл* Не6/7
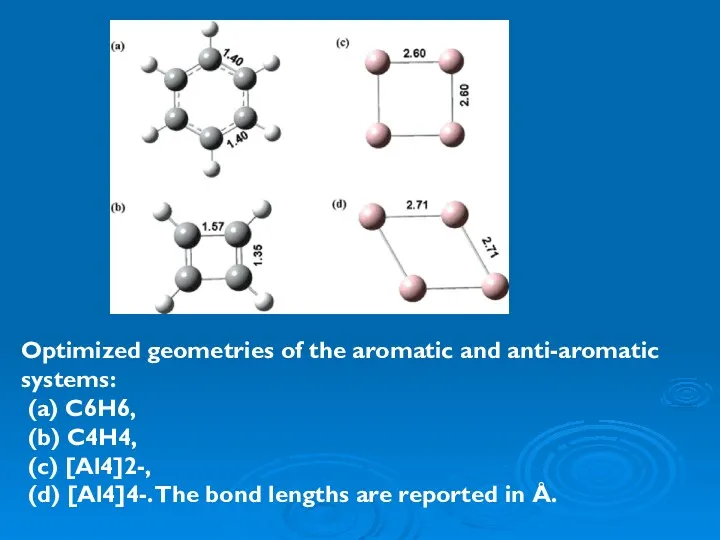
- 44. Optimized geometries of the aromatic and anti-aromatic systems: (a) C6H6, (b) C4H4, (c) [Al4]2-, (d) [Al4]4-.
- 45. The structures of ([Al4]2- Ca2+)2 all-metal aromatic molecules
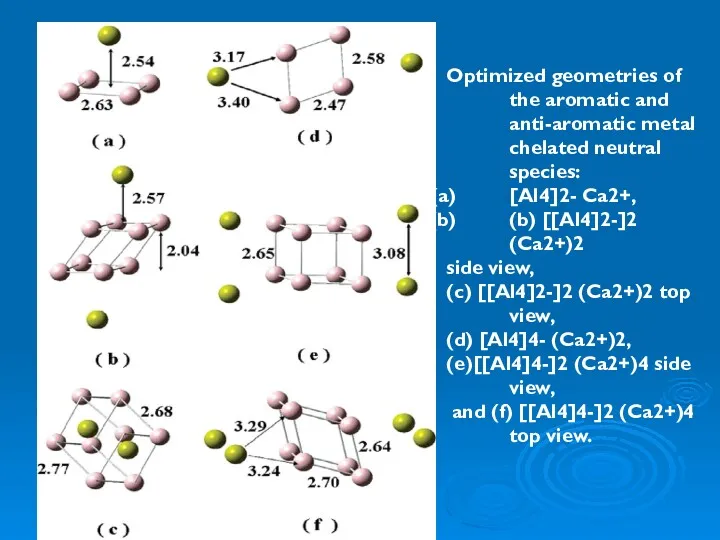
- 46. Optimized geometries of the aromatic and anti-aromatic metal chelated neutral species: [Al4]2- Ca2+, (b) [[Al4]2-]2 (Ca2+)2
- 48. 1. Что такое кластер, клатрат ? 2. Свойства газовых гидратов 3. Природа связи в кластерах и
- 50. Скачать презентацию











![The structures of ([Al4]2- Ca2+)2 all-metal aromatic molecules](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/226202/slide-44.jpg)

 Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Основания - свойства ТЭД
Основания - свойства ТЭД Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства
Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Предельные одноатомные спирты
Предельные одноатомные спирты Stoffe bestehen aus kleinsten teilchen
Stoffe bestehen aus kleinsten teilchen Атом. Будова атома
Атом. Будова атома Типы химических реакций. Систематизация и обобщение знаний
Типы химических реакций. Систематизация и обобщение знаний Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Мұнайды өңдеудің химиялық процестерінің теориялық негіздері
Мұнайды өңдеудің химиялық процестерінің теориялық негіздері Строение атома
Строение атома Водород. Распространенность в природе
Водород. Распространенность в природе Водород
Водород Полімери та їх властивості
Полімери та їх властивості Типы химических реакций. Практическая работа
Типы химических реакций. Практическая работа Оксиды. 9 класс
Оксиды. 9 класс Задачи на вывод формулы органических веществ
Задачи на вывод формулы органических веществ Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов
Открытие Д.И. Менделеевым периодического закона. Периодическая система химических элементов Ненасыщенные углеводороды. Алкены
Ненасыщенные углеводороды. Алкены Интересные факты о химических веществах
Интересные факты о химических веществах Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ
Лекция №11 ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Цинк в функциональных пищевых и кормовых продуктах
Цинк в функциональных пищевых и кормовых продуктах Лекция 15. Аминокислоты
Лекция 15. Аминокислоты Химический элемент радий
Химический элемент радий Рекомендации по использованию пластмасс в быту. Опасные типы пластмасс
Рекомендации по использованию пластмасс в быту. Опасные типы пластмасс Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Коррозия металлов
Коррозия металлов