Слайд 2

Цели урока:
формирование знаний о химических свойствах оснований в свете ТЭД.
развитие знаний
о свойствах веществ;
развитие умений и навыков составления уравнений реакций, характеризующих свойства оснований.
Слайд 3

Актуализация опорных знаний:
Химический словарь: ТЭД, кислоты (их классификация).
С какими веществами соляная
кислота реагирует до конца: магний, оксид меди (II), гидроксид бария, гидроксид алюминия, нитрат меди (II), нитрат серебра?
Слайд 4

Химическая сказка
Л.С. Федорченко
Слайд 5

Жил да был в стране чудесной
Серебристо – белый Натрий
Слайд 6

И однажды он увидел раскрасавицу одну.
От нее в восторге были
Щелочные
все металлы,
Полюбил ее и Натрий,
Возвестив на всю страну:
«Я хочу на ней жениться!»
Слайд 7

Только Лед, отец принцессы,
Строг был с дочерью любимой,
Раскрасавицей Водой,
Натрия поймать велел
он,
Посадить его в темницу
И у входа он поставил
Вазелина целый строй.
Слайд 8

Но Любовь не умирает!
Родилась у них принцесса,
Дочку Щелочью назвали,
Раскрасавицей была.
Слайд 9

Лакмус чопорный и строгий
Слайд 10

Слайд 11

Но всех больше улыбалась
Лишь Фенолуфталеину
И от счастья он готов был
Переплыть
пролив Ла – Манш.
Слайд 12

Вышла замуж за другого –
Звали Хлороводород.
Слайд 13

Сын у них родился вскоре,
Хлорид натрия назвали,
И своею службой людям
Он
сегодня очень горд.
Слайд 14
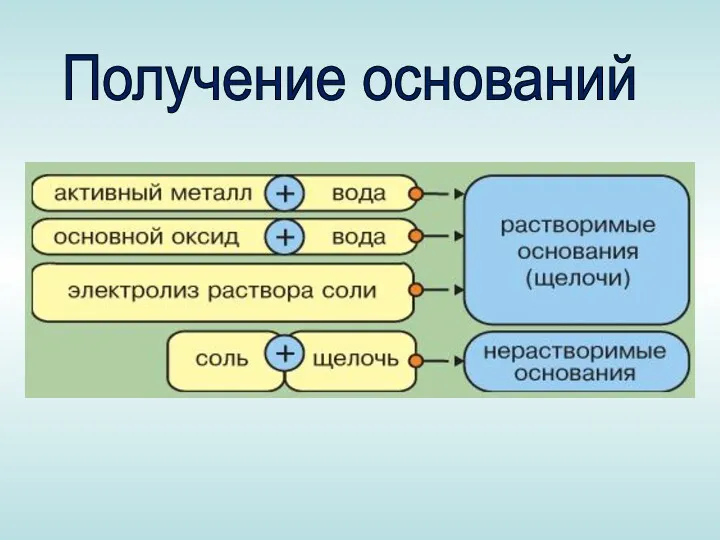
Слайд 15

2Na + 2H2O = 2NaOH + H2
Натрий + вода =
гидроксид натрия + водород
Слайд 16

При растворении в воде оксида кальция образуется гидроксид кальция (малорастворимый)
Слайд 17

Получение нерастворимых оснований:
Соль + щёлочь = новая соль + нерастворимое основание
CuSO4 NaOH Cu(OH)2
Слайд 18
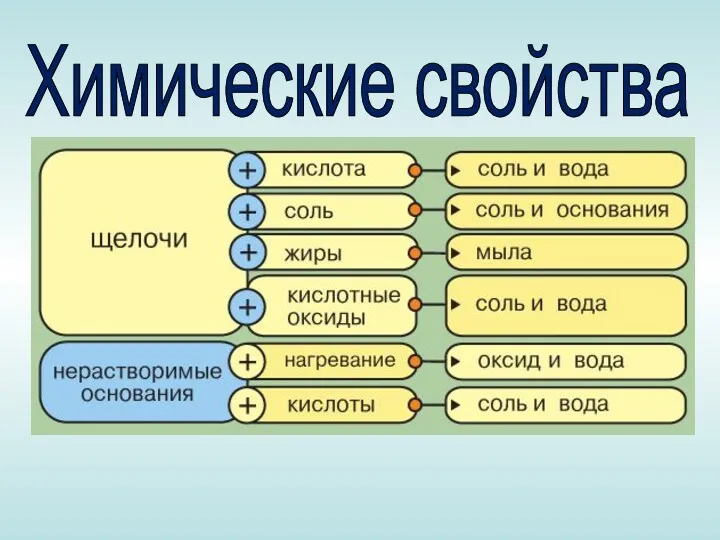
Слайд 19

1. Все щёлочи называют едкими, т. к. они разрушают бумагу, ткани,
древесину.
Слайд 20

2. Щёлочи изменяют окраску индикатора фенолфталеина (бесцветный – малиновый)
Слайд 21
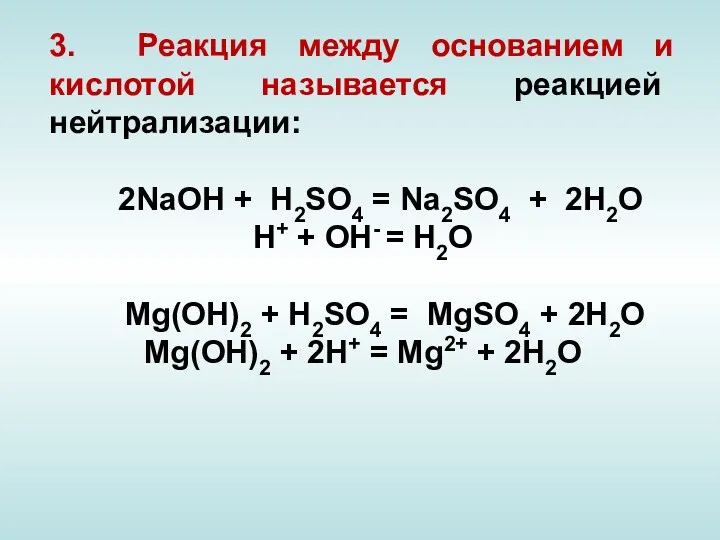
3. Реакция между основанием и кислотой называется реакцией нейтрализации:
2NaOH
+ H2SO4 = Na2SO4 + 2H2O
Н+ + ОН- = Н2О
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
Mg(OH)2 + 2Н+ = Mg2+ + 2H2O
Слайд 22

4. Основания взаимодействуют с кислотой с образованием соли и воды:
Mn(OH)2
+ 2HCl = MnCl2 + 2H2O
Mn(OH)2 + 2Н+ = Mn2+ + 2H2O
Fe(OH)2 + H2SO4 = FeSO4 +2H2O
Fe(OH)2 + 2Н+ = Fe 2+ + 2H2O
Слайд 23

5. Взаимодействие щелочей с кислотными оксидами:
СО2 + Са(ОН)2 = СаСО3 ↓
+ Н2О
Слайд 24

6. Нерастворимые основания разлагаются при нагревании:
Cu(OH)2 CuО + H2O
Слайд 25

Запомните:
Основание – это сложное вещество, состоящее из атомов металла и одной
или нескольких гидроксогрупп. Гидроксогруппа всегда одновалентна.
2. Большинство оксидов металлов I и II А групп периодической системы реагируют с водой с образованием оснований.
3. Растворимые в воде основания называются щелочами.
Слайд 26

Запомните:
4. При контакте с щелочами фенолфталеин окрашивается в малиновый цвет, метилоранж
– в желтый, а универсальный индикатор и лакмусовая бумага – в синий.
5. Гидроксиды калия и натрия – едкие вещества. Они очень гигроскопичны. Растворение этих веществ в воде является экзотермическим процессом.

























 Фенол и его свойства
Фенол и его свойства Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1 Валентность и степень окисления
Валентность и степень окисления Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Приборы радиационной и химической разведки
Приборы радиационной и химической разведки Круговорот воды в природе
Круговорот воды в природе Plastics слайды
Plastics слайды Химическая связь
Химическая связь Основы квантовой химии
Основы квантовой химии Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров
Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи
Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи Оксид фосфора
Оксид фосфора Вещества и материалы. Классификация веществ. Реакции нейтрализации
Вещества и материалы. Классификация веществ. Реакции нейтрализации Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика
Симметрия, структура и свойства твердых тел – кристаллография и кристаллофизика Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы
Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы Азот
Азот Классификация и свойства кислот
Классификация и свойства кислот Действующие вещества. Лексикон
Действующие вещества. Лексикон Растворы электролитов
Растворы электролитов Взаємодія кисеню зі складними речовинами
Взаємодія кисеню зі складними речовинами Производство серной кислоты
Производство серной кислоты Хинонды бояғыштар
Хинонды бояғыштар Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Равновесия в растворах электролитов
Равновесия в растворах электролитов Stoffe bestehen aus kleinsten teilchen
Stoffe bestehen aus kleinsten teilchen Зелёная химия
Зелёная химия