Содержание
- 2. Цель урока: Сформировать представление о строении атома и молекулы азота. Рассмотреть физические и химические свойства азота.
- 3. открытие открыт Д. Резерфордом в 1772г.,
- 4. Получил название назван А.Лавуазье в 1787г. «азоэ» (греч.) - «безжизненный», не поддерживает горение (горящая лучина в
- 5. Распространение в природе По распространенности в земной коре азот занимает 17-е место, на его долю приходится
- 7. Природный азот состоит из двух стабильных изотопов: 14N — 99,635 % 15N — 0,365 %
- 10. N2 молекулярная формула
- 12. Получение
- 13. 1. Разложением нитритов NH4NO2 N2 + 2H2O в лаборатории
- 15. 2. Реакция воздуха с раскаленным коксом O2+ 4N2 + 2C → 2CO + 4N2
- 16. 3. Пропускание аммиака над оксидом меди (II) при температуре ~700 °C 2NH3 + 3CuO → N2↑
- 17. 4. Сжигание аммиака 3O2+ 4NH3 → 6H2O + 2N2
- 18. в промышленности - из жидкого воздуха (в воздухе содержится 78%) (tкип(О2)= -1830С, tкип (N2)= -1960С при
- 19. Физические свойства газ, без цвета, без запаха, мало растворим в воде, tкип= -1960С, tпл=-2100С
- 20. Химические свойства Свободный азот химически инертен из-за высокой прочности молекулы азота, в которой атомы связаны тройной
- 21. восстановитель N20 N+2
- 22. Взаимодействие с кислородом N2 + О2⇒ 2 NO Температура электрической дуги 3000 - 4000 0С (или
- 23. Взаимодействие с фтором N20 +3F20 2N+3 F3-1
- 24. Окислитель N20 2N-3
- 25. Взаимодействие с водородом N2 + 3 Н2 ⇒ 2 NН3
- 27. Скачать презентацию
 Главные подгруппы металлов I-III групп в таблице Д.И. Менделеева
Главные подгруппы металлов I-III групп в таблице Д.И. Менделеева Азотсодержащие органические соединения. Аминокислоты (часть 2)
Азотсодержащие органические соединения. Аминокислоты (часть 2) Електролітична дисоціація. Гідроліз солей
Електролітична дисоціація. Гідроліз солей Углеводы. Моносахариды
Углеводы. Моносахариды Осадительное титрование. Меркуриметрия
Осадительное титрование. Меркуриметрия Правила техники безопасности при работе в кабинете химии
Правила техники безопасности при работе в кабинете химии Химическая картина мира
Химическая картина мира Хроматография әдісінің негізі
Хроматография әдісінің негізі Буферные растворы
Буферные растворы Составление уравнений ОВР
Составление уравнений ОВР Значение периодического закона и периодической системы Д.И. Менделеева
Значение периодического закона и периодической системы Д.И. Менделеева Арены
Арены Тема 11 -Дисперсные системы
Тема 11 -Дисперсные системы Синтетические моющие средства. Механизм моющего действия
Синтетические моющие средства. Механизм моющего действия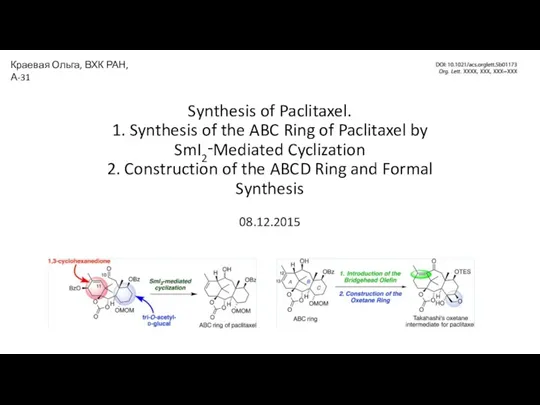 Synthesis of Paclitaxel
Synthesis of Paclitaxel Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Циклоалканы. Строение циклоалканов
Циклоалканы. Строение циклоалканов Жескость воды
Жескость воды Зависимость биохимических изменений в мясе от условий хранения
Зависимость биохимических изменений в мясе от условий хранения Многоядерные ароматические углеводороды
Многоядерные ароматические углеводороды Классы неорганических веществ
Классы неорганических веществ Химия көшбасшысы
Химия көшбасшысы Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения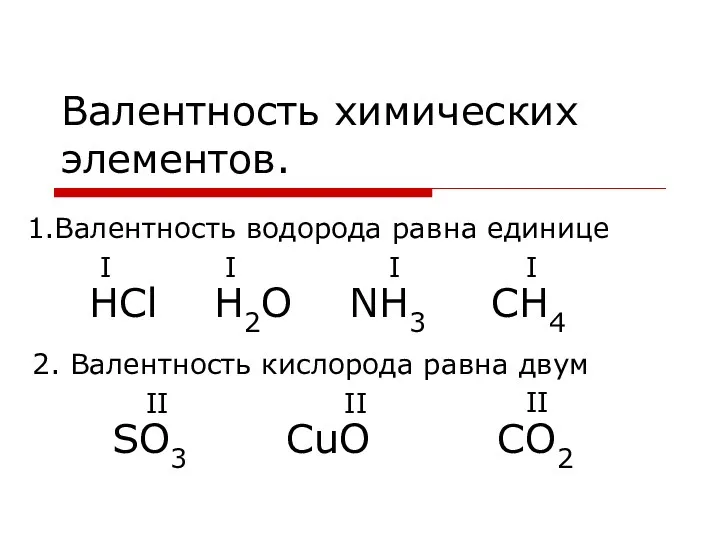 Валентность химических элементов
Валентность химических элементов Углеводы (монозы, биозы)
Углеводы (монозы, биозы) Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Химические свойства металлов
Химические свойства металлов Амінокислоти
Амінокислоти