Содержание
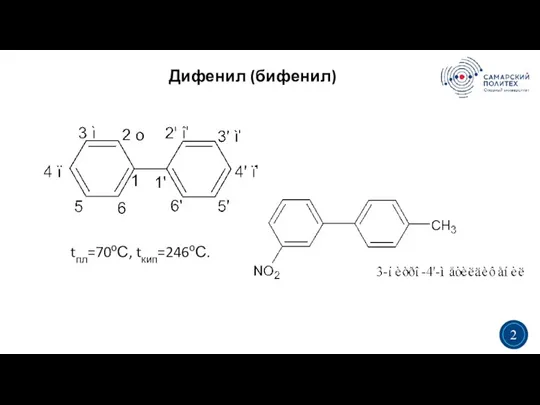
- 2. Дифенил (бифенил) 3 2 tпл=70оС, tкип=246оС.
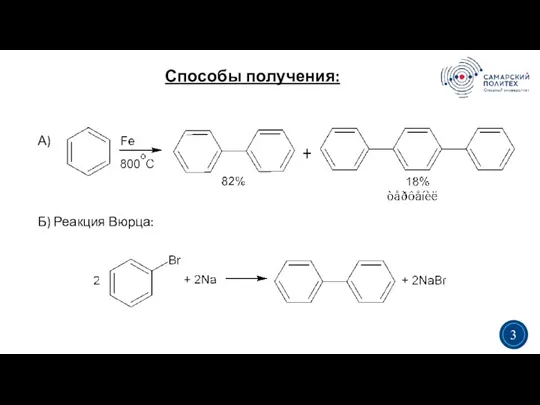
- 3. Способы получения: 3 3 А) Б) Реакция Вюрца:
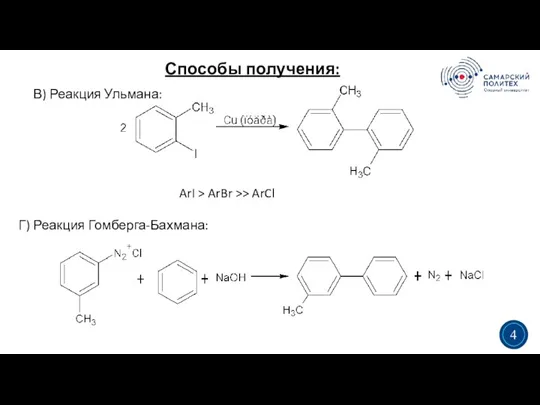
- 4. Способы получения: 3 4 В) Реакция Ульмана: ArI > ArBr >> ArCl Г) Реакция Гомберга-Бахмана:
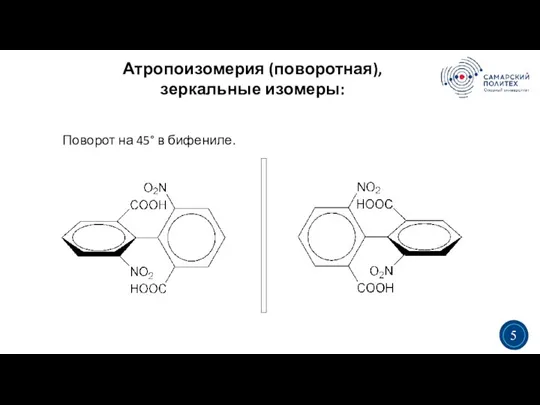
- 5. Атропоизомерия (поворотная), зеркальные изомеры: 3 5 Поворот на 45° в бифениле. 3 5
- 6. Реакции электрофильного замещения 3 5 3 6
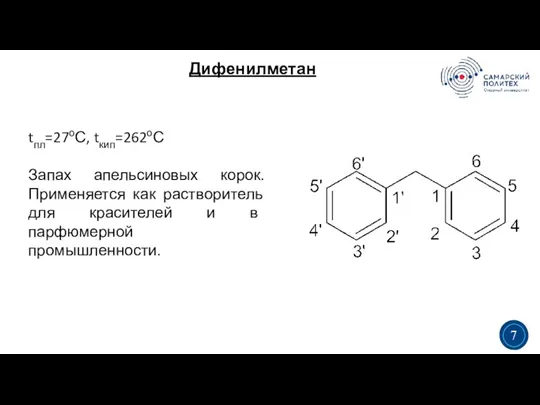
- 7. Дифенилметан 3 5 tпл=27оС, tкип=262оС Запах апельсиновых корок. Применяется как растворитель для красителей и в парфюмерной
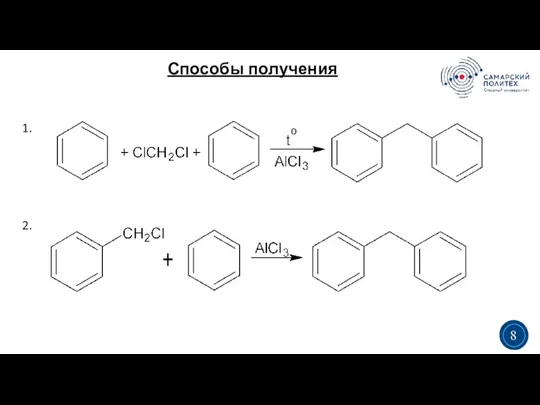
- 8. Способы получения 3 5 1. 2. 3 8
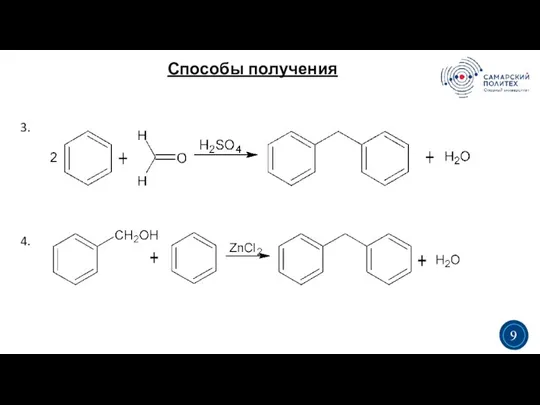
- 9. Способы получения 3 5 3. 4. 3 9
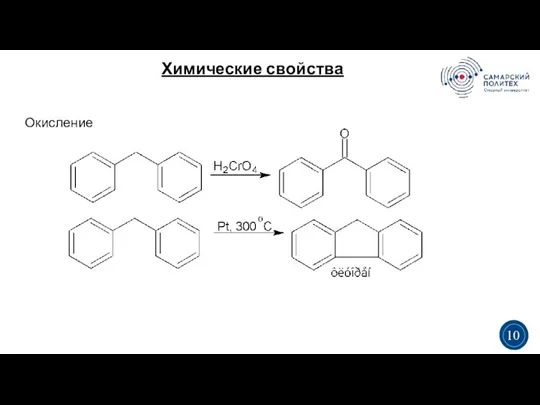
- 10. Химические свойства 3 5 Окисление 3 10
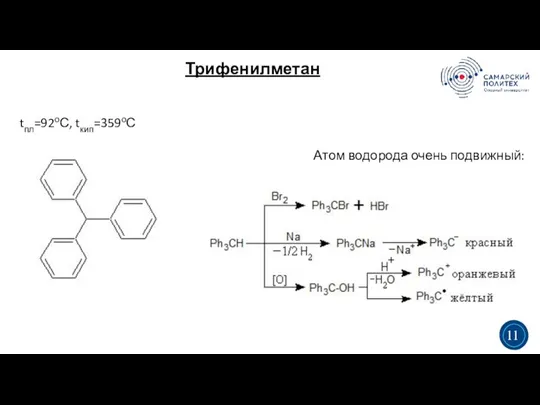
- 11. Трифенилметан 3 5 tпл=92оС, tкип=359оС Атом водорода очень подвижный: 3 11
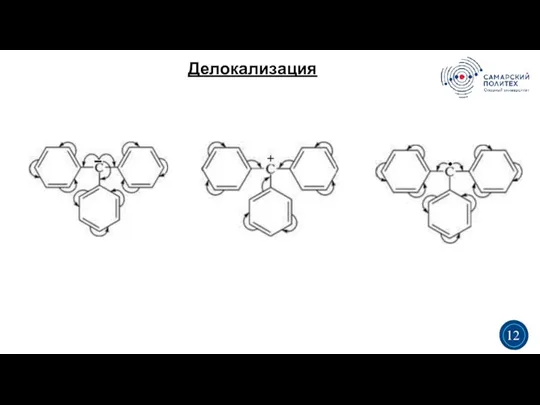
- 12. Делокализация 3 5 3 12
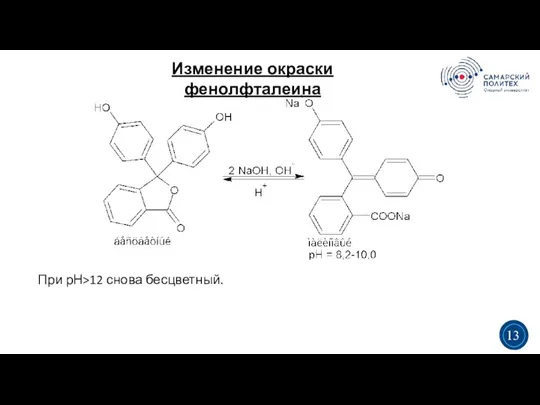
- 13. Изменение окраски фенолфталеина 3 5 При рН>12 снова бесцветный. 3 13
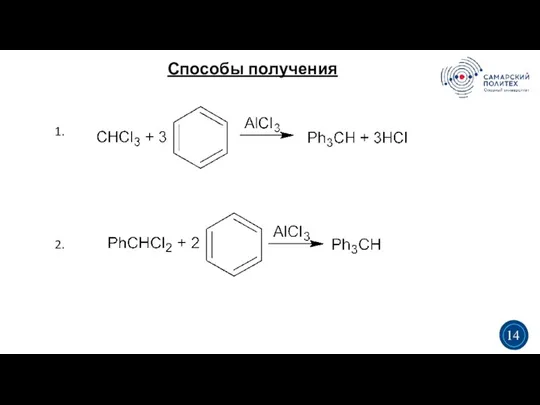
- 14. Способы получения 3 5 3 14 1. 2.
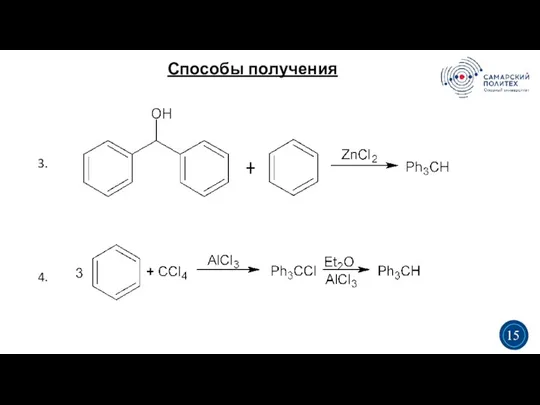
- 15. Способы получения 3 5 3 15 3. 4.
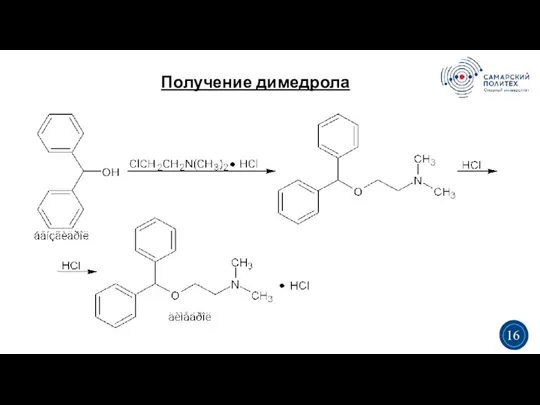
- 16. Получение димедрола 3 5 3 16
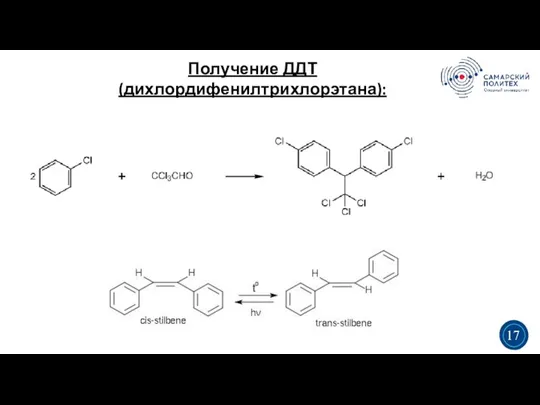
- 17. Получение ДДТ (дихлордифенилтрихлорэтана): 3 5 3 17
- 18. Ароматические углеводороды с конденсированными ядрами. Нафталин. 3 5 3 18 Нафталин (С10Н8) Белое кристаллическое вещество с
- 19. 4 Промышленным источником получения является каменноугольная смола и продукты пиролиза нефти (фр. 180-230°С). Синтетически нафталин может
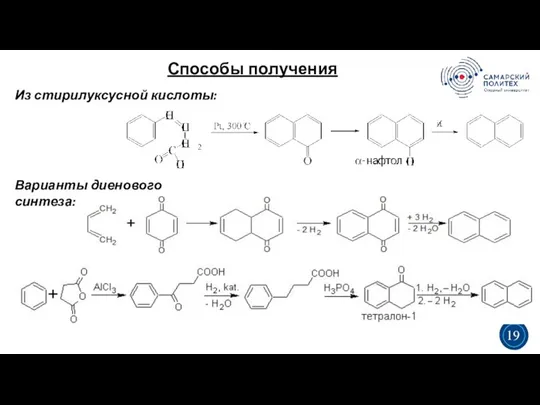
- 20. Способы получения 5 19 Из стирилуксусной кислоты: 3 3 19 Варианты диенового синтеза:
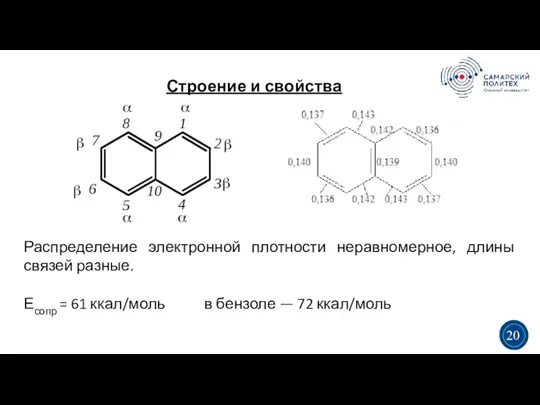
- 21. Строение и свойства 5 19 Распределение электронной плотности неравномерное, длины связей разные. Есопр = 61 ккал/моль
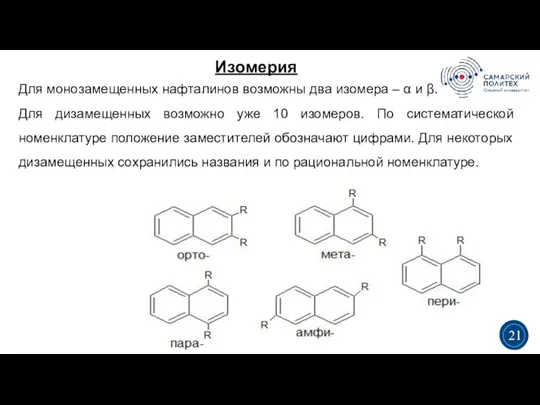
- 22. Изомерия 5 19 3 3 21 Для монозамещенных нафталинов возможны два изомера – α и β.
- 23. 7 Химические свойства Нафталин - ароматическим соединением, по своим свойствам напоминающим бензол. Устойчив к реакциям присоединения,
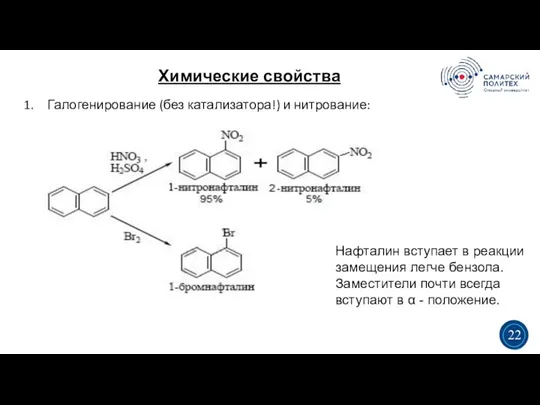
- 24. Химические свойства 5 19 Галогенирование (без катализатора!) и нитрование: 3 3 22 Нафталин вступает в реакции
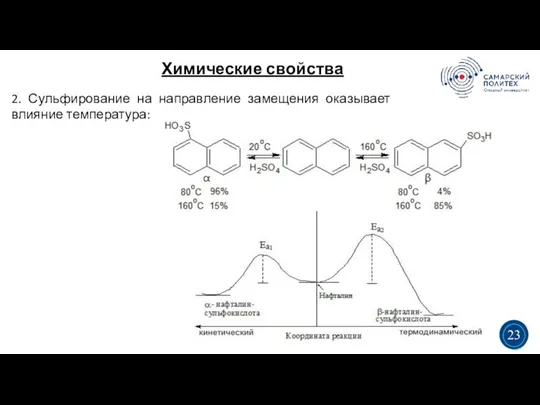
- 25. Химические свойства 5 19 2. Сульфирование на направление замещения оказывает влияние температура: 3 3 23
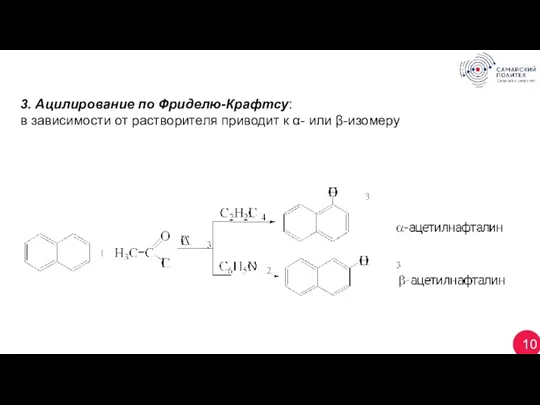
- 26. 10 3. Ацилирование по Фриделю-Крафтсу: в зависимости от растворителя приводит к α- или β-изомеру
- 27. 12 Ориентация электрофильного замещения в нафталине Как и в случае ряда бензола, заместители в нафталиновом кольце
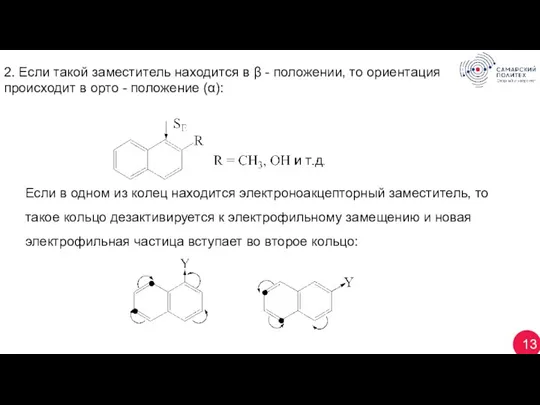
- 28. 13 2. Если такой заместитель находится в β - положении, то ориентация происходит в орто -
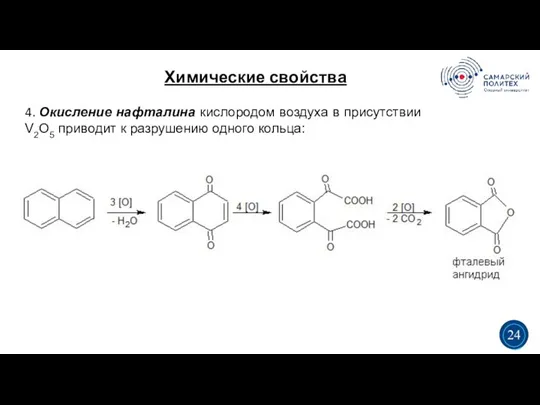
- 29. Химические свойства 5 19 4. Окисление нафталина кислородом воздуха в присутствии V2O5 приводит к разрушению одного
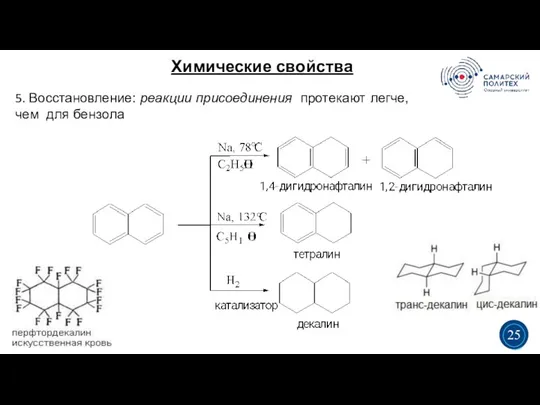
- 30. Химические свойства 5 19 5. Восстановление: реакции присоединения протекают легче, чем для бензола 3 3 25
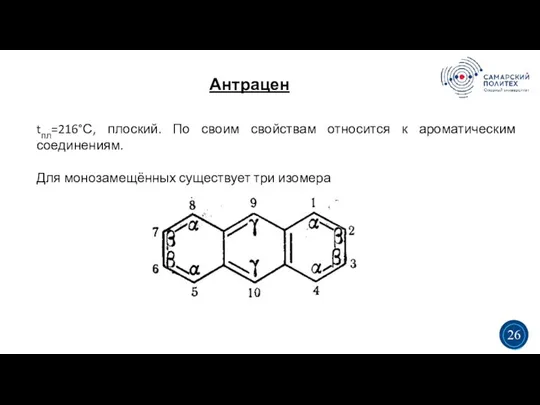
- 31. Антрацен 5 19 tпл=216°С, плоский. По своим свойствам относится к ароматическим соединениям. Для монозамещённых существует три
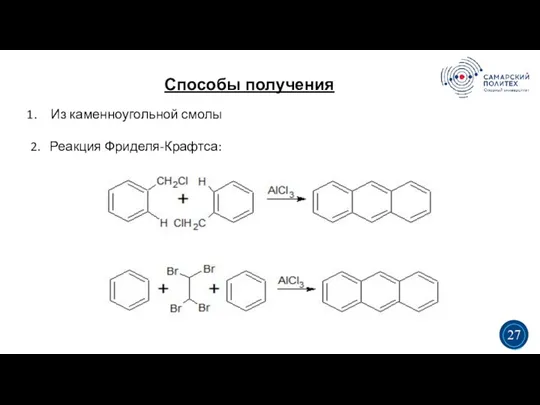
- 32. Способы получения 5 19 Из каменноугольной смолы 2. Реакция Фриделя-Крафтса: 3 3 27
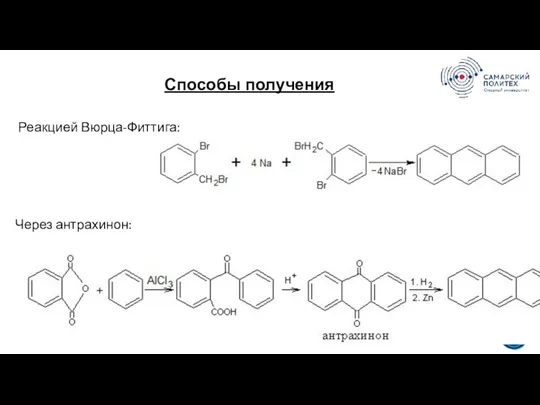
- 33. Способы получения 5 19 Реакцией Вюрца-Фиттига: Через антрахинон: 3 3 28
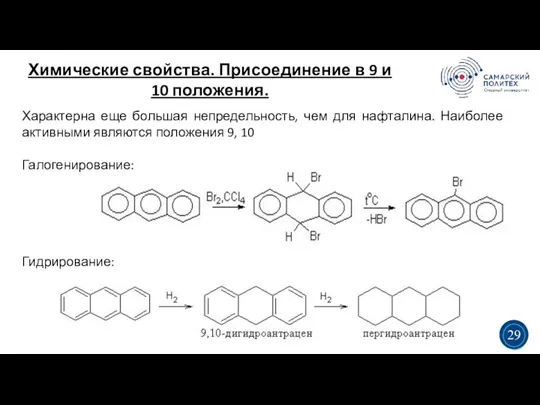
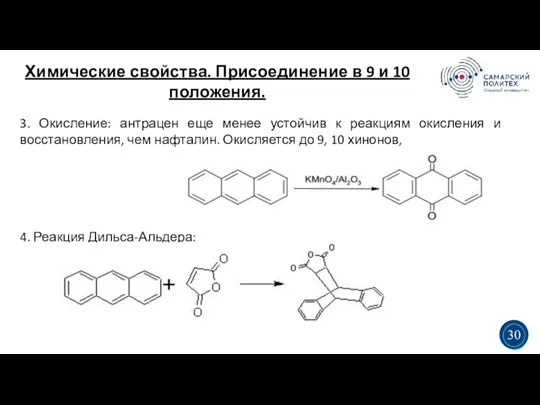
- 34. Химические свойства. Присоединение в 9 и 10 положения. 5 19 Характерна еще большая непредельность, чем для
- 35. Химические свойства. Присоединение в 9 и 10 положения. 5 19 3. Окисление: антрацен еще менее устойчив
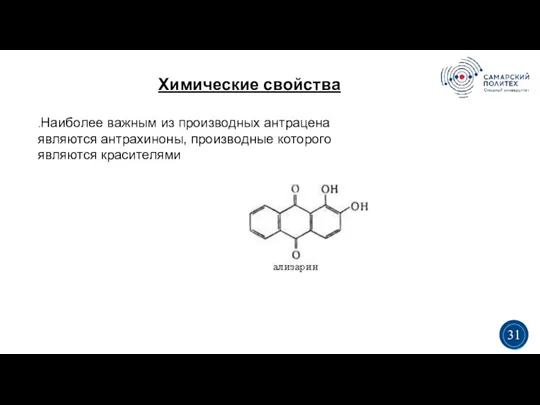
- 36. Химические свойства 5 19 3 3 31 .Наиболее важным из производных антрацена являются антрахиноны, производные которого
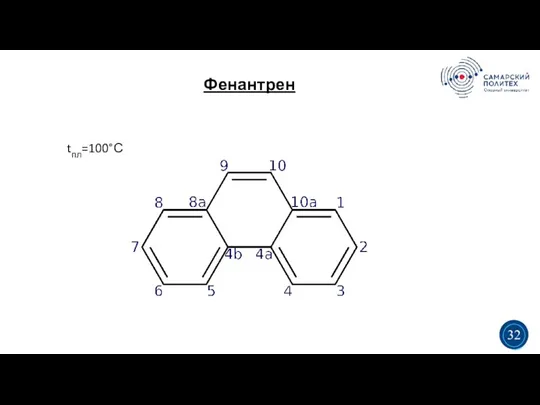
- 37. Фенантрен 5 19 tпл=100°С 3 3 32
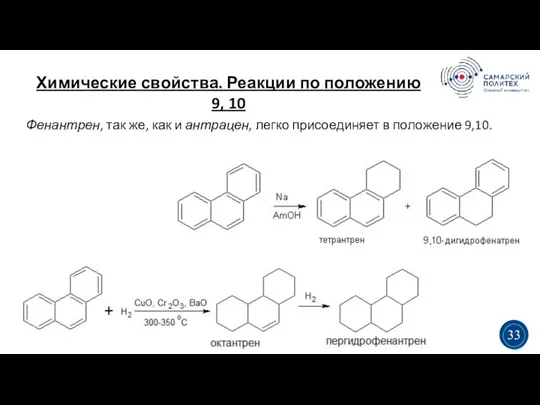
- 38. Химические свойства. Реакции по положению 9, 10 5 19 Фенантрен, так же, как и антрацен, легко
- 39. Химические свойства. Реакции по положению 9, 10. 5 19 Эти же положения (9 и 10) более
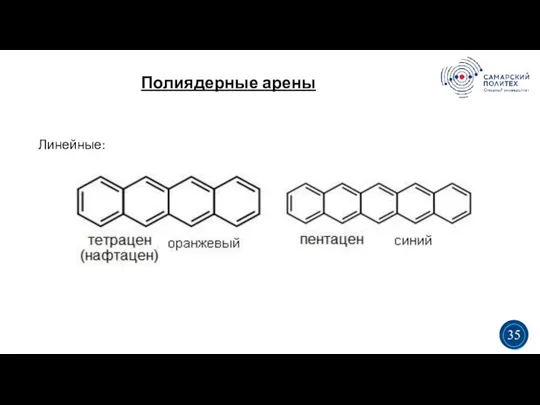
- 40. Полиядерные арены 5 19 Линейные: 3 3 35
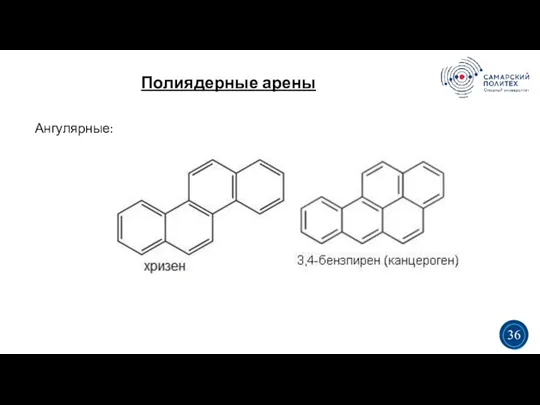
- 41. Полиядерные арены 5 19 Ангулярные: 3 3 36
- 43. Скачать презентацию






 Характеристика азота и фосфора. Свойства азота
Характеристика азота и фосфора. Свойства азота Тяжелые металлы
Тяжелые металлы Нітроген
Нітроген Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Взрывчатые вещества, их история и применение
Взрывчатые вещества, их история и применение Присадки. Механизм действия присадок
Присадки. Механизм действия присадок Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Хімічні властивості кислот
Хімічні властивості кислот Элементы кристаллохимии
Элементы кристаллохимии Химия 20 века
Химия 20 века Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Лекция по химии
Лекция по химии Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара
Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара Сполуки фосфору
Сполуки фосфору Гомополисахариды (углеводы растений)
Гомополисахариды (углеводы растений) Цинк
Цинк Химическая кинетика
Химическая кинетика Атомы и молекулы. Простые и сложные вещества. 6 класс
Атомы и молекулы. Простые и сложные вещества. 6 класс Алюміній і сполуки алюмінію у побуті людини
Алюміній і сполуки алюмінію у побуті людини Алкадиены
Алкадиены Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Химия в искусстве
Химия в искусстве Серная кислота H2SO4. 9 классы
Серная кислота H2SO4. 9 классы Товары бытовой химии
Товары бытовой химии Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома
Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома Металдар коррозиясы және онымен күресу шаралары
Металдар коррозиясы және онымен күресу шаралары Полистирол өндірісі
Полистирол өндірісі Искусственная радиоактивность. Ядерное оружие и его поражающие факторы
Искусственная радиоактивность. Ядерное оружие и его поражающие факторы