Содержание
- 2. Реакцию, уравнение которой N2(г) + 3Н2(г) ⮀ 2NН3(г) + Q относят к реакциям: 1) обратимым, экзотермическим
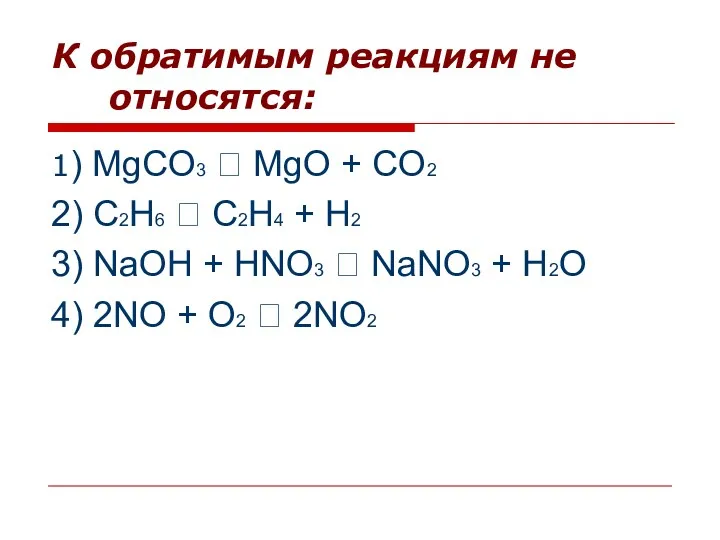
- 3. К обратимым реакциям не относятся: 1) MgCO3 ⭢ MgO + CO2 2) C2H6 ⭢ C2H4 +
- 4. К реакциям замещения относится взаимодействие: 1) метана и кислорода 2) брома и водорода 3) бутана и
- 5. Простое вещество может быть получено в реакциях 1) соединения и замещения 2) замещения и разложения 3)
- 6. Окислительно-восстановительная реакция соединения протекает между: 1) хлороводородом и аммиаком 2) аммиаком и кислородом 3) кислородом и
- 7. Скорость химической реакции горения угля в кислороде уменьшится при: 1) увеличении концентрации кислорода 2) повышении температуры
- 8. С наибольшей скоростью при комнатной температуре протекает реакция: 1) Zn и HCl(1%ный р-р) 2) Zn и
- 9. Скорость прямой реакции в системе: 2SO2 + O2 ⮀ 2SO3 + Q при увеличении давления в
- 10. Скорость реакции при повышении температуры на 40°С и температурном коэффициенте реакции, равном 2, увеличится в: 1)
- 11. Химическое равновесие сместится вправо при увеличении давления в системе: 1) H2 + Cl2 ⮀ 2HCl 2)
- 12. Химическое равновесие в системе С3Н8 ⮀ С3Н6 + Н2 – Q можно сместить в сторону продуктов
- 13. В соответствии с термохимическим уравнением 3Fe3O4+8Al=9Fe+4Al2O3+ 3330кДж при образовании 2 моль оксида алюминия: 1) выделяется 1655
- 14. Укажите все возможные способы смещения химического равновесия в сторону прямой реакции: NH3(г) + H2S(г) ⮀ NH4HS(тв)
- 15. Химическое равновесие в системе N2(г) + 3Н2(г) ⮀ 2NН3(г) установилось при равновесных концентрациях: [NН3] = 0,4моль/л,
- 17. Скачать презентацию













 Фотохимический смог и химизм его образования
Фотохимический смог и химизм его образования Металлы побочных подгрупп
Металлы побочных подгрупп Исследование снежного покрова
Исследование снежного покрова Современные тенденции развития химии
Современные тенденции развития химии Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Межмолекулярные силы (силы Ван дер Ваальса)
Межмолекулярные силы (силы Ван дер Ваальса) Крохмаль. Структурна формула крохмалю
Крохмаль. Структурна формула крохмалю Белоктар. Биохимиясы
Белоктар. Биохимиясы Возраст в геологии
Возраст в геологии Металлы
Металлы Фенолы
Фенолы Азотная кислота и нитраты
Азотная кислота и нитраты Обмоточные провода
Обмоточные провода Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31
Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31 III А – топтың элементтері
III А – топтың элементтері Основной государственный экзамен Химия 2021. Задание 5
Основной государственный экзамен Химия 2021. Задание 5 Некоторые d-элементы
Некоторые d-элементы Массовая доля химического элемента
Массовая доля химического элемента Скорость химических реакций. Молекулярные гонки
Скорость химических реакций. Молекулярные гонки Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук Переработка тяжелых нефтей, битумов и нефтяных остатков
Переработка тяжелых нефтей, битумов и нефтяных остатков Алюминий. Химические свойства
Алюминий. Химические свойства Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Щелочные породы среднего состава
Щелочные породы среднего состава Кристаллические решетки
Кристаллические решетки