Содержание
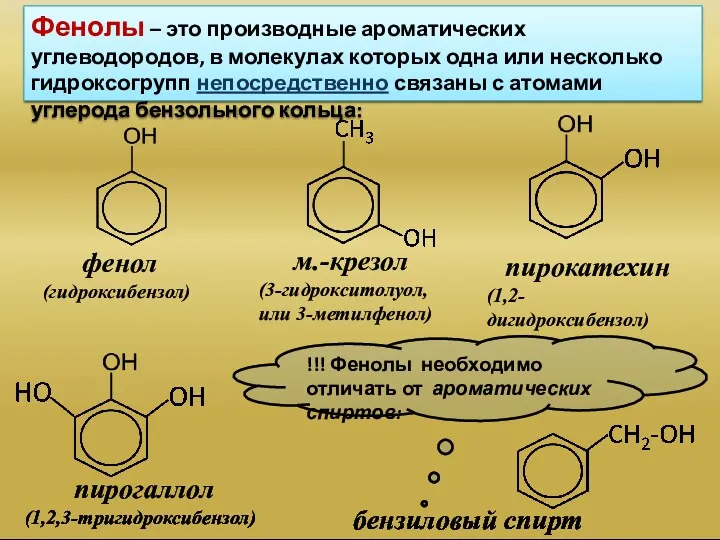
- 2. Фенолы – это производные ароматических углеводородов, в молекулах которых одна или несколько гидроксогрупп непосредственно связаны с
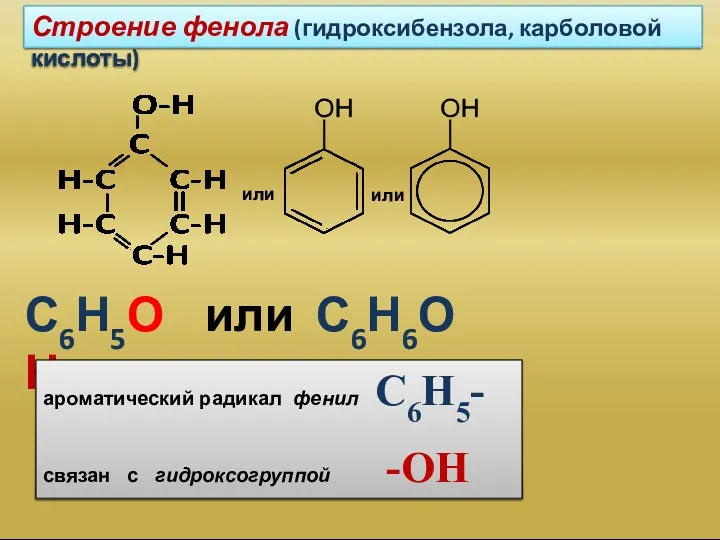
- 3. или или Строение фенола (гидроксибензола, карболовой кислоты) С6Н5ОН или С6Н6О ароматический радикал фенил С6Н5- связан с
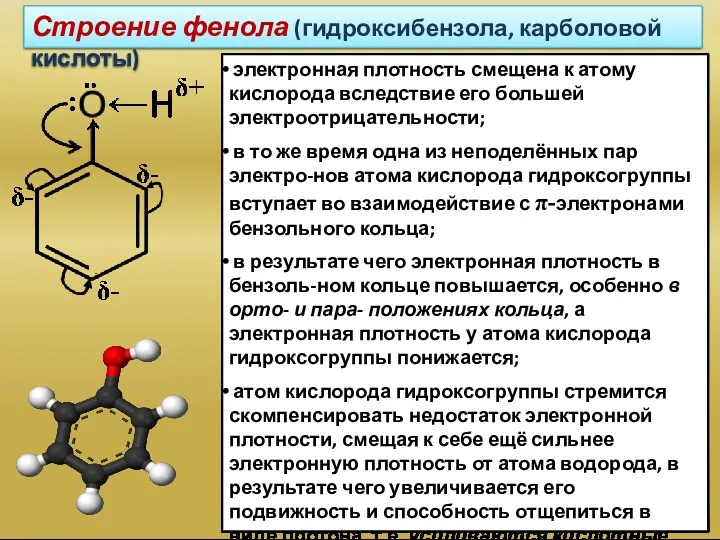
- 4. Строение фенола (гидроксибензола, карболовой кислоты) электронная плотность смещена к атому кислорода вследствие его большей электроотрицательности; в
- 5. Физические свойства фенола Фенол - твёрдое бесцветное кристаллическое вещество, низкоплавкое, очень гигроскопичное, с характерным запахом. На
- 6. В конце XIX в. шотландский врач Д. Листер впервые провёл операцию, использовав в качестве антисептика карболовую
- 7. Применение фенола для производства пластмасс, красителей, лекарств, взрывчатых веществ
- 8. Способы получения 1) Из каменноугольной смолы: коксовая смола, каменноугольный дёготь - один из продуктов коксования каменных
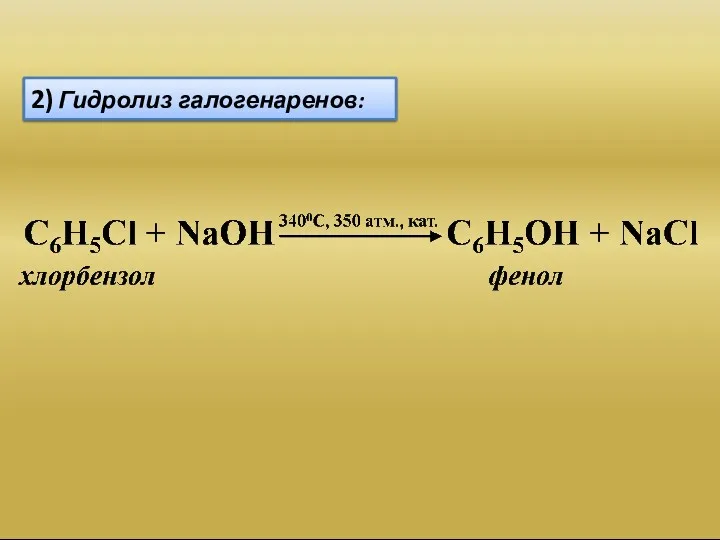
- 9. 2) Гидролиз галогенаренов:
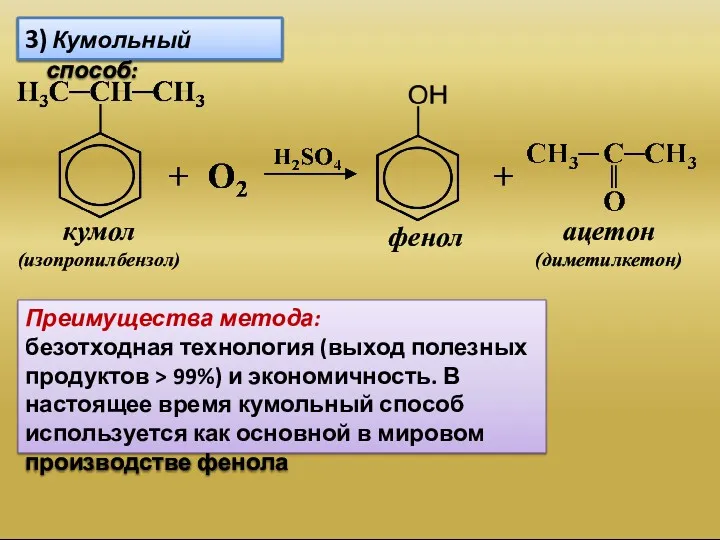
- 10. 3) Кумольный способ: кумол (изопропилбензол) фенол ацетон (диметилкетон) Преимущества метода: безотходная технология (выход полезных продуктов >
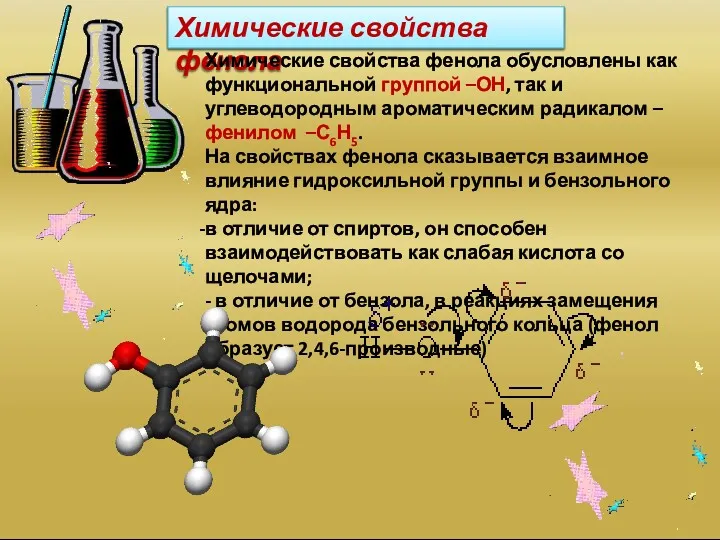
- 11. Химические свойства фенола Химические свойства фенола обусловлены как функциональной группой –ОН, так и углеводородным ароматическим радикалом
- 12. I. Реакции по гидроксигруппе 1) Взаимодействие со щелочными металлами: 2С6Н5ОН + 2Na → 2С6Н5ОNa + Н2↑
- 13. 2) Взаимодействие с водными растворами щелочей: С6Н5ОН + NaOH → С6Н5ОNa + Н2O фенол фенолят натрия
- 14. 3) Реакция с хлоридом железа(III)- - качественная реакция (!) Качественной реакцией на фенол является реакция с
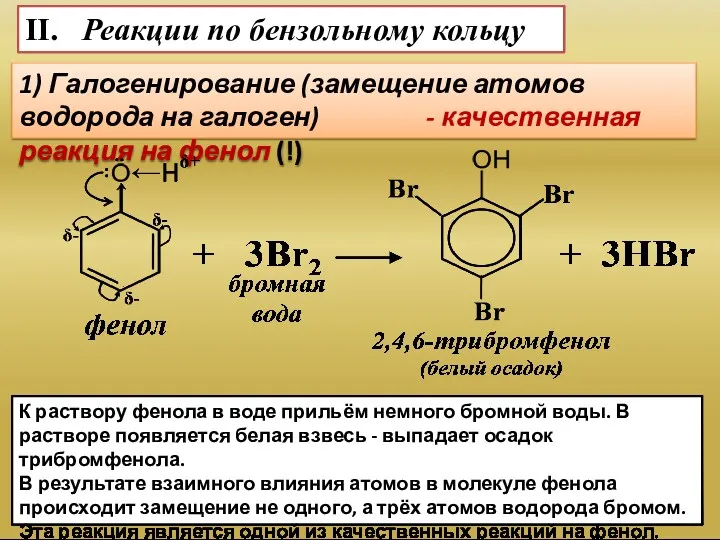
- 15. II. Реакции по бензольному кольцу 1) Галогенирование (замещение атомов водорода на галоген) - качественная реакция на
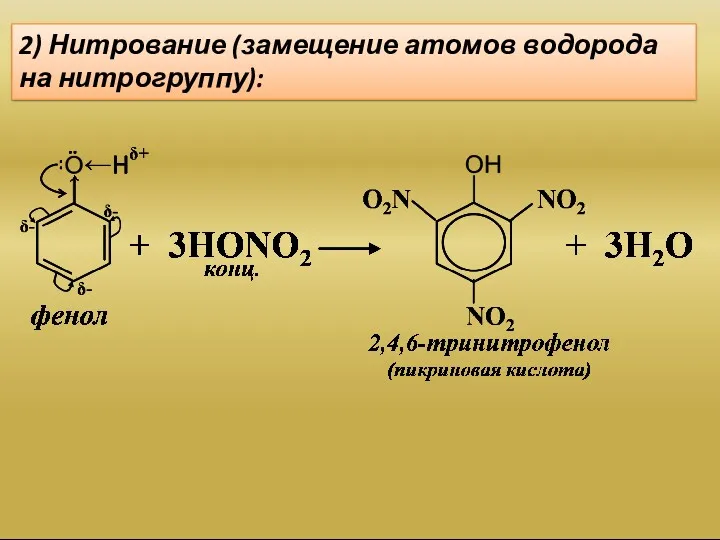
- 16. 2) Нитрование (замещение атомов водорода на нитрогруппу):
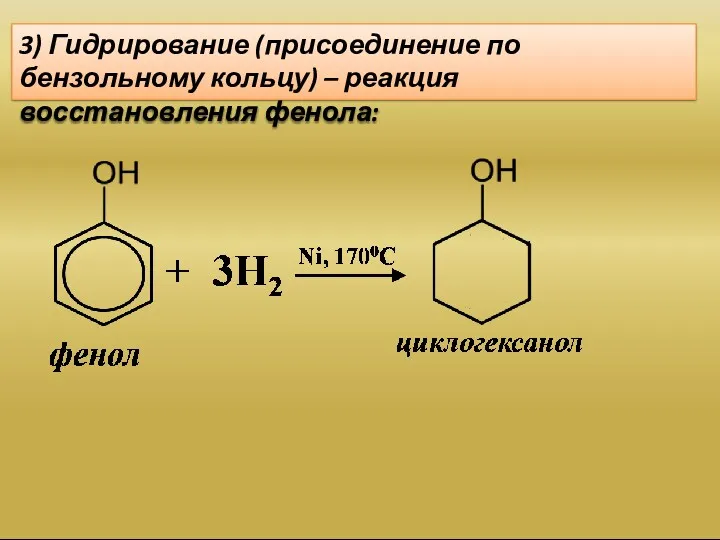
- 17. 3) Гидрирование (присоединение по бензольному кольцу) – реакция восстановления фенола:
- 18. С6Н5ОН + 7О2 → 6СО2 + 3Н2О III. Реакции окисления: фенолы легко окисляются даже под действием
- 20. Скачать презентацию







 Алкины. Химические свойства и способы получения алкинов
Алкины. Химические свойства и способы получения алкинов Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов
Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2
Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2 Правила техники безопасности при работе в кабинете химии
Правила техники безопасности при работе в кабинете химии Титан. Хром
Титан. Хром Основные разделы химии
Основные разделы химии Субстраты и продукты биохимических реакций
Субстраты и продукты биохимических реакций Хромотография, явления, атомы и молекулы. 8 класс
Хромотография, явления, атомы и молекулы. 8 класс Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Ионная хроматография
Ионная хроматография Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс Щелочные металлы. 9 класс
Щелочные металлы. 9 класс История органической химии. Характерные особенности органических соединений
История органической химии. Характерные особенности органических соединений Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства
Асфальтены в тяжелых нефтях и битумах. Химическое строение и влияние на свойства Электрохимические процессы
Электрохимические процессы Alkynes
Alkynes Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Вуглеводні. Підсумковий урок 9 клас
Вуглеводні. Підсумковий урок 9 клас Теория возникновения электродных и ОВ-потенциалов
Теория возникновения электродных и ОВ-потенциалов Аммиак
Аммиак Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс
Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс Химические свойства кислот
Химические свойства кислот Взаємодія кисеню зі складними речовинами
Взаємодія кисеню зі складними речовинами Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Наноструктурные и нанокристаллические материалы
Наноструктурные и нанокристаллические материалы Железо. Строение атома, физические и химические свойства простого вещества
Железо. Строение атома, физические и химические свойства простого вещества Влияние этилового спирта на организм детей
Влияние этилового спирта на организм детей