Содержание
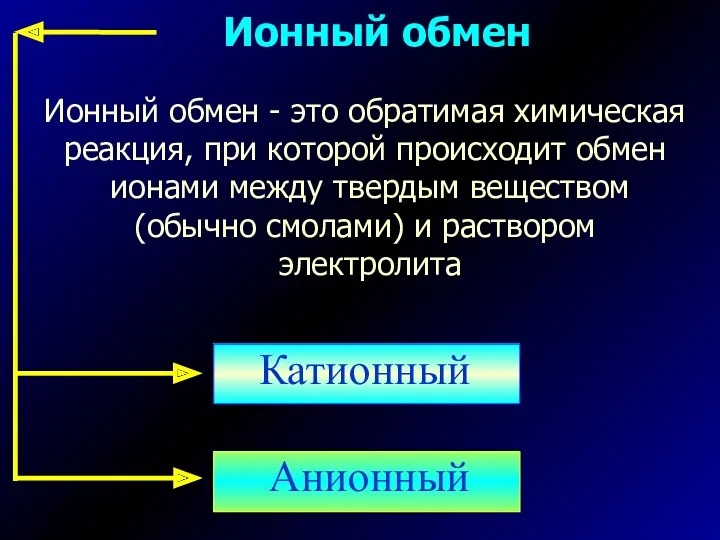
- 2. Ионный обмен Ионный обмен - это обратимая химическая реакция, при которой происходит обмен ионами между твердым
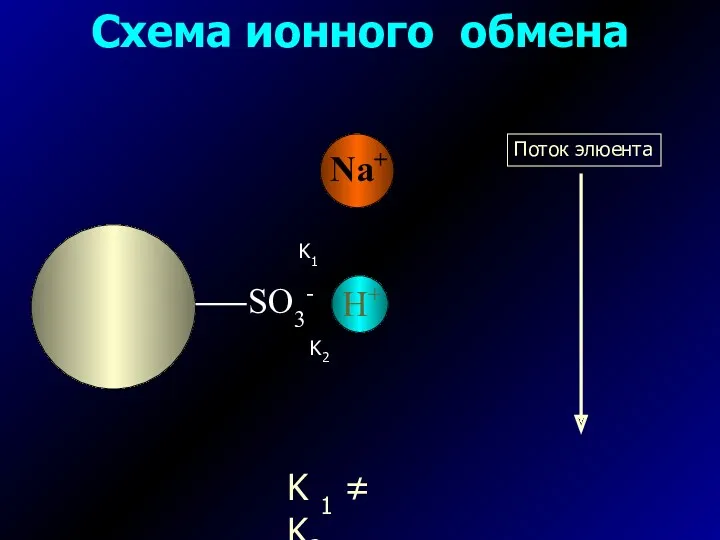
- 3. Схема ионного обмена K1 K2 K 1 ≠ K2
- 4. Ионообменная хроматография Жидкостная хроматография, основанная на различной способности ионов к ионному обмену Больше физико-химический, чем аналитический
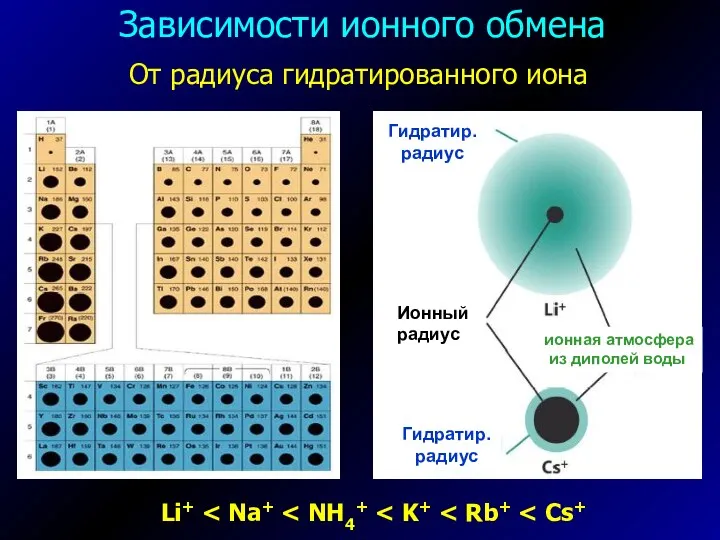
- 5. Зависимости ионного обмена Li+ От радиуса гидратированного иона
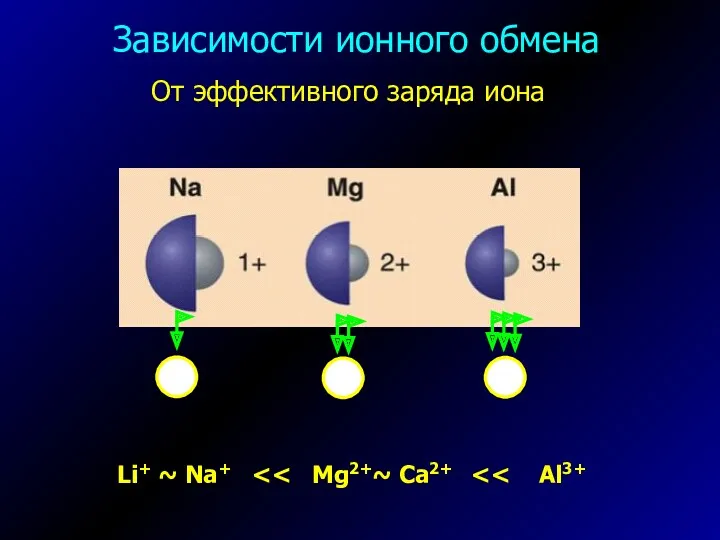
- 6. От эффективного заряда иона Li+ ~ Na+ Зависимости ионного обмена
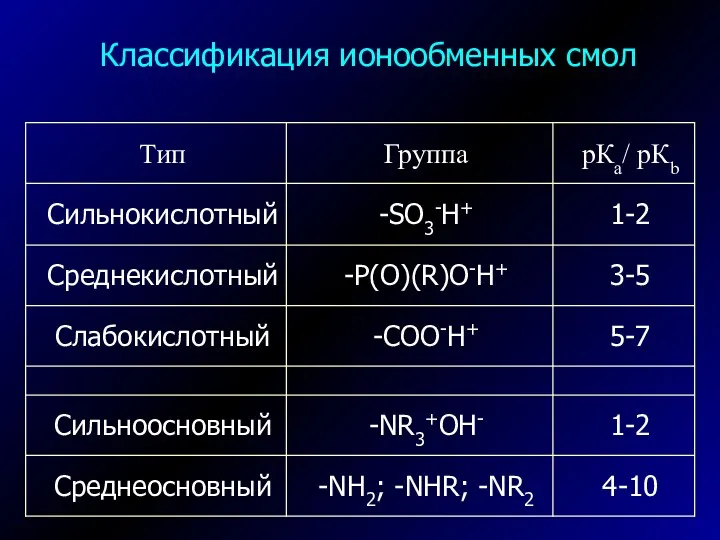
- 7. Классификация ионообменных смол
- 8. Ионная хроматография Весьма эффективный метод определения ионов Лучший метод определения анионов, особенно неорганических Наиболее распространенные детекторы
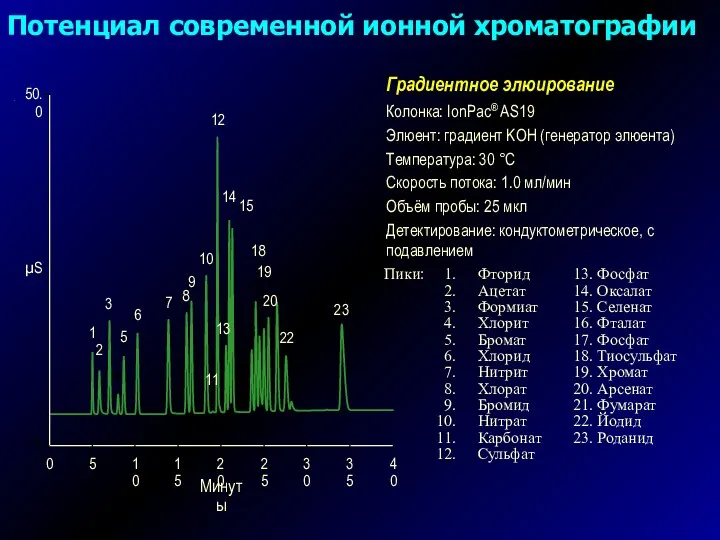
- 9. Колонка: IonPac® AS19 Элюент: градиент KOH (генератор элюента) Температура: 30 °C Скорость потока: 1.0 мл/мин Объём
- 10. Строение сорбентов Ионообменная хр-фия Объемно- модифицированные Емкость до 10 мМ/г Диаметр 200-2000 мкм Поверхностно- модифицированные Емкость
- 11. Микрофотография латексного анионообменника
- 12. Матрица сорбентов
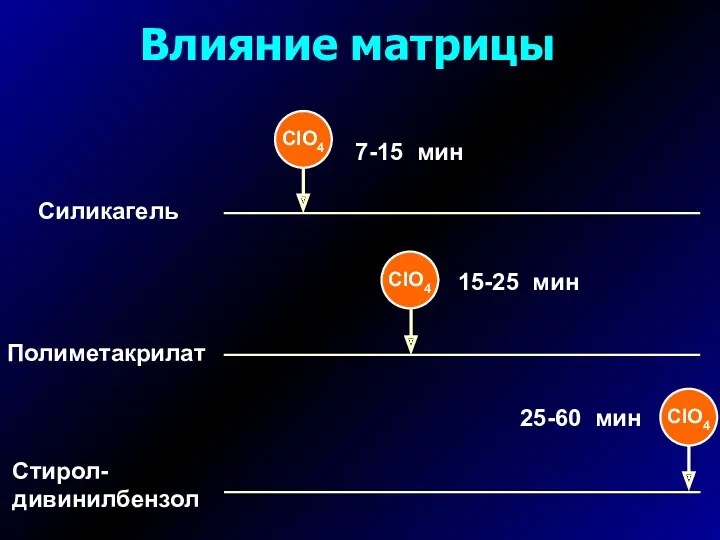
- 13. Влияние матрицы
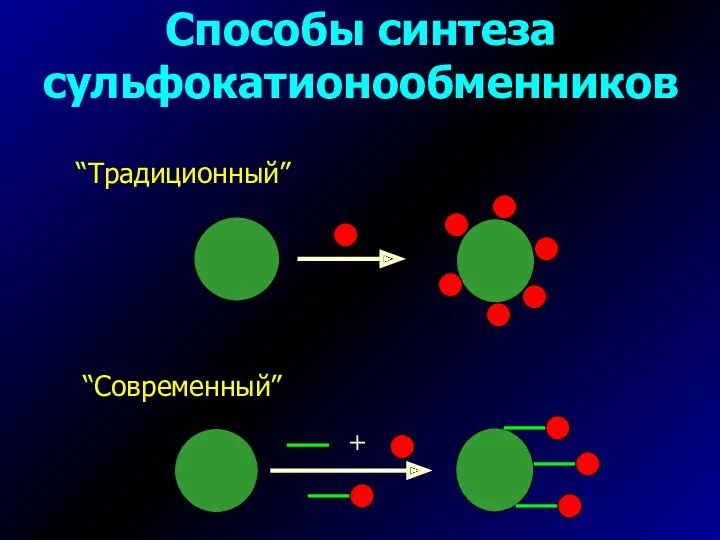
- 14. Способы синтеза сульфокатионообменников
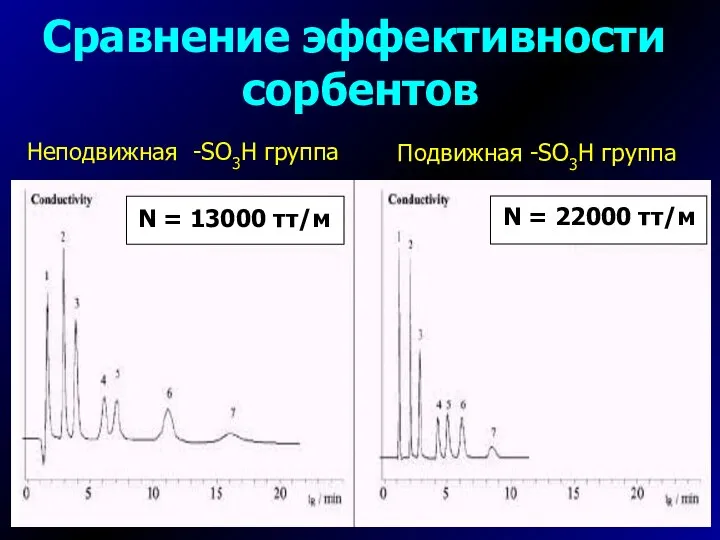
- 15. Сравнение эффективности сорбентов Подвижная -SO3H группа Неподвижная -SO3H группа
- 16. Особенности подвижных фаз в ионной хроматографии Практически всегда только водные растворы электролитов (солей или кислот) Элюирующая
- 17. Схема ионного хроматографа
- 18. Одноколоночный вариант (без подавления фонового сигнала) Двухколоночный вариант (с подавлением фонового сигнала) Варианты ионной хроматографии
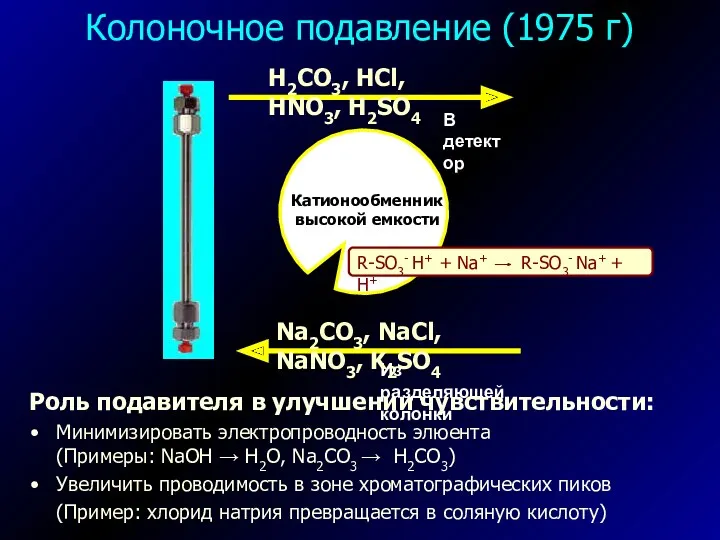
- 19. Колоночное подавление (1975 г) Роль подавителя в улучшении чувствительности: Минимизировать электропроводность элюента (Примеры: NaOH → H2O,
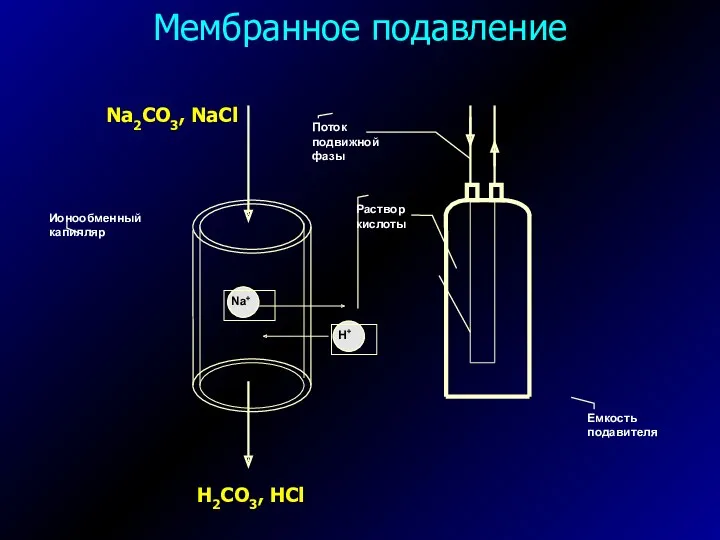
- 20. Мембранное подавление
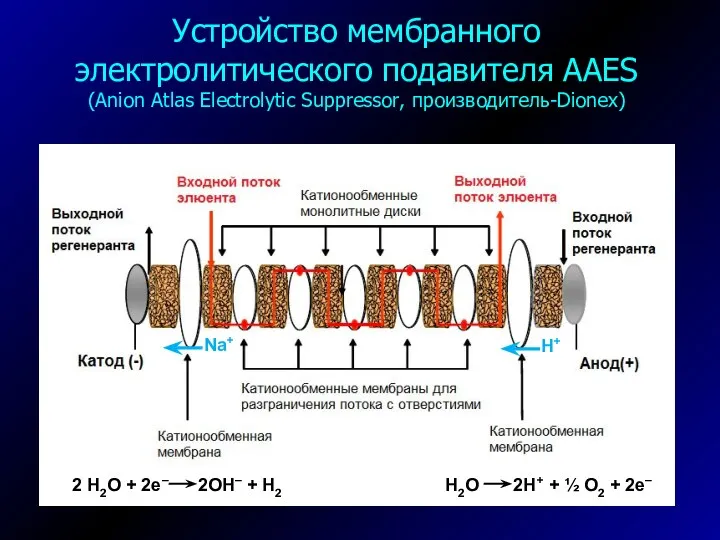
- 21. Устройство мембранного электролитического подавителя AAES (Anion Atlas Electrolytic Suppressor, производитель-Dionex) H2O 2H+ + ½ O2 +
- 22. Мертвый объем систем подавления Колоночная: 2 мл Мембранная: 0.2 мл Микромембранная: 0.05 мл Рост эффективности
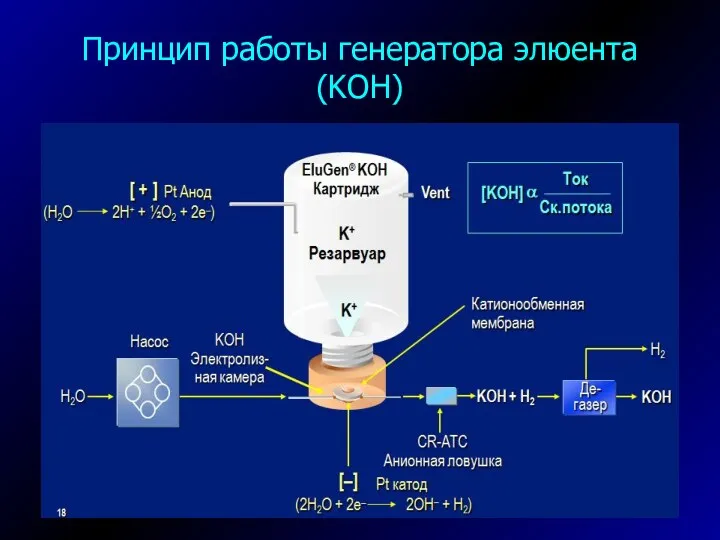
- 23. Принцип работы генератора элюента (KOH)
- 24. Улучшение характеристик определения следовых количеств анионов в режиме безреагентной ИХ Колонка: IonPac® AG11, AS11, 2 mm
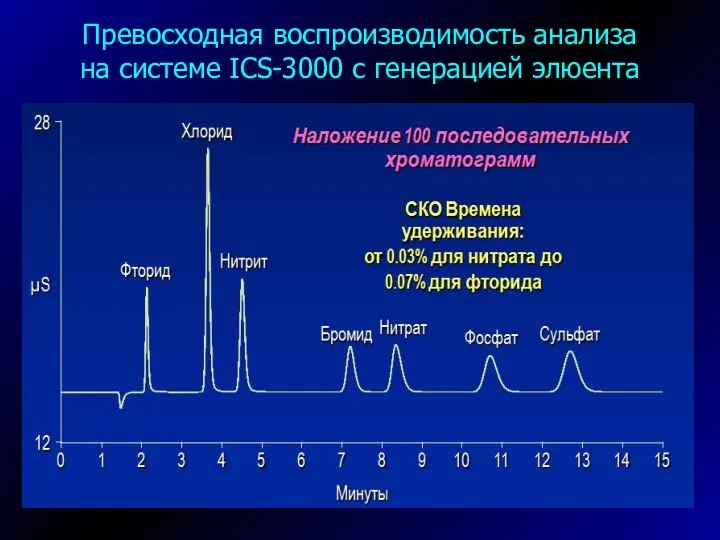
- 25. Превосходная воспроизводимость анализа на системе ICS-3000 с генерацией элюента
- 26. Наиболее часто используемые элюенты при определении анионов с подавлением
- 27. Сравнение двухколоночной (ДК) и одноколоночной (ОК) ионной хроматографии Пределы обнаружения в ДК ниже на 1-2 порядка
- 28. Детектирование в ионной хроматографии
- 29. Детектирование в ионной хроматографии Кондуктометрическое Спектрофотометрическое Электрохимическое Рефрактометрическое (в ионоэксклюзионной хр-фии) Другие
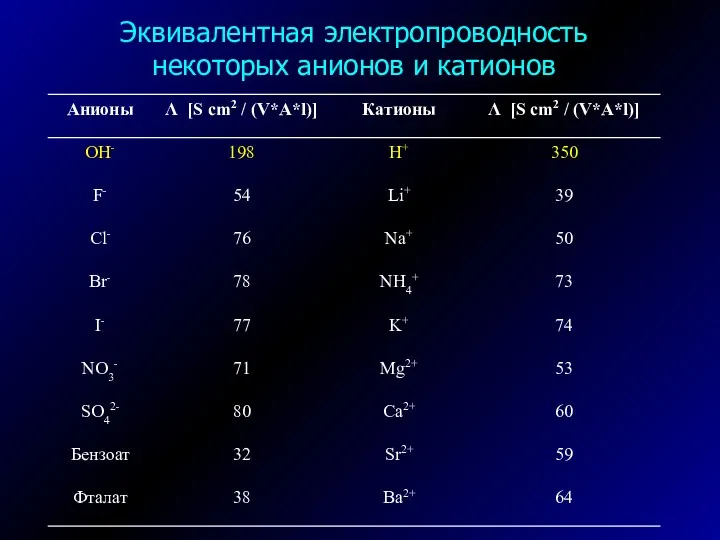
- 30. Эквивалентная электропроводность некоторых анионов и катионов
- 31. Оптимальные длины волн при СФ-детектировании некоторых анионов
- 32. Нитрофенолы, аминофенолы Гидразин, метилгидразин, диметилгидразин, Цианид, роданид Основные типы сахаров Бромид, гидросульфид, арсенит, иодид, тиосульфат, сульфит,
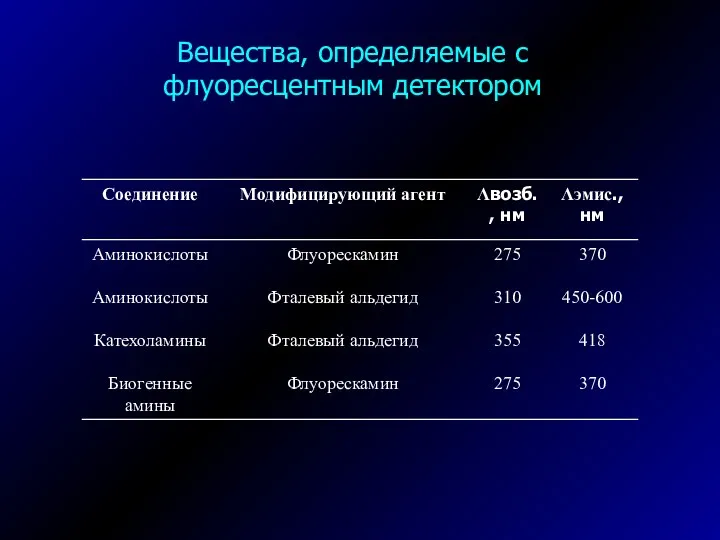
- 33. Вещества, определяемые с флуоресцентным детектором
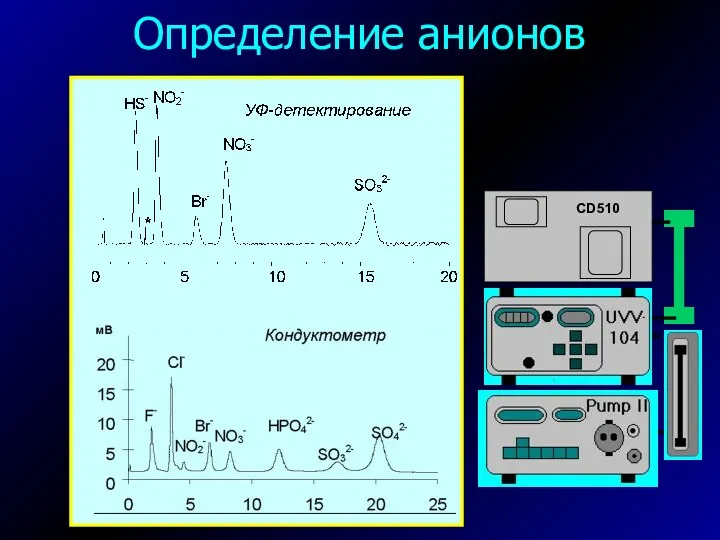
- 34. Определение анионов
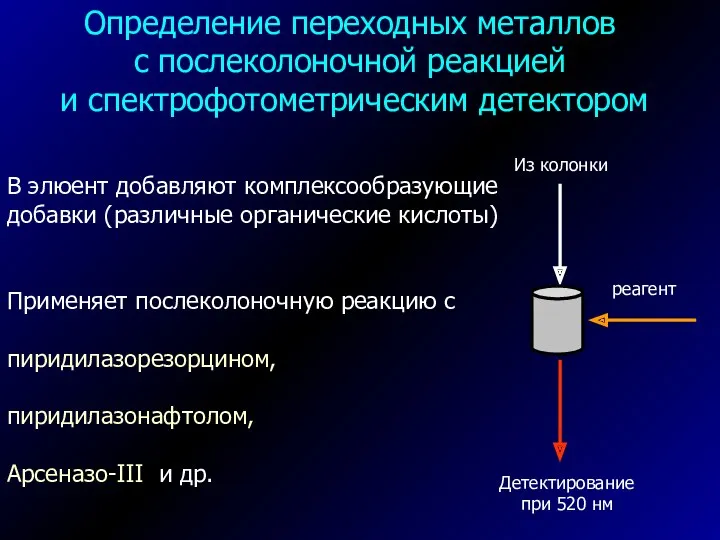
- 35. Определение переходных металлов с послеколоночной реакцией и спектрофотометрическим детектором В элюент добавляют комплексообразующие добавки (различные органические
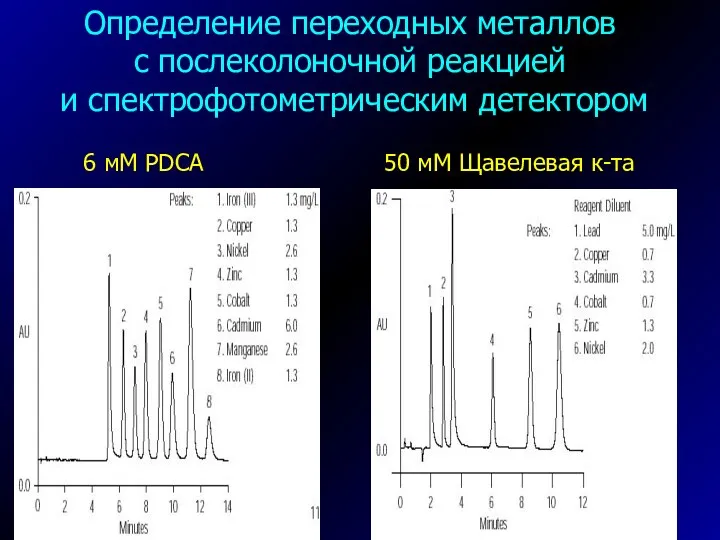
- 36. Определение переходных металлов с послеколоночной реакцией и спектрофотометрическим детектором 6 мМ PDCA 50 мМ Щавелевая к-та
- 37. Ион-эксклюзионная хроматография
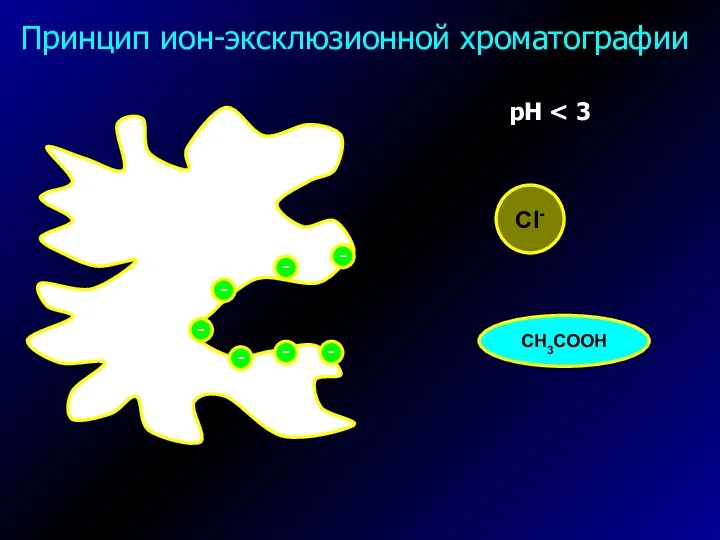
- 38. Принцип ион-эксклюзионной хроматографии рН Cl- CH3COOH
- 39. Характеристики сорбента Сорбент: сульфированный СДВБ Степень сшивки: 4 и 8% Формы: Ca2+, Na+, K+, Ag2+, Pb2+,
- 40. Закономерности удерживания органических кислот 1. Увеличение рКа ведет к возрастанию удерживания 2. Для кислот равной силы
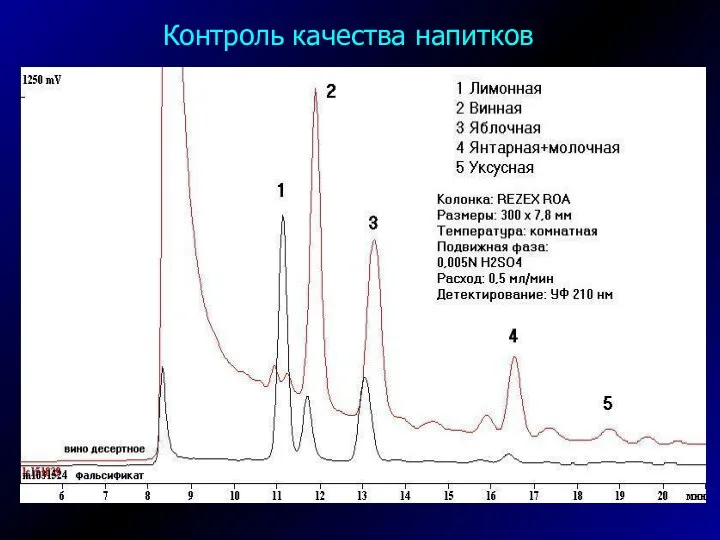
- 41. Контроль качества напитков
- 42. Ион-парная хроматография
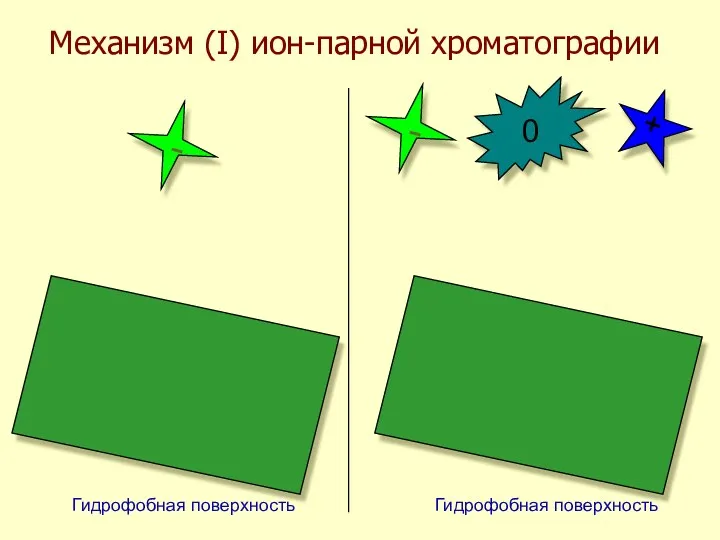
- 43. Механизм (I) ион-парной хроматографии - - + 0
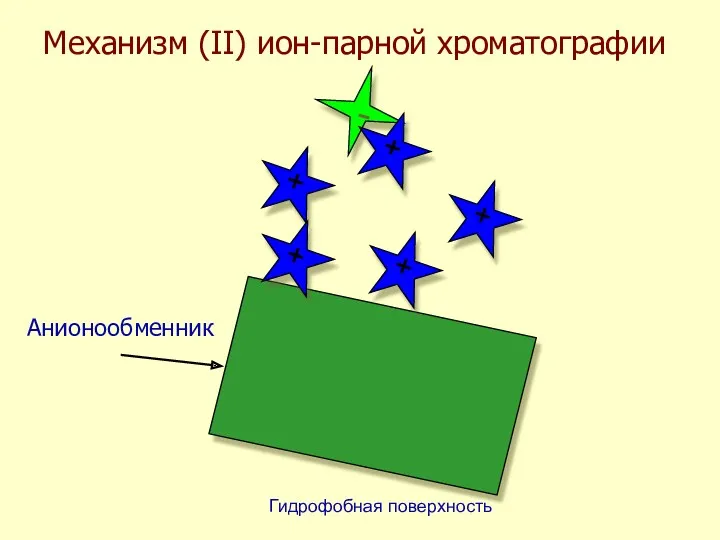
- 44. Механизм (II) ион-парной хроматографии - + + + + +
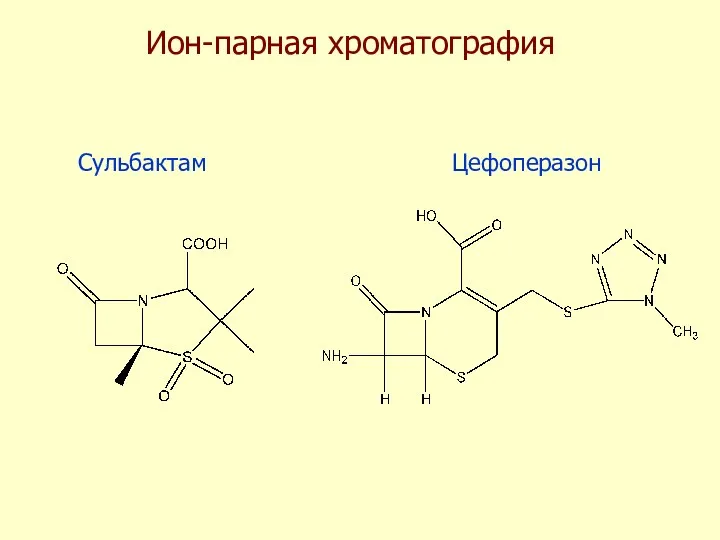
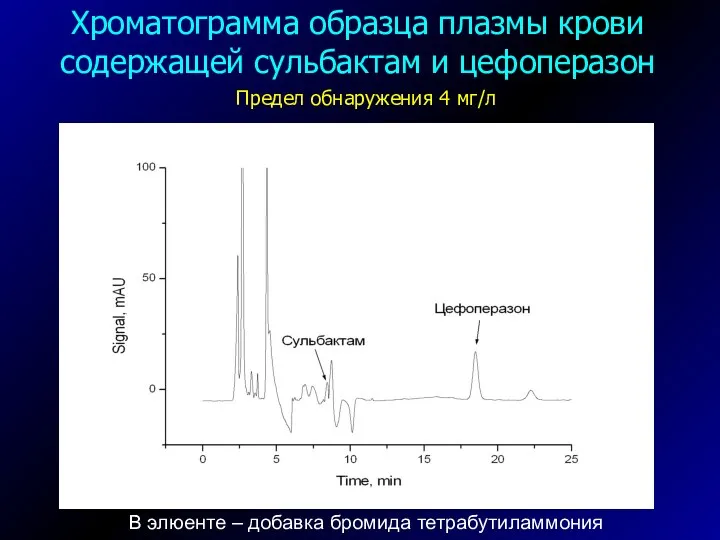
- 45. Ион-парная хроматография Сульбактам Цефоперазон
- 46. В элюенте – добавка бромида тетрабутиламмония Хроматограмма образца плазмы крови содержащей сульбактам и цефоперазон Предел обнаружения
- 47. Микроэмульсии – термодинамически стабильные, оптически прозрачные коллоидные системы, состоящие из двух жидкостей с ограничнной взаимной растворимостью,
- 48. Микроэмульсии и Макроэмульсии Микроэмульсия Макроэмульсия (молоко)
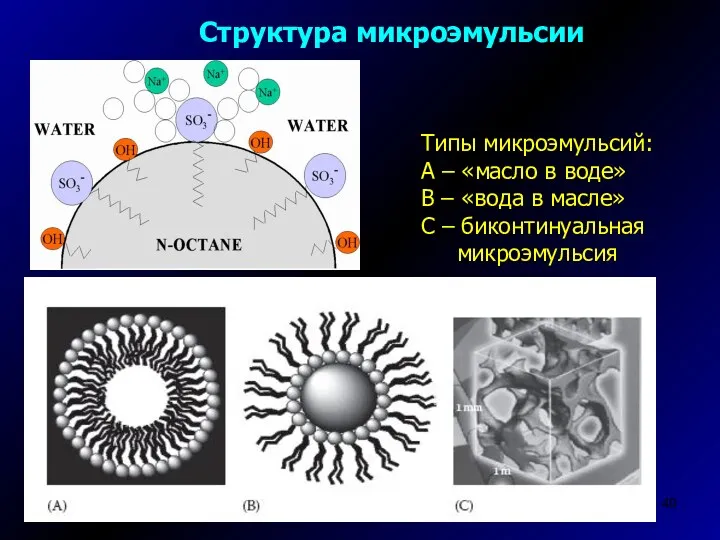
- 49. Структура микроэмульсии Типы микроэмульсий: А – «масло в воде» В – «вода в масле» С –
- 50. Макрогомогенны Оптически прозрачны и устойчивы Большая площадь поверхности Участки с повышенной энергией Каталитические и стабилизационные свойства
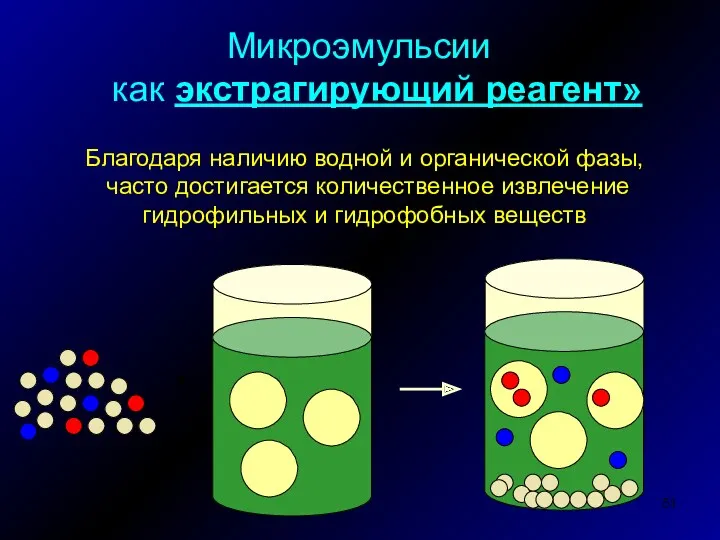
- 51. Микроэмульсии как экстрагирующий реагент» Благодаря наличию водной и органической фазы, часто достигается количественное извлечение гидрофильных и
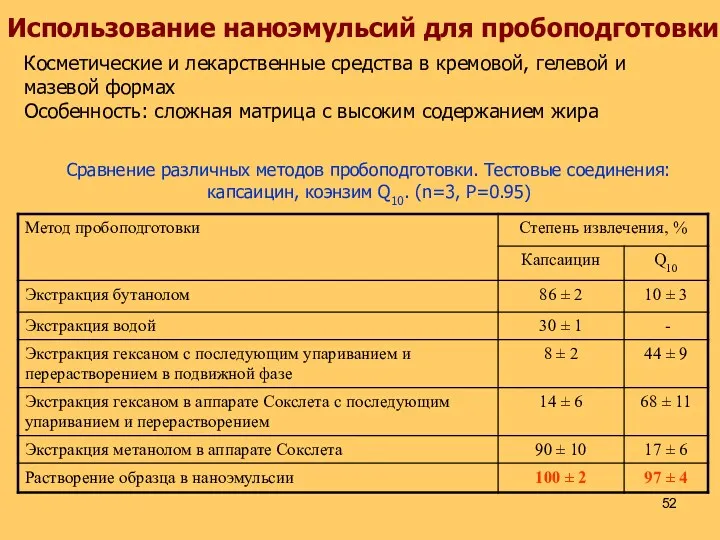
- 52. Использование наноэмульсий для пробоподготовки Косметические и лекарственные средства в кремовой, гелевой и мазевой формах Особенность: сложная
- 53. Микроэмульсии как «катализатор» целевых процессов Поверхность капли микроэмульсии постоянно обновляется. Возникают области с повышенной энергией, которые
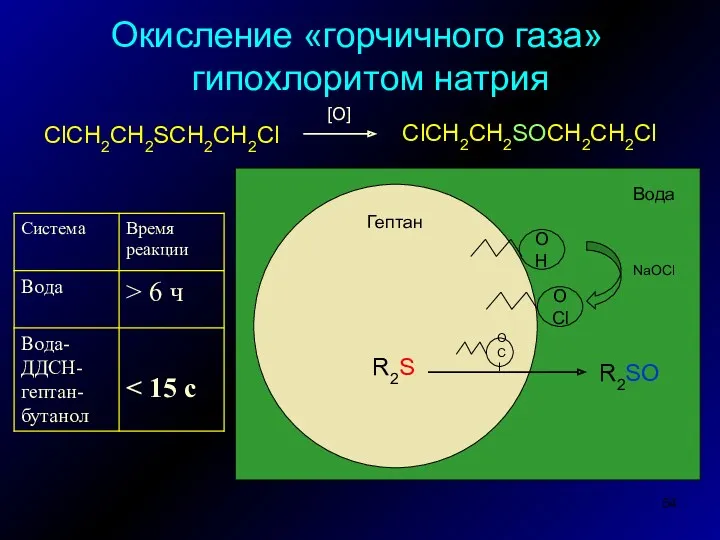
- 54. Окисление «горчичного газа» гипохлоритом натрия
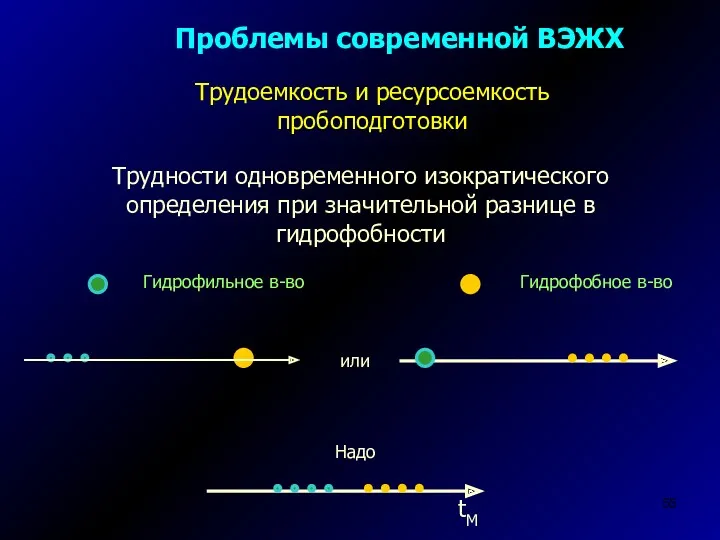
- 55. Проблемы современной ВЭЖХ Трудности одновременного изократического определения при значительной разнице в гидрофобности Трудоемкость и ресурсоемкость пробоподготовки
- 56. Возможные способы снижения давления 1. Снижение скорости потока подвижной фазы 2. Повышение температуры элюента 3. Использование
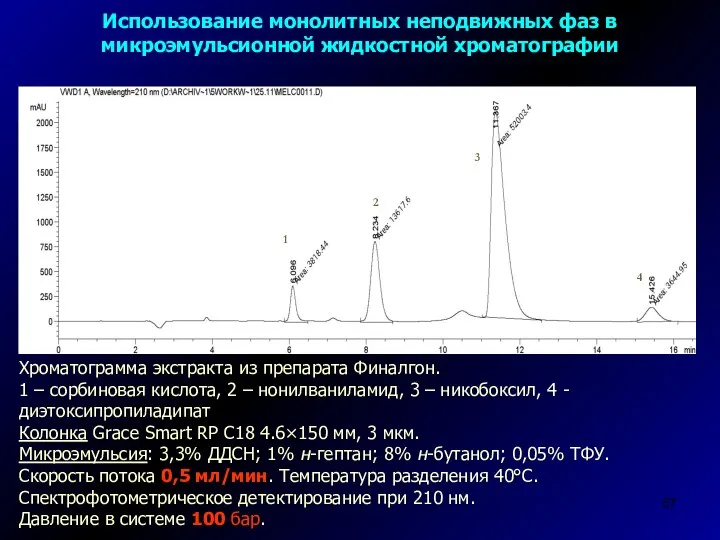
- 57. Хроматограмма экстракта из препарата Финалгон. 1 – сорбиновая кислота, 2 – нонилваниламид, 3 – никобоксил, 4
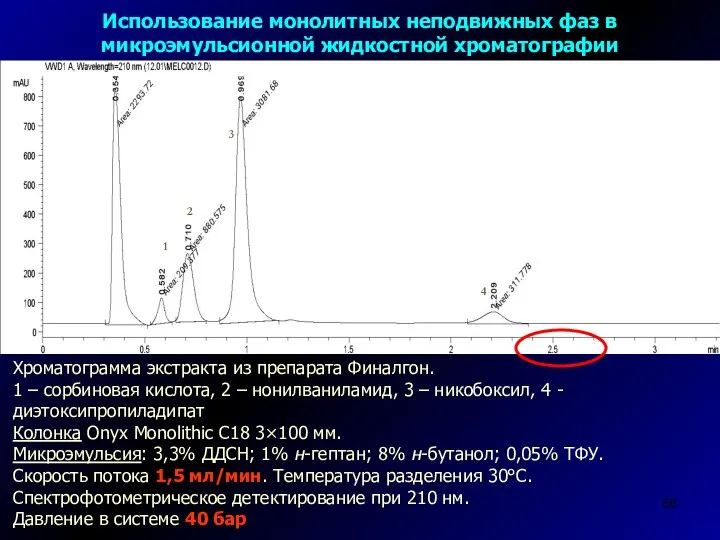
- 58. Хроматограмма экстракта из препарата Финалгон. 1 – сорбиновая кислота, 2 – нонилваниламид, 3 – никобоксил, 4
- 59. Выбор варианта хроматографии в зависимости от задачи
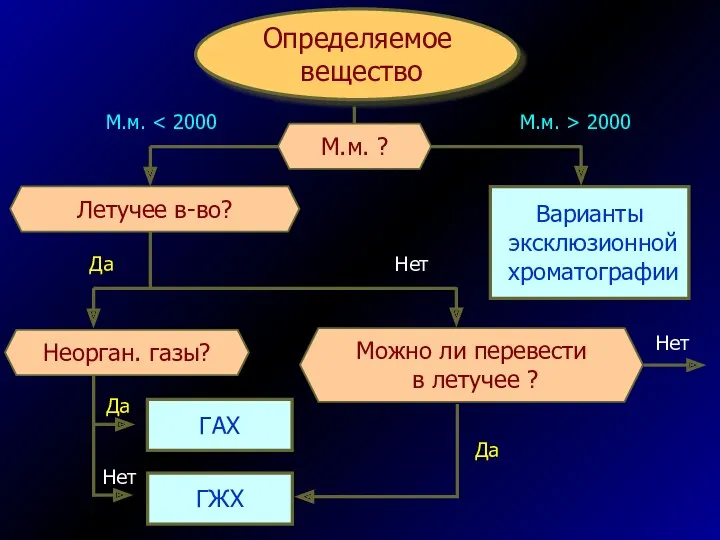
- 60. Определяемое вещество Варианты эксклюзионной хроматографии Летучее в-во? Можно ли перевести в летучее ? Неорган. газы? ГАХ
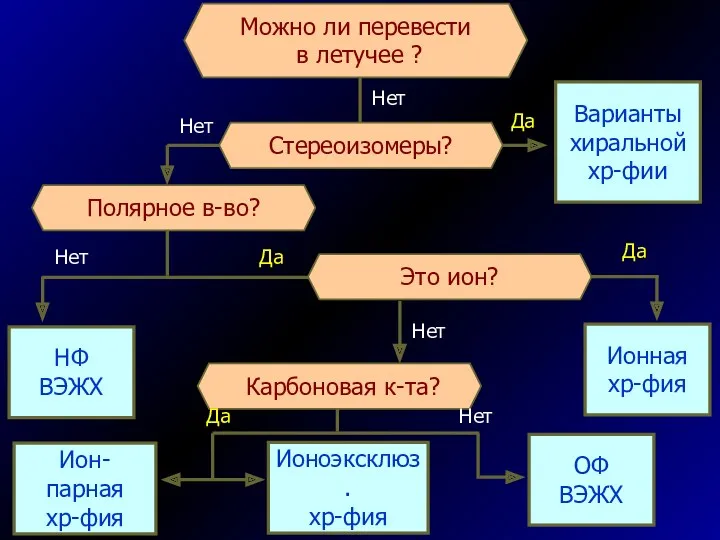
- 61. Полярное в-во? Стереоизомеры? Варианты хиральной хр-фии НФ ВЭЖХ Это ион? Карбоновая к-та? Ионная хр-фия
- 63. Скачать презентацию


























 Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток
Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Рафинирование металлических расплавов
Рафинирование металлических расплавов Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Общая характеристика металлов
Общая характеристика металлов Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері
Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері Химия сабағындағы өздік жұмыстар
Химия сабағындағы өздік жұмыстар Ископаемые углеводороды
Ископаемые углеводороды Времена алхимиков
Времена алхимиков Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Оксид серы (IV) и серы (VI)
Оксид серы (IV) и серы (VI) Минералы для ИЗБ
Минералы для ИЗБ Химия: классификация химических реакций
Химия: классификация химических реакций Химический элемент углерод
Химический элемент углерод Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1 Бытовая химия. Правила безопасного обращения со средствами бытовой химии
Бытовая химия. Правила безопасного обращения со средствами бытовой химии Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Термодинамика химических процессов
Термодинамика химических процессов Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4)
Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4) Осмос. Онкотикалық қысым. Изотоникалық коэффицент. Гипо, гипер изотоникалық ерітінділер
Осмос. Онкотикалық қысым. Изотоникалық коэффицент. Гипо, гипер изотоникалық ерітінділер Химическая кинетика. Тема 2.2
Химическая кинетика. Тема 2.2 Атомы и молекулы. Простые и сложные вещества (8 класс)
Атомы и молекулы. Простые и сложные вещества (8 класс) Растворы. Лекция 7
Растворы. Лекция 7 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Алкадиены (диены)
Алкадиены (диены) Гидролиз солей
Гидролиз солей Галогены
Галогены