Содержание
- 2. К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат
- 3. В свободном виде не встречаются
- 4. Галит NaCl
- 6. Иод — элемент редкий
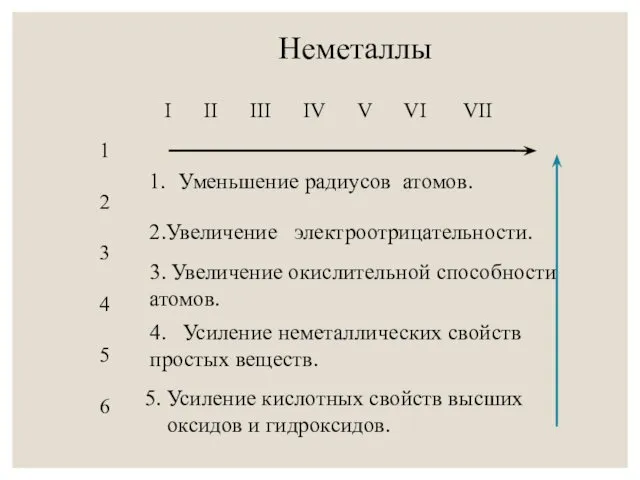
- 8. Неметаллы I II III IV V VI VII 1 2 3 4 5 6 Уменьшение радиусов
- 10. Название "фтор" (от греческого phthoros - разрушение, гибель) Ни один из химических элементов не принес химикам
- 11. Хлор был открыт шведским химиком Карлом Шееле в 1774 г. Газ желто-зеленого цвета с резким запахом,
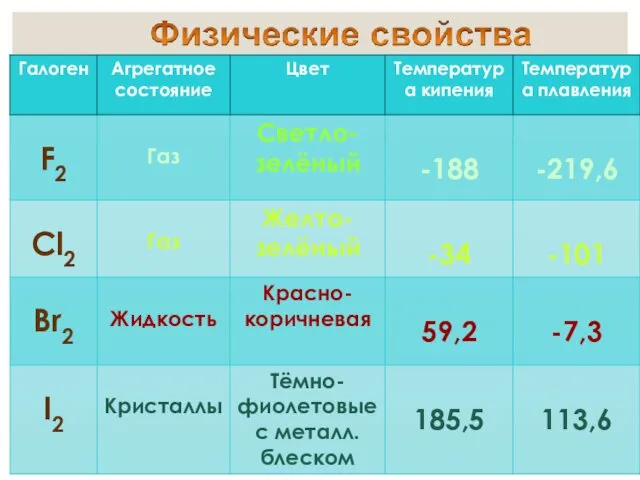
- 12. от греч. bromos – зловоние единственный неметалл, жидкий при комнатной температуре пары брома имеют желто-бурый цвет
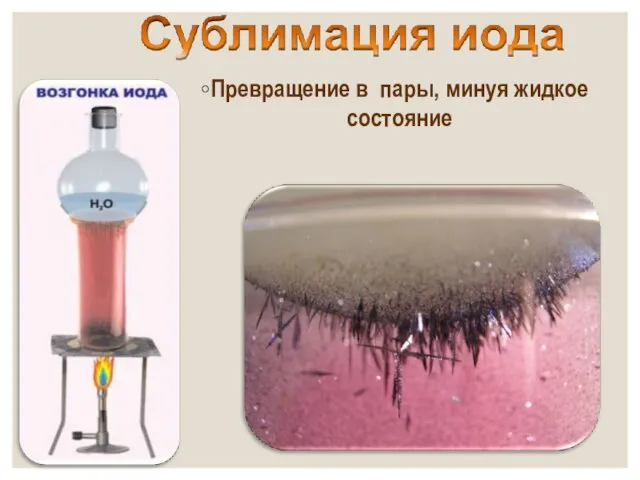
- 13. от греч. iodes—имеющий фиалковый цвет в парообразное состояние переходит при комнатной t°, не плавясь (сублимация); пары
- 14. Превращение в пары, минуя жидкое состояние
- 15. Молекулы галогенов состоят из двух атомов. Связь – ковалентная неполярная
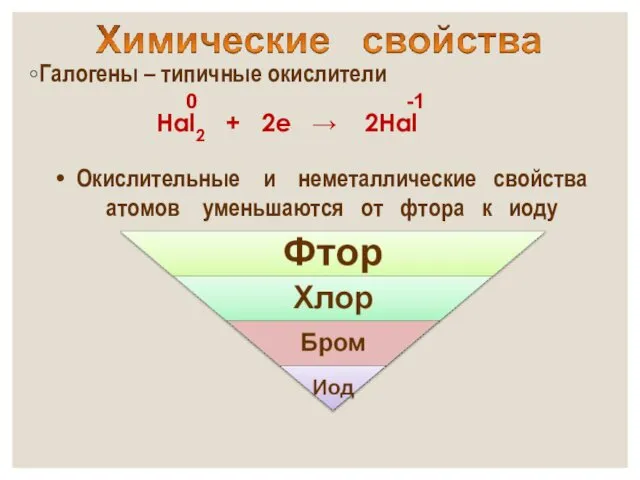
- 16. Галогены – типичные окислители Hal2 + 2e → 2Hal -1 Окислительные и неметаллические свойства атомов уменьшаются
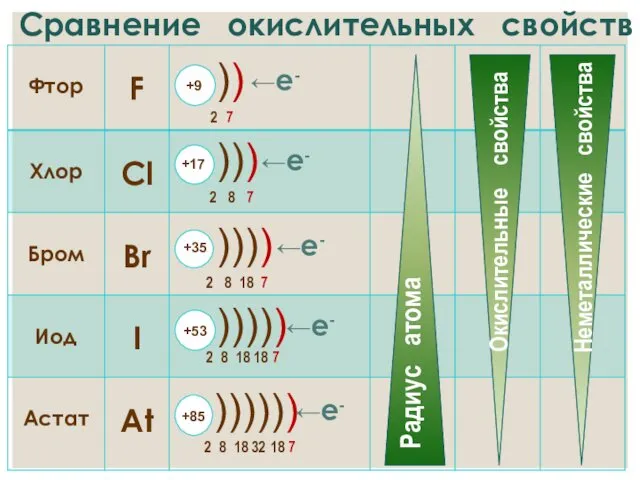
- 17. Сравнение окислительных свойств ←е- ←е- ←е- ←е- ←е-
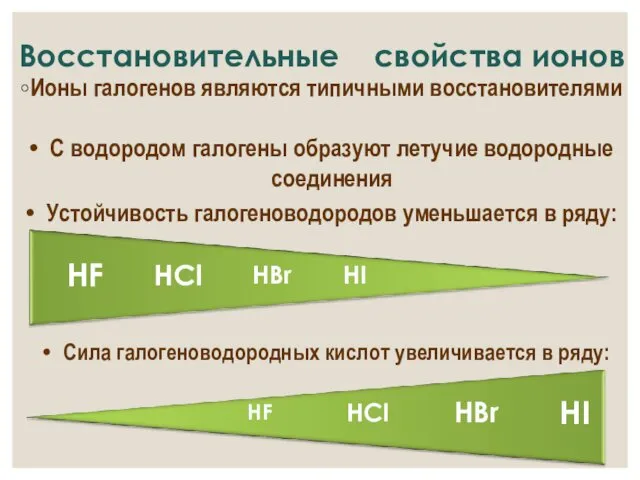
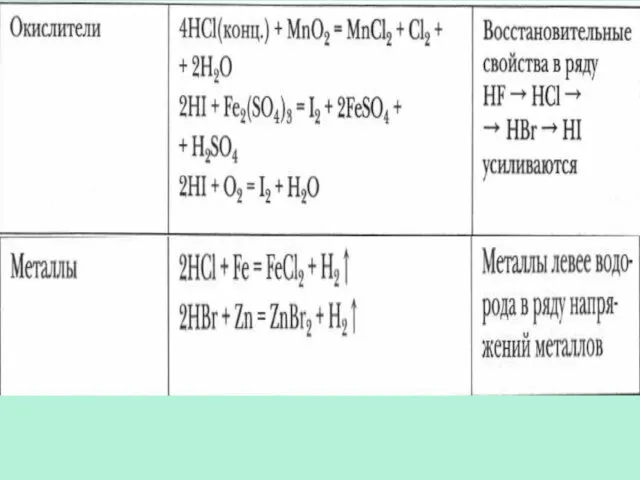
- 18. Восстановительные свойства ионов Ионы галогенов являются типичными восстановителями С водородом галогены образуют летучие водородные соединения Устойчивость
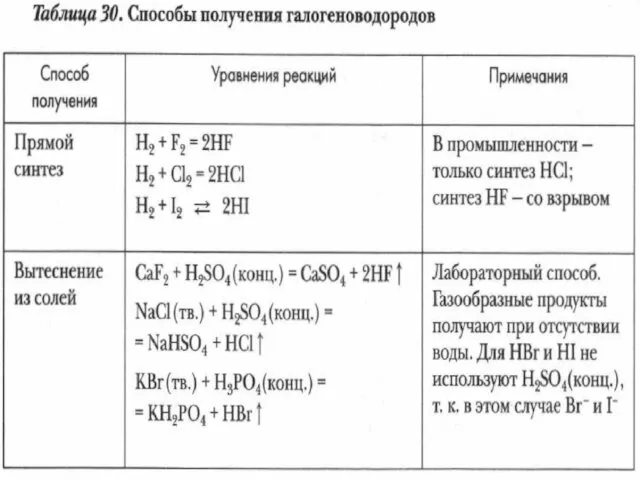
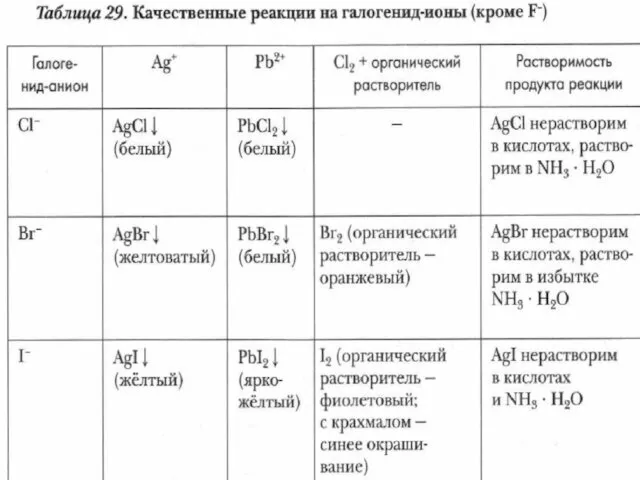
- 19. Соединения галогенов
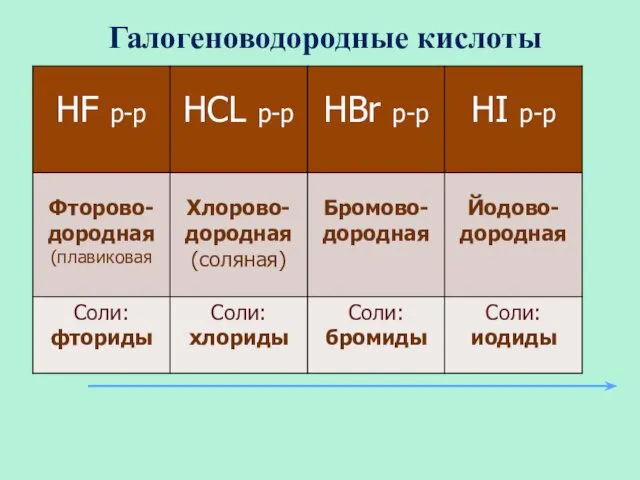
- 20. Галогеноводородные кислоты
- 21. PH3 – H2S – HCl Усиление кислотных св-в. Чем больше радиус атома неМе и меньше атомов
- 22. 27.01.2017 Сафиканов А.Ф.
- 23. 27.01.2017 Сафиканов А.Ф.
- 24. Химические свойства галогеноводородов 27.01.2017 Сафиканов А.Ф.
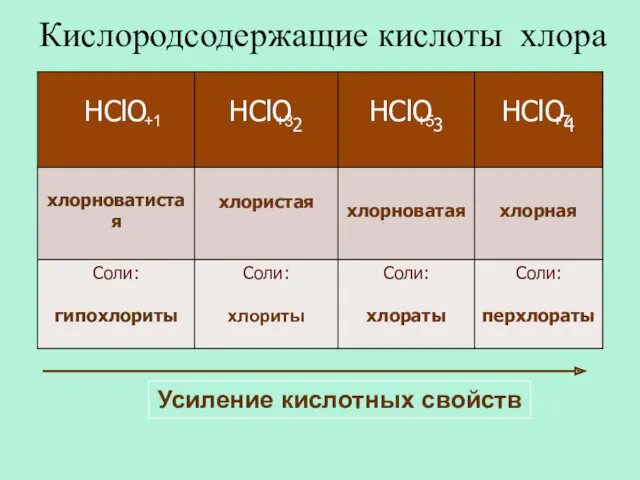
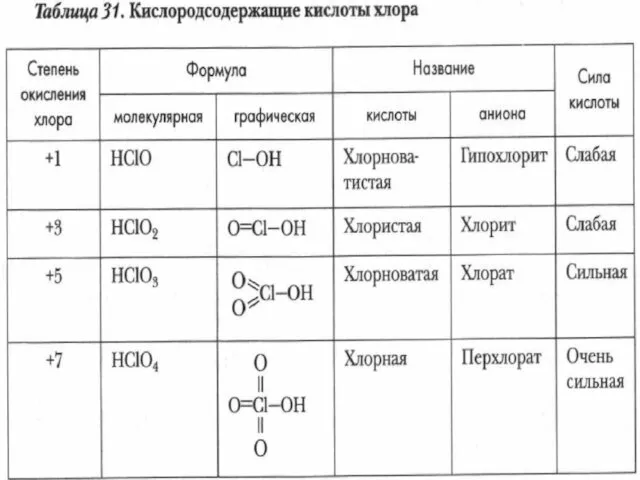
- 27. Кислородсодержащие кислоты хлора +1 +3 +5 +7 Усиление кислотных свойств
- 28. 27.01.2017
- 29. Химические свойства 1. Взаимодействие с неметаллами: 2. Взаимодействие с металлами: Cu + Cl2 = CuCl2 O2
- 30. Химические свойства хлора 3. Взаимодействие с водой: Cl2 + H2O = HCl + HClO Cl2 +
- 31. 5. Взаимодействие сo щёлочами: Cl2 + 2NaOH = NaCl + NaClO + H2O хол. р-р 3Cl2
- 32. В промышленности: электролиз расплава или раствора хлорида натрия В лаборатории: 4 HСl + MnO2 → MnCl2
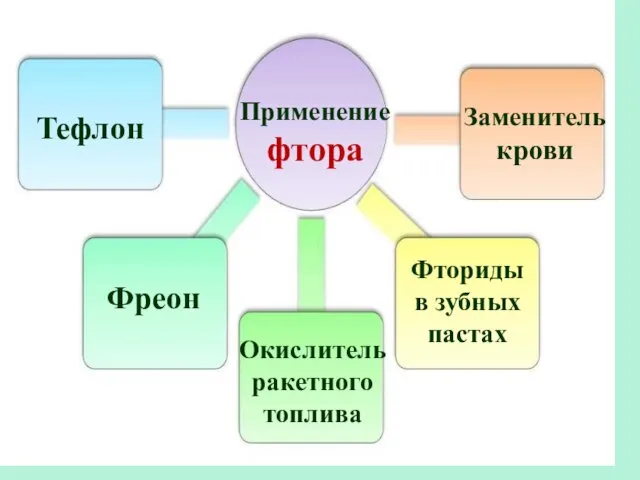
- 33. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
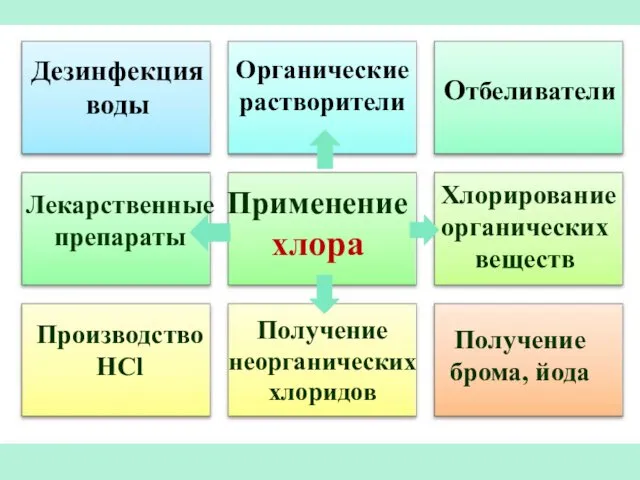
- 34. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
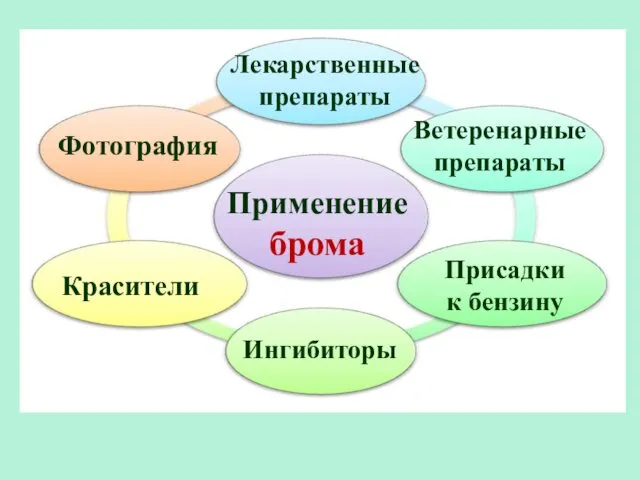
- 35. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину
- 37. Скачать презентацию



















 Химическая промышленность
Химическая промышленность Приёмы обращения с лабораторным оборудованием
Приёмы обращения с лабораторным оборудованием Химические свойства металлов
Химические свойства металлов Анализ жидких средств для мытья посуды
Анализ жидких средств для мытья посуды Химический элемент уран
Химический элемент уран Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Мыловарение. Мыло своими руками
Мыловарение. Мыло своими руками Характеристика химического элемента Металла на основании его положения в периодической системе Д.И. Менделеева
Характеристика химического элемента Металла на основании его положения в периодической системе Д.И. Менделеева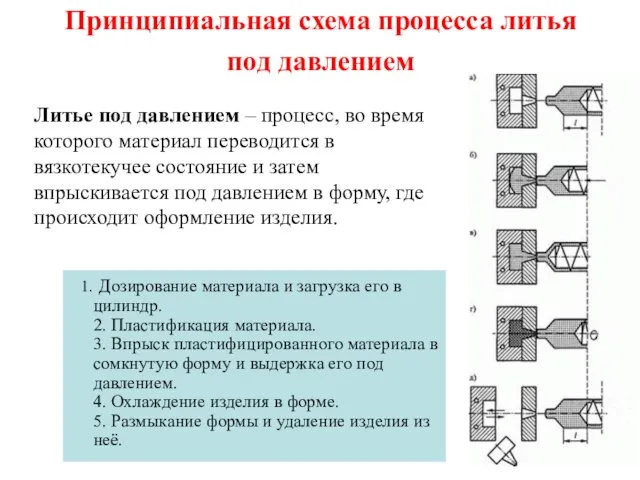 Принципиальная схема процесса литья под давлением
Принципиальная схема процесса литья под давлением Алкены. Гомологический ряд и изомерия
Алкены. Гомологический ряд и изомерия Железо и его свойства
Железо и его свойства Строение атома
Строение атома Такой разный песок
Такой разный песок Адсорбция на твердых телах
Адсорбция на твердых телах Самое удивительное на свете вещество - вода
Самое удивительное на свете вещество - вода Кам’яне вугілля, продукти його переробки
Кам’яне вугілля, продукти його переробки Чисті речовини та суміші. Способи розділення
Чисті речовини та суміші. Способи розділення Механизмы органических реакций. (Лекция 2)
Механизмы органических реакций. (Лекция 2)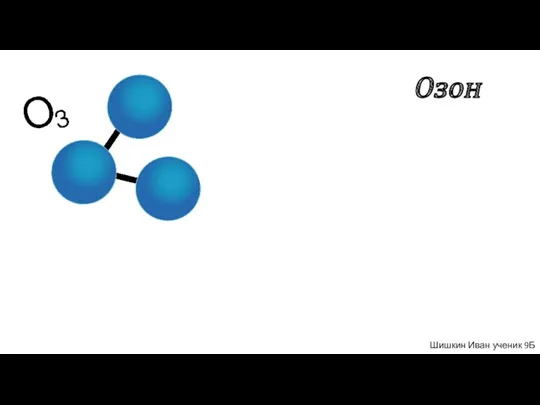 Озон. Значение Озона
Озон. Значение Озона Понятия и определения химической термодинамики. (Лекция 11)
Понятия и определения химической термодинамики. (Лекция 11) Периодические изменения свойств химических элементов
Периодические изменения свойств химических элементов Простые эфиры
Простые эфиры Электролитическая диссоциация химических элементов
Электролитическая диссоциация химических элементов Экспериментально исследовательский проект Соль волшебница
Экспериментально исследовательский проект Соль волшебница Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Кислоты. Состав кислот
Кислоты. Состав кислот Массовая доля вещества в растворе
Массовая доля вещества в растворе Получение и применение алканов
Получение и применение алканов