Содержание
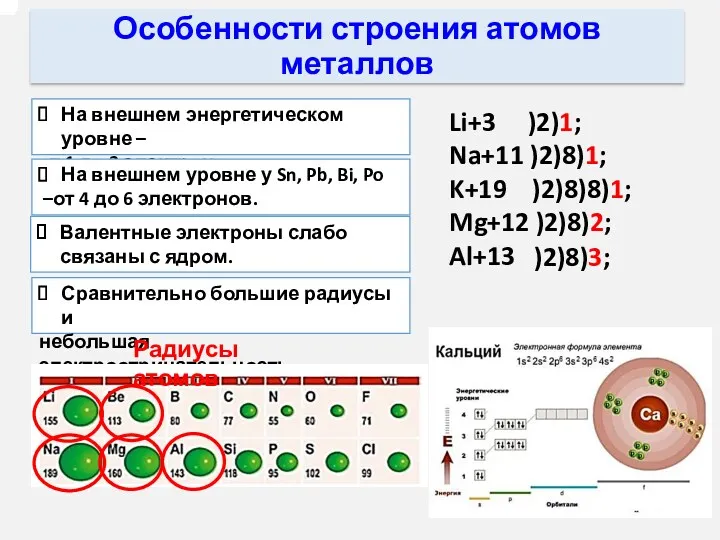
- 2. Особенности строения атомов металлов На внешнем энергетическом уровне – от 1 до 3 электронов. На внешнем
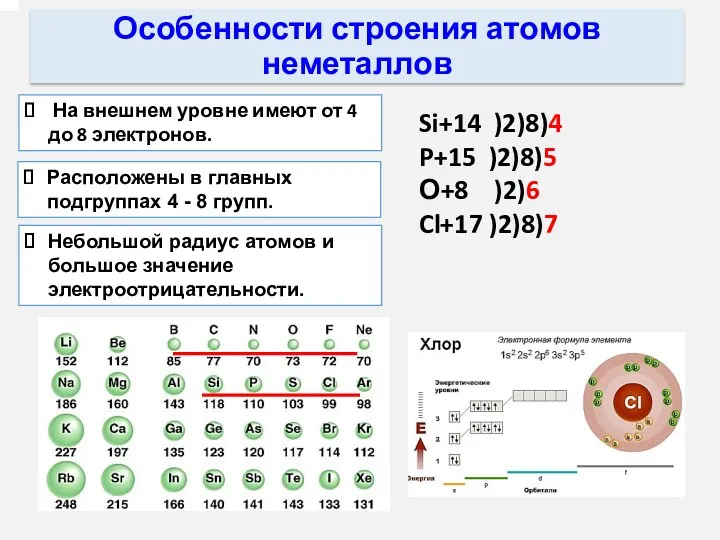
- 3. Расположены в главных подгруппах 4 - 8 групп. Особенности строения атомов неметаллов На внешнем уровне имеют
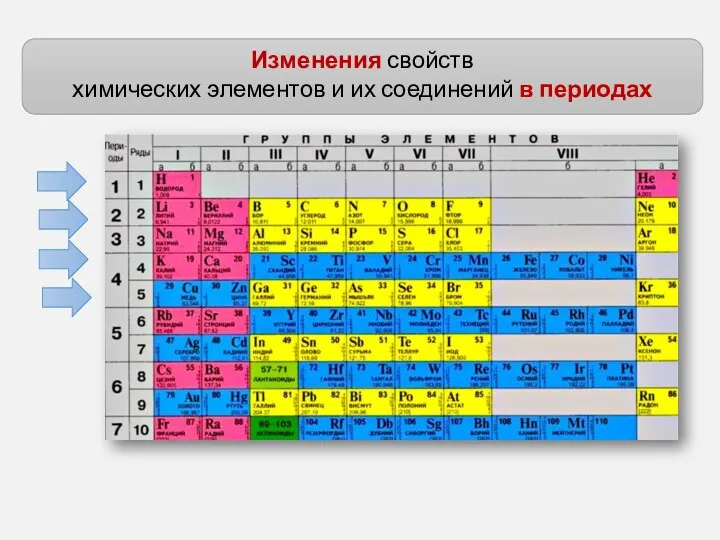
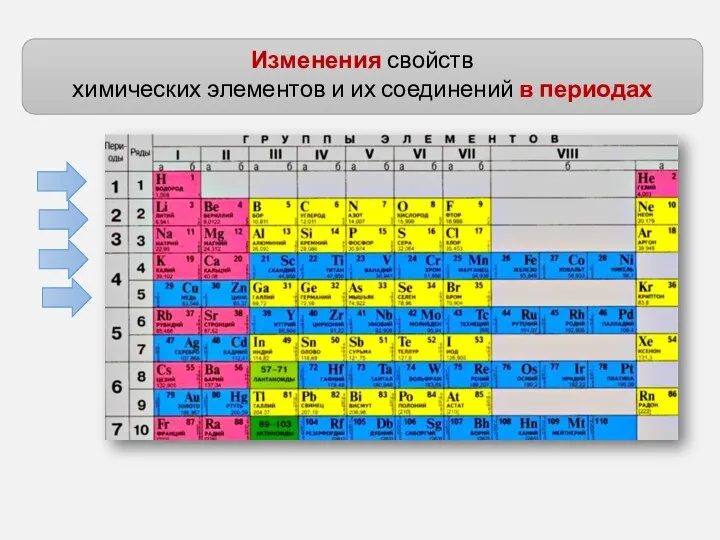
- 4. Изменения свойств химических элементов и их соединений в периодах
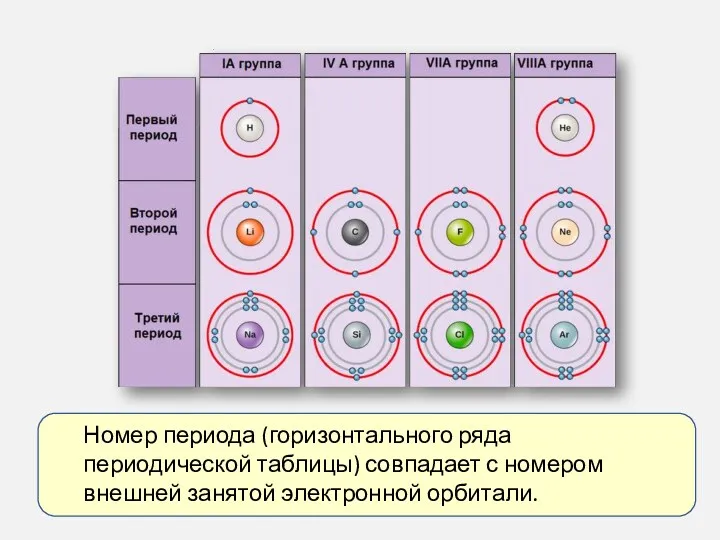
- 5. Номер периода (горизонтального ряда периодической таблицы) совпадает с номером внешней занятой электронной орбитали.
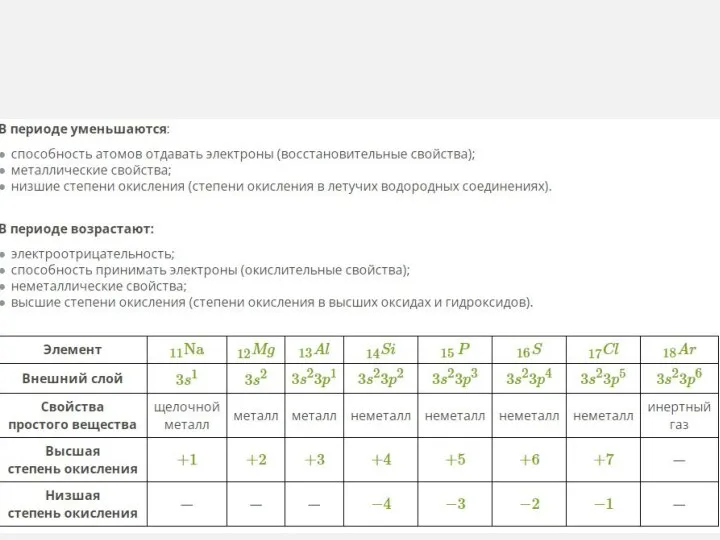
- 6. Металлические свойства – это способность атомов отщеплять внешние (валентные) электроны. Неметаллические свойства – это способность атомов
- 7. Изменения свойств химических элементов и их соединений в периодах
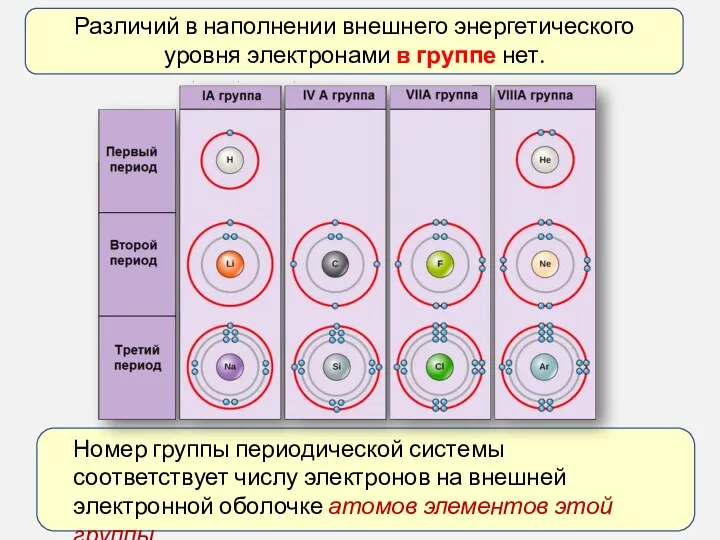
- 8. Различий в наполнении внешнего энергетического уровня электронами в группе нет. Номер группы периодической системы соответствует числу
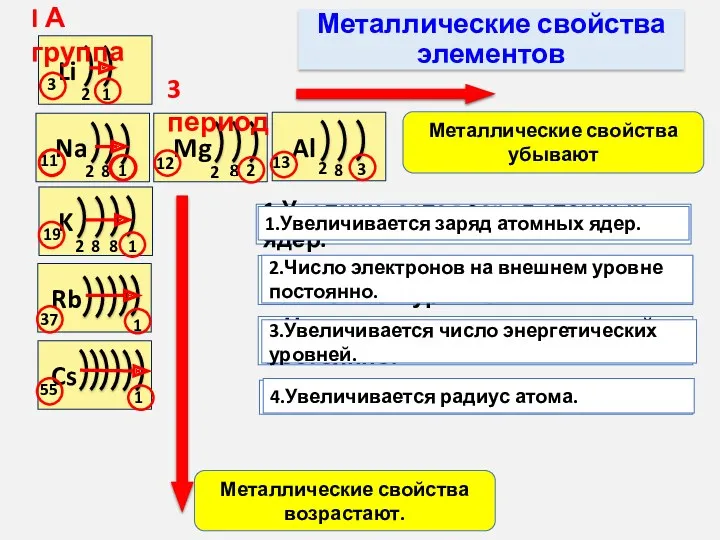
- 9. Металлические свойства элементов Na 11 2 8 1 Mg 12 2 2 Al 13 2 8
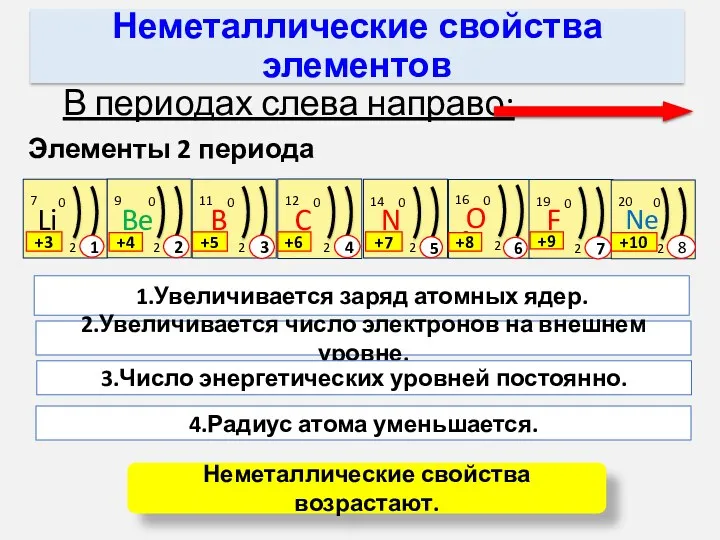
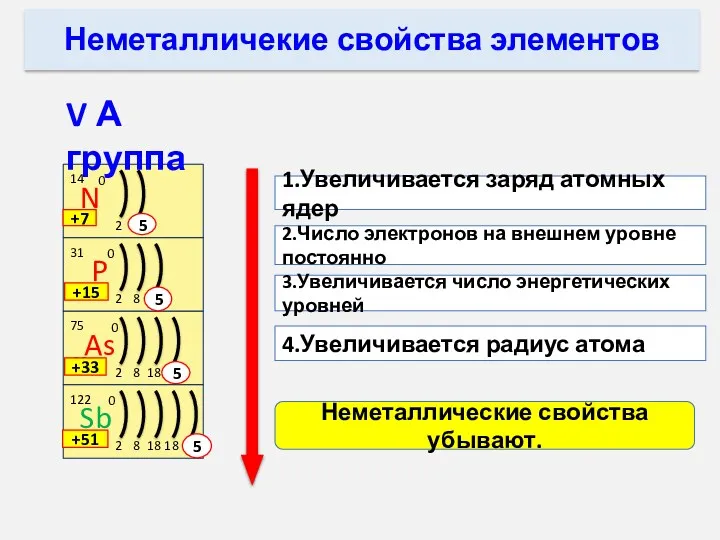
- 10. Неметаллические свойства элементов В периодах слева направо: Элементы 2 периода 1.Увеличивается заряд атомных ядер. 2.Увеличивается число
- 11. 1.Увеличивается заряд атомных ядер 2.Число электронов на внешнем уровне постоянно 3.Увеличивается число энергетических уровней 4.Увеличивается радиус
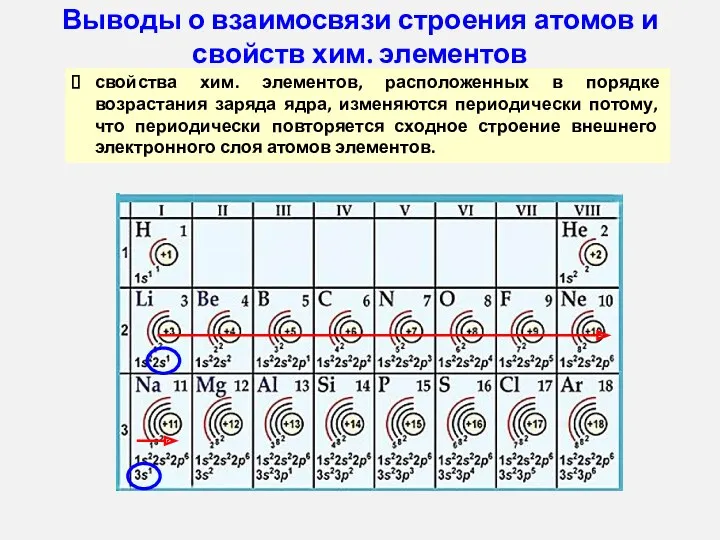
- 12. свойства хим. элементов, расположенных в порядке возрастания заряда ядра, изменяются периодически потому, что периодически повторяется сходное
- 13. Выводы о взаимосвязи строения атомов и свойств хим. элементов плавное изменение свойств элементов в пределах одного
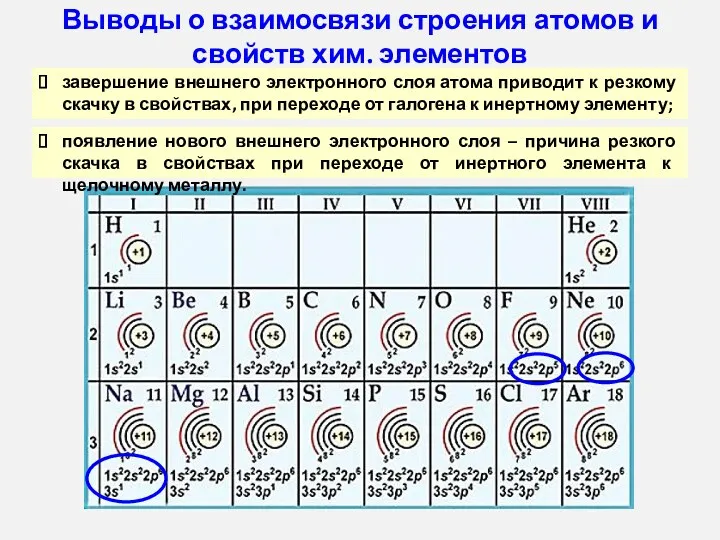
- 14. Выводы о взаимосвязи строения атомов и свойств хим. элементов завершение внешнего электронного слоя атома приводит к
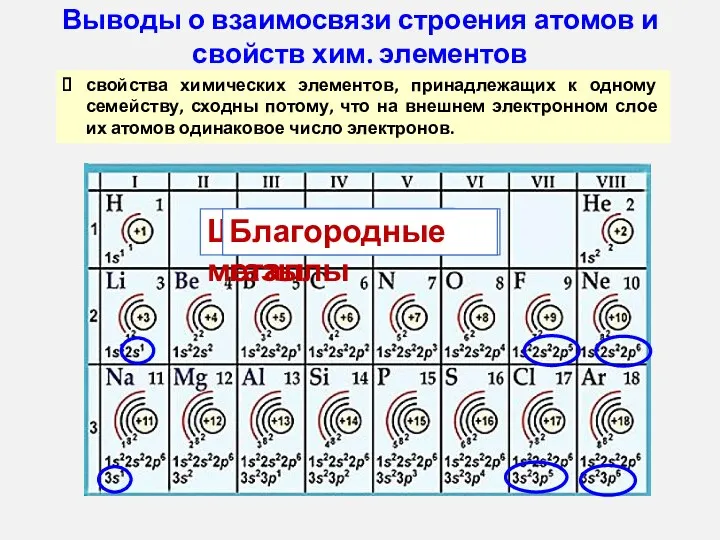
- 15. Выводы о взаимосвязи строения атомов и свойств хим. элементов свойства химических элементов, принадлежащих к одному семейству,
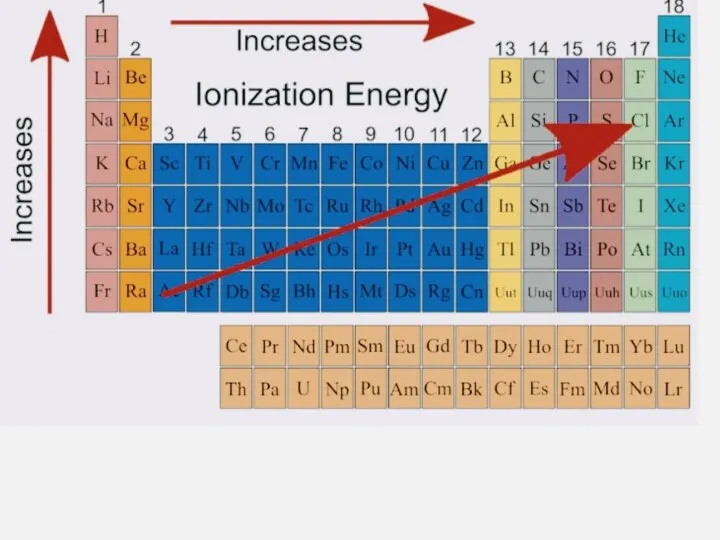
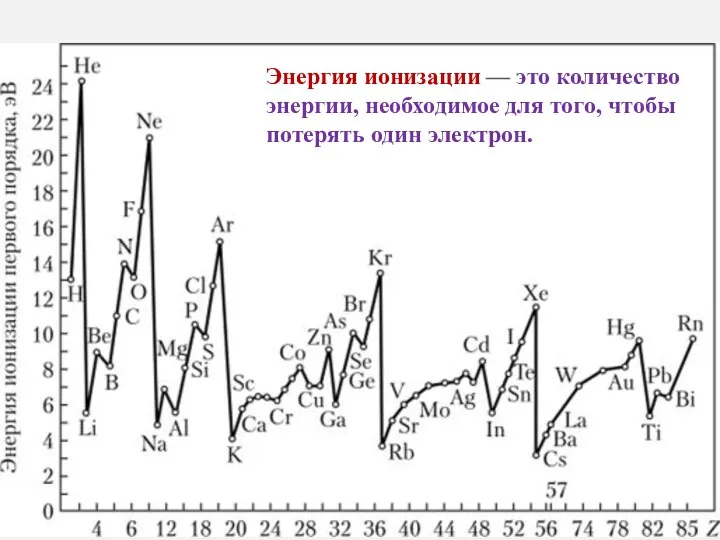
- 19. Энергия ионизации — это количество энергии, необходимое для того, чтобы потерять один электрон.
- 21. Периодическое изменение свойств атомов и их соединений по периодам
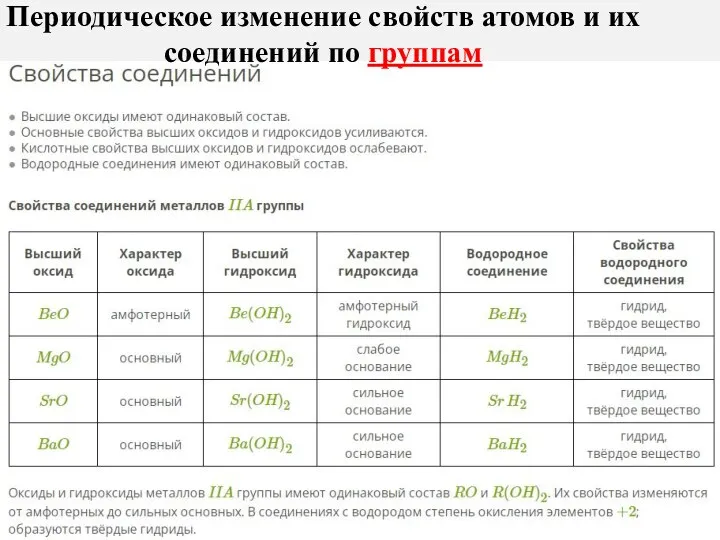
- 22. Периодическое изменение свойств атомов и их соединений по группам
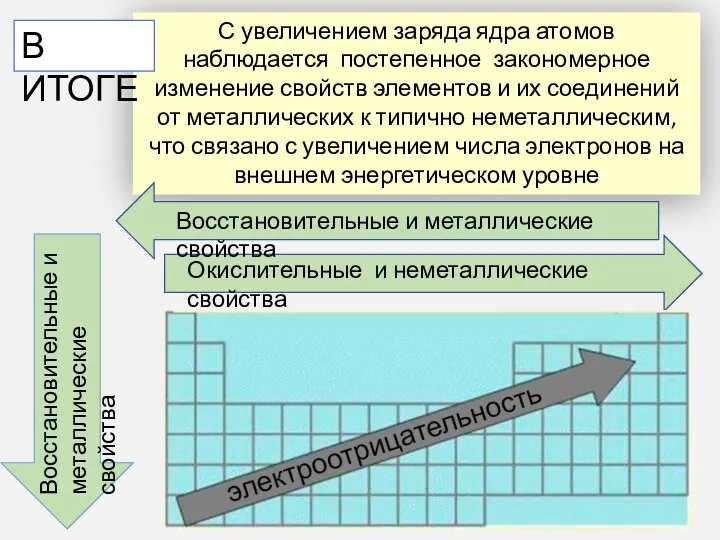
- 23. С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических
- 24. Zn Cr Al Sn Pb Mn Fe Be Есть еще элементы, которые образуют так называемые амфотерные
- 25. Периодическое изменение свойств атомов и их соединений по периодам
- 26. Периодическое изменение свойств атомов и их соединений по группам
- 27. Характеристика химического элемента по его положению в периодической таблице ПЛАН Химический знак, название. Положение в периодической
- 28. ОБРАЗЕЦ ХАРАКТЕРИСТИКИ
- 29. Повторение Задание: заполните пропуски. В периодах слева направо: металлические свойства____________________ а неметаллические свойства_________________, потому что: а)_______________________________________
- 30. Задание. В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ? 1) алюминий →
- 31. Закрепление материала Задание №1: Сравните металлические свойства элементов, поставив вместо ☺ знак « »: Na ☺
- 32. Проверьте себя: Сравните металлические свойства элементов, поставив вместо ☺ знак « »: Na Sr; Na >
- 33. Задание №2: Расположите элементы в порядке уменьшения их металлических свойств: а) Al, Na, K, B, Bа,
- 34. Проверьте себя: Расположите элементы в порядке уменьшения их металлических свойств: а) K > Bа > Nа
- 35. Домашнее задание: Изучить §41, по данной презентации сделать конспект и выполнить тест (смотри ниже!!!), ответы на
- 36. В ряду Li → Ве → В → С А усиливаются восстановительные свойства простых веществ Б
- 37. 2. Усиление металлических свойств элементов представлено в ряду: А N → Р → As Б S
- 38. 3. Электронную конфигурацию 1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0) имеет ион А Ca(0) Б Al(3+) В Cs(+) Г K(+)
- 39. 4. В каком ряду кислотность соединений возрастает А Cr(0), Cr(3+), Cr(+6) Б Mn(+6), Mn(+4), Mn(+2) В
- 40. 5. Как изменяются кислотные свойства оксидов хрома в ряду: CrO - Cr2O3 - CrO3 А основной
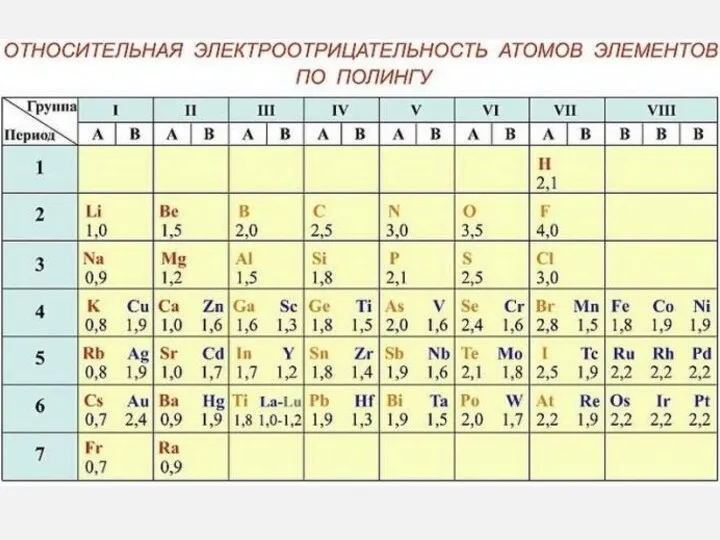
- 41. 6. Даны элементы: F, O, N, Cl. Какие утверждения верны? А в заданном ряду элементов электроотрицательность
- 42. 7. Наиболее выражены металлические свойства у: А фософра Б азота В рубидия Г водорода
- 43. 8. Только амфотерные оксиды указаны в ряду: А Na2O, ZnO, CuO Б ZnO, Al2O3, Cr2O3 В
- 44. 9. Выберите правильное утверждение: А - в ряду элементов: Na – Si – Cl неметалличность простых
- 45. 10. Соединения элемента с порядковым номером 20 А простое вещество проявляет металлические свойства Б оксид элемента
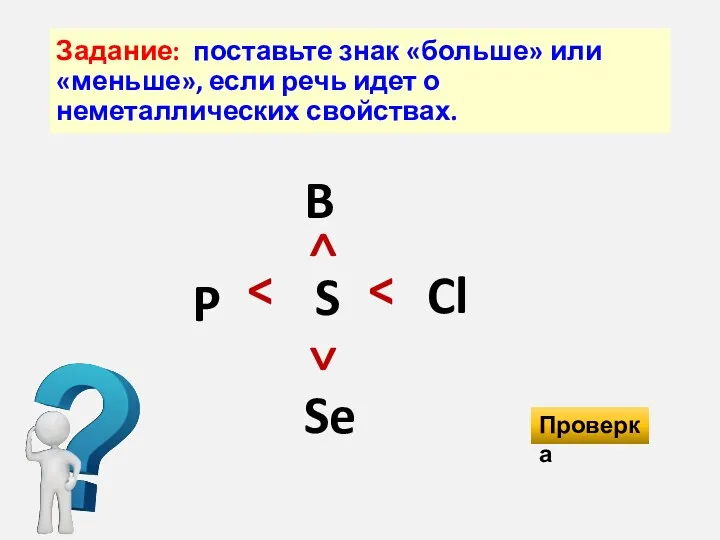
- 46. Задание: поставьте знак «больше» или «меньше», если речь идет о неметаллических свойствах. B S Se P
- 48. Скачать презентацию


























 Месторождения берилла и топаза
Месторождения берилла и топаза Минеральные удобрения. Для школьников
Минеральные удобрения. Для школьников Решение задач на определение массовой и объемной доли вещества для смесей и растворов
Решение задач на определение массовой и объемной доли вещества для смесей и растворов Исследовательский проект определение качества питьевой воды в домашних условиях
Исследовательский проект определение качества питьевой воды в домашних условиях Получение наночастиц в сверхкритическом флюиде
Получение наночастиц в сверхкритическом флюиде Химический элемент кремний
Химический элемент кремний Классификация неорганических соединений
Классификация неорганических соединений Подгруппа азота
Подгруппа азота Метод изготовления слоистых и намотанных ПКМ
Метод изготовления слоистых и намотанных ПКМ Валентность и степень окисления элементов
Валентность и степень окисления элементов Щелочные металлы
Щелочные металлы Общая геохимия. Атомная и молекулярная масса. Представление результатов аналитических исследований
Общая геохимия. Атомная и молекулярная масса. Представление результатов аналитических исследований Строение вещества. Строение атома
Строение вещества. Строение атома Тотығутотықсыздану титрлеу әдістері. Дәріс № 7
Тотығутотықсыздану титрлеу әдістері. Дәріс № 7 Основания. Классификация оснований
Основания. Классификация оснований Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток
Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік
Сулы ерітінділер. Тірі ағза сұйықтықтарындағы тепе-теңдік Серная кислота. ОХТ, лекция №7
Серная кислота. ОХТ, лекция №7 Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Нефть - “Кормилица”. 10 класс
Нефть - “Кормилица”. 10 класс Біохімія вуглеводів
Біохімія вуглеводів Химия нефти и газа
Химия нефти и газа Камни и Телец
Камни и Телец Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Омега 3
Омега 3 Биомакромолекулы. Нуклеиновые кислоты
Биомакромолекулы. Нуклеиновые кислоты Альдегиды и кетоны
Альдегиды и кетоны