Содержание
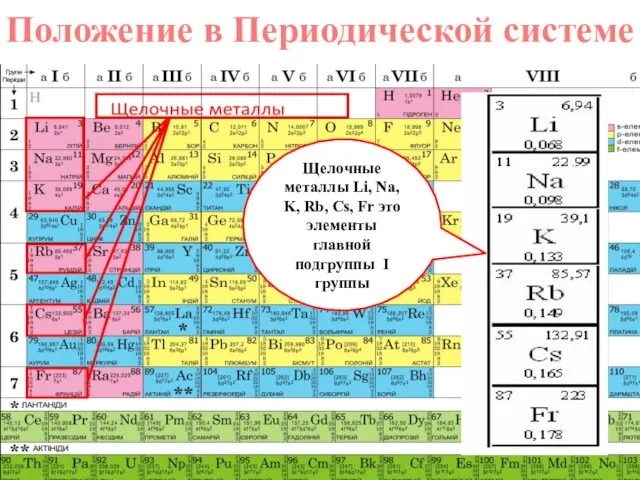
- 2. Положение в Периодической системе Щелочные металлы Li, Na, K, Rb, Cs, Fr это элементы главной подгруппы
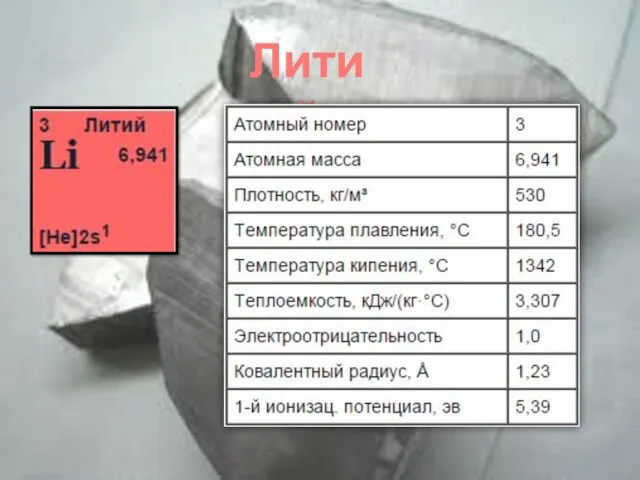
- 4. Литий
- 5. Натрий
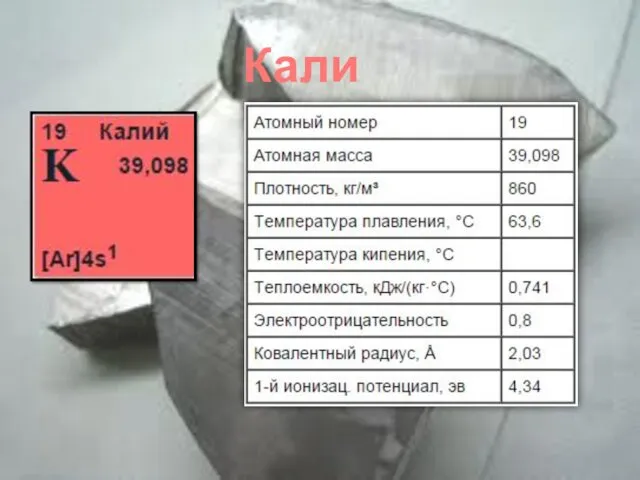
- 6. Калий
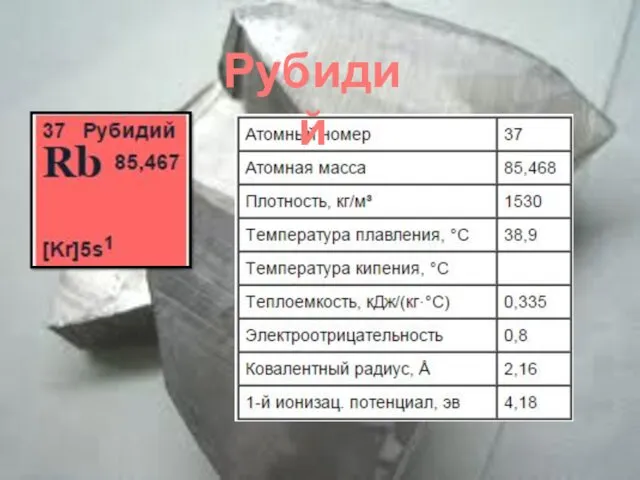
- 7. Рубидий
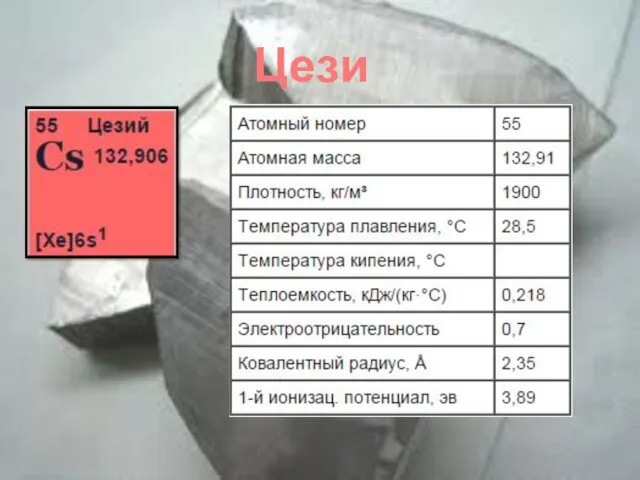
- 8. Цезий
- 9. Франций
- 10. Щелочные металлы в свободном виде в природе не встречаются т.к. очень сильно окисляются,они встречаются в виде
- 11. Нахождение лития в природе петалит (Li,Na)[Si4AlO10] сподумен LiAl[Si2O6] лепидолит KLi1.5Al1.5[Si3AlO10](F,OH)2.
- 12. Na2SO4· 10H2O - глауберова соль NaNO3 - чилийская селитра Na3AlF6 - криолит Нахождение натрия в природе
- 13. Нахождение калия в природе KCl - сильвин KCl NaCl - сильвинит KCl·MgCl2·6H2O карналлит
- 14. Нахождение рубидия в природе RbCl·MgCl2·6H2O карналлит циннвальдит амазонит
- 15. Нахождение цезия в природе поллуцит авонгадрид
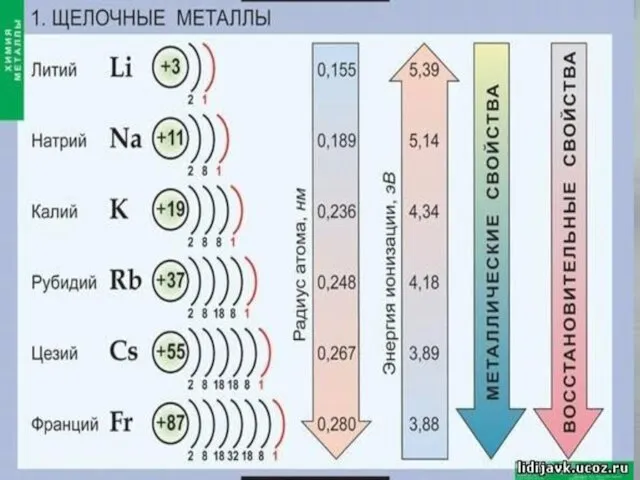
- 16. Цвет - серебристо-белый (Сs - золотисто-желтый); Тип связи – металлический; Кристаллическая решетка – объемоцентрированная; Тепло- и
- 17. Взаимодействие с неметаллами оксид образует только литий: 4Li + O2 = 2Li2O, натрий образует пероксид: 2Na
- 18. С галогенами образуют галогениды: 2Na + Cl2 = 2NaCl. С водородом образуются гидриды: 2Na + H2
- 19. Взаимодействие с водой Все щелочные металлы с водой, литий реагирует спокойно, держась на поверхности воды, натрий
- 20. Взаимодействие с кислотами Щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет
- 21. Взаимодействие с аммиаком. Щелочные металлы реагируют с аммиаком с образованием амида натрия: 2Li + 2NH3 =
- 22. Взаимодействие с органическими веществами Щелочные металлы реагируют со спиртами и фенолами, которые проявляют в данном случае
- 23. Восстановление металлов из оксидов и солей Менее активные металлы могут быть получены восстановлением щелочными металлами: 3Na
- 24. окрашивание пламени в следующие цвета: Общая характеристика щелочных металлов Качественная реакция на катионы щелочных металлов-
- 26. Скачать презентацию



![Нахождение лития в природе петалит (Li,Na)[Si4AlO10] сподумен LiAl[Si2O6] лепидолит KLi1.5Al1.5[Si3AlO10](F,OH)2.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/115698/slide-10.jpg)













 Вещества и их свойства
Вещества и их свойства Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара
Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара Типы химических реакций в органической химии
Типы химических реакций в органической химии Хімічні явища в побуті
Хімічні явища в побуті Обзор электродных процессов
Обзор электродных процессов Аммиак
Аммиак Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі. Лекція №27
Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі. Лекція №27 Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений
Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений Металдар
Металдар Карбоновые кислоты
Карбоновые кислоты Химическая кинетика
Химическая кинетика Гидрирование альдегидов и кетонов
Гидрирование альдегидов и кетонов Mechanistic insights into the aminolysis of 3,4-epoxysulfolane
Mechanistic insights into the aminolysis of 3,4-epoxysulfolane Йони. Йонний зв’язок, його утворення
Йони. Йонний зв’язок, його утворення 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Оксиды. Классификация. Химические и физические свойства (8 класс)
Оксиды. Классификация. Химические и физические свойства (8 класс) Кислородосодержащие соединения - спирты
Кислородосодержащие соединения - спирты Классификация химических реакций. 8 класс
Классификация химических реакций. 8 класс Водород и его свойства
Водород и его свойства Аминокислоты. Белки
Аминокислоты. Белки Основания
Основания Фазовые превращения в стали при охлаждении
Фазовые превращения в стали при охлаждении Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул Приготування розчинів
Приготування розчинів Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Полимеры и их использование
Полимеры и их использование Алкадиены: гомологический ряд, общая формула, номенклатура. Сопряжённые, изолированные, кумулированные
Алкадиены: гомологический ряд, общая формула, номенклатура. Сопряжённые, изолированные, кумулированные