Содержание
- 2. Все что нас окружает состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой.
- 3. Отгадай загадку и узнай о чем пойдет речь на сегодняшнем уроке Она идет, она прошла! Никто
- 4. Что такое химическая реакция? Химические реакции или химические явления – это процессы, в результате которых из
- 5. По каким признакам можно определить химические реакции? Выделение газа; Образование осадка; Выделение (поглощение) тепла и света;
- 6. Каковы условия возникновения реакций: 1) Образование хлорида аммония 2) Горение магния 3) Взаимодействие алюминия с иодом
- 7. Химические реакции. Как классифицировать ?
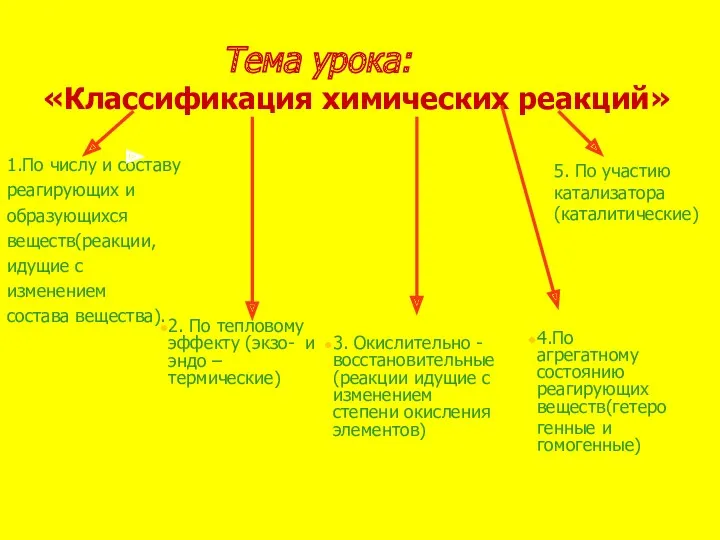
- 8. Тема урока: «Классификация химических реакций» 1.По числу и составу реагирующих и образующихся веществ(реакции, идущие с изменением
- 9. 2H2 + O2 → 2H2O CaO + H2O → Ca(OH)2 Cu(OH)2 → CuO + H2O; 2HgO
- 10. …Al +… O2 → …Al2O3 …P + …O2 → …P2O5 Na2O + SO3 → Na2SO4 Li2O
- 11. …Fe(OH)3 → Fe2O3 +… H2O …HgO → …Hg + O2 CaCO3 → CaO + CO2 …NO
- 12. CuCl2 + Fe → Cu + FeCl2 Cr2O3 + …Al → …Cr + Al2O3 Mg +
- 13. CuO + …HCl → CuCl2 + H2О BaCl2 + K2SO4 → BaSO4 + …KCl Что объединяет
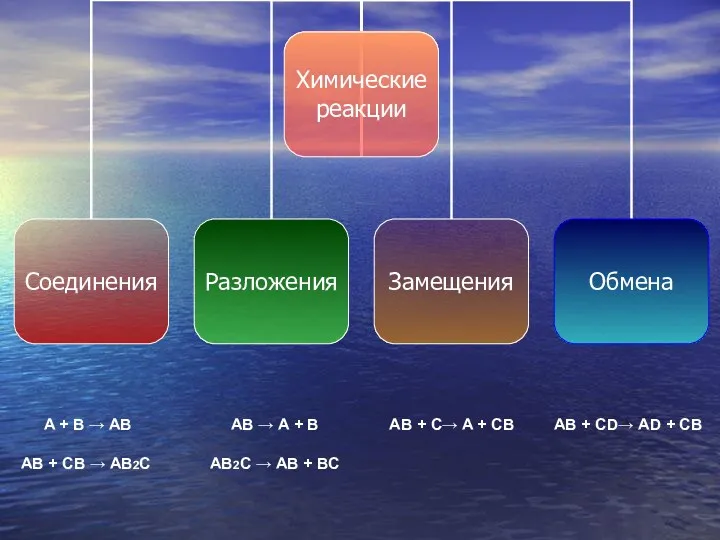
- 14. A + B → AB AB + CB → AB2C AB → A + B AB2C
- 16. Скачать презентацию











 Химия в жизни общества
Химия в жизни общества Organic molecules
Organic molecules Первичная переработка нефти
Первичная переработка нефти Состав газированной воды
Состав газированной воды Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Галогены (солеобразующие)
Галогены (солеобразующие) Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями
Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями Катионы 1, 2 аналитических групп
Катионы 1, 2 аналитических групп Углекислый газ
Углекислый газ Неон. Получение
Неон. Получение Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
 Химическая связь
Химическая связь Углеводы Cn(H2O)m
Углеводы Cn(H2O)m Генетическая связь между классами органических веществ
Генетическая связь между классами органических веществ Типы химических реакций в органической химии
Типы химических реакций в органической химии СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Хімічні сполуки у побуті
Хімічні сполуки у побуті Основные классы неорганических веществ
Основные классы неорганических веществ Мир первозданной красоты. Природные уникумы Урала
Мир первозданной красоты. Природные уникумы Урала Химический элемент и вещество
Химический элемент и вещество Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива
Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива