Содержание
- 2. Актуальность Карбоновые кислоты и их функциональные производные (сложные эфиры и тиоэфиры, амиды, гидразиды галогенангидриды и ангидриды)
- 3. Их взаимопревращаемость используется химиками-органиками для получения новых соединений. Функциональные группы карбоновых кислот, сложных эфиров и тиоэфиров,
- 4. Актуальность Поэтому знание электронного строения функциональных групп вышеуказанных классов органических соединений и на этой основе прогнозирование
- 5. Цель лекции На основе электронного строения функциональных групп типа где Х = -ОН, -ОR, -SR, -NH2,
- 6. План Реакционные центры карбоновых кислот и их функциональных производных …...10 мин Сравнительная кислотность карбоновых кислот………………………20 мин
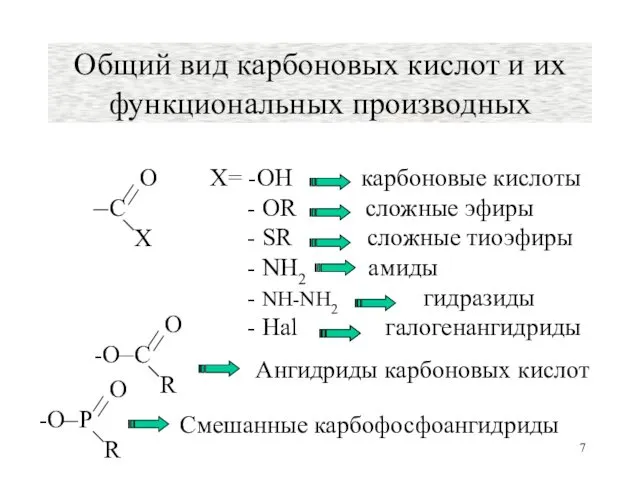
- 7. Общий вид карбоновых кислот и их функциональных производных
- 8. Реакционные центры Любая группа Х (кроме Cl и оксикарбонильной) является электронодонором для оксогруппы и ослабляет её
- 9. Кислотность карбоновых кислот В карбоновых кислотах существует ещё один важный центр – ОН-кислотный. О←Н δ+ С
- 10. Электроноакцепторные заместители усиливают кислотность карбоновых кислот, т.к. стабилизируют сопряженный анион. Электронодоноры дестабилизируют сопряженный анион и поэтому
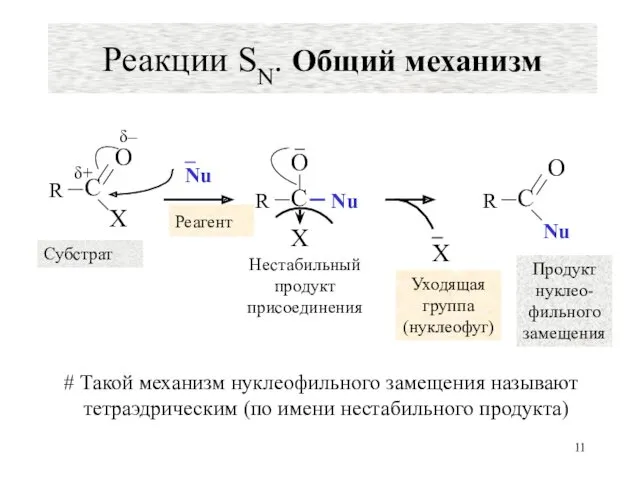
- 11. Реакции SN. Общий механизм Nu – Субстрат Реагент Нестабильный продукт присоединения Уходящая группа (нуклеофуг) Продукт нуклео-
- 12. Условия протекания реакции Наличие хорошей уходящей группы Наличие сильного нуклеофильного реагента или сильного электрофильного центра #
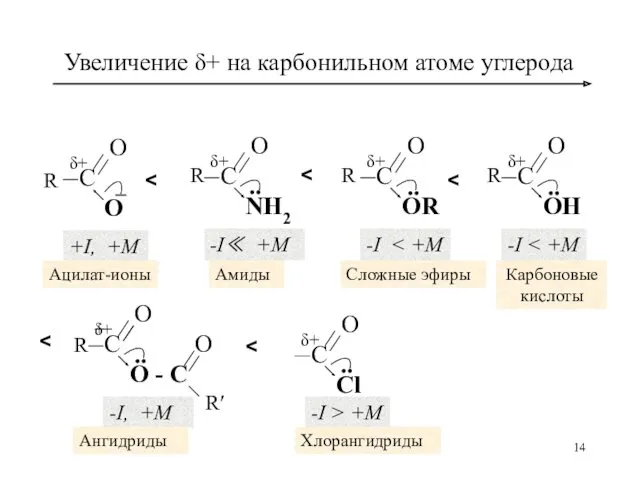
- 13. Величина эффективного положительного заряда карбонильной группы Зависит от соотношения –I и +М-эффектов группы Х: с увеличением
- 14. Увеличение δ+ на карбонильном атоме углерода С О О δ+ – +I, +M .. С О
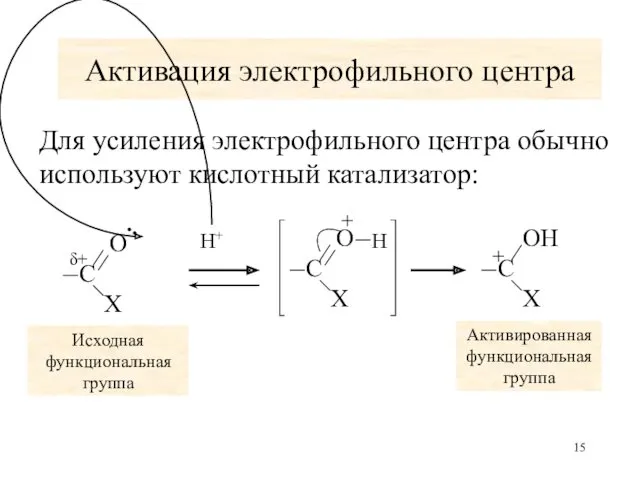
- 15. Активация электрофильного центра Для усиления электрофильного центра обычно используют кислотный катализатор: Исходная функциональная группа Активированная функциональная
- 16. Реакция образования сложных эфиров Схема: # Эта реакция называется реакцией этерификации Но она может носить и
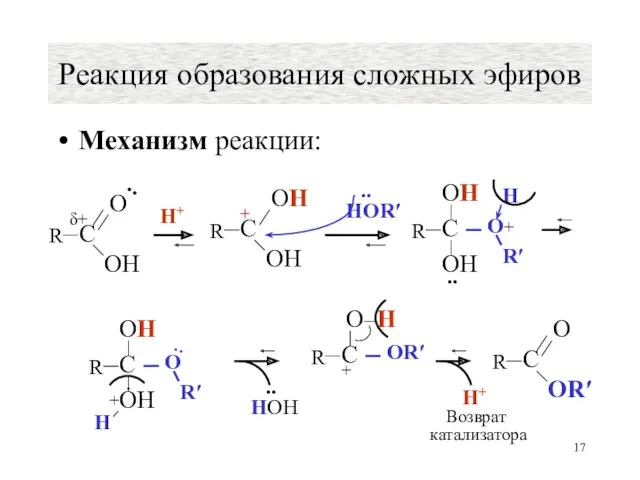
- 17. Механизм реакции: Реакция образования сложных эфиров H+ HOR′ .. HOH .. С О–H R OR′ +
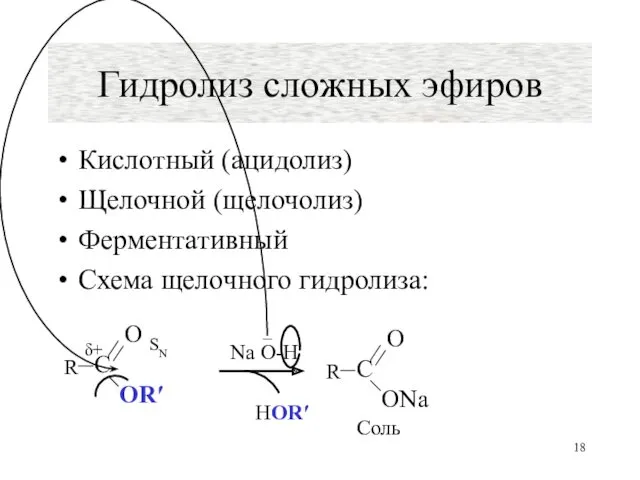
- 18. Гидролиз сложных эфиров Кислотный (ацидолиз) Щелочной (щелочолиз) Ферментативный Схема щелочного гидролиза:
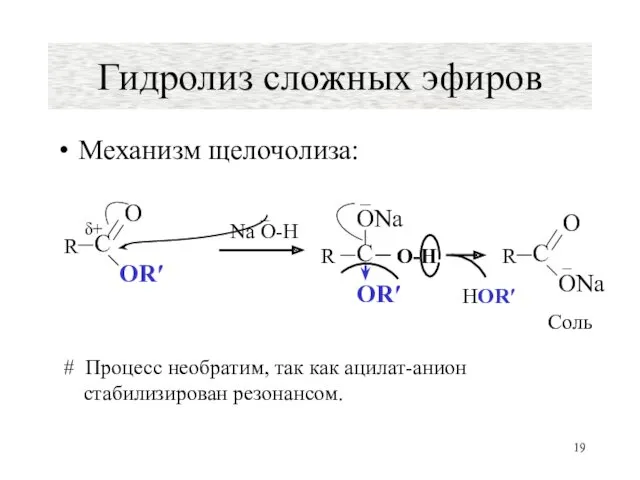
- 19. Механизм щелочолиза: Гидролиз сложных эфиров Na O-H – δ+ HOR′ С О ONa R Соль С
- 20. Значение гидролиза В организме по принципу кислотного гидролиза расщепляются жиры и сложные омыляемые липиды, белки, нуклеиновые
- 22. Скачать презентацию












 Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Синтетические топлива
Синтетические топлива Определение витамина “С” в продуктах питания с помощью иодометрии
Определение витамина “С” в продуктах питания с помощью иодометрии Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Этапы гравиметрического анализа. (Лекция 3)
Этапы гравиметрического анализа. (Лекция 3) Искусственная и синтетическая резина
Искусственная и синтетическая резина Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах
Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах Галогены (солеобразующие)
Галогены (солеобразующие) Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Свойства воды. Оценка качества
Свойства воды. Оценка качества Теплота сгорания топлива
Теплота сгорания топлива Железо и его соединения
Железо и его соединения Коррозия металлов
Коррозия металлов Классы неорганических веществ. Соли
Классы неорганических веществ. Соли Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Анионы. Группы анионов
Анионы. Группы анионов Электронное строение атома
Электронное строение атома Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis Магний (Mg)
Магний (Mg) Химические свойства солей в свете теории электролитической диссоциации
Химические свойства солей в свете теории электролитической диссоциации Удивительный мир камня
Удивительный мир камня Щелочные металлы
Щелочные металлы Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)
Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)