Содержание
- 2. Результат: прямые потери массы металла; косвенные потери - утрата важнейших свойств. Коррозия – рыжая крыса, Грызёт
- 3. Коррозия - самопроизвольное разрушение поверхности металлов (сплавов) под влиянием химического и электрохимического воздействия окружающей среды. окислительно-восстановительный
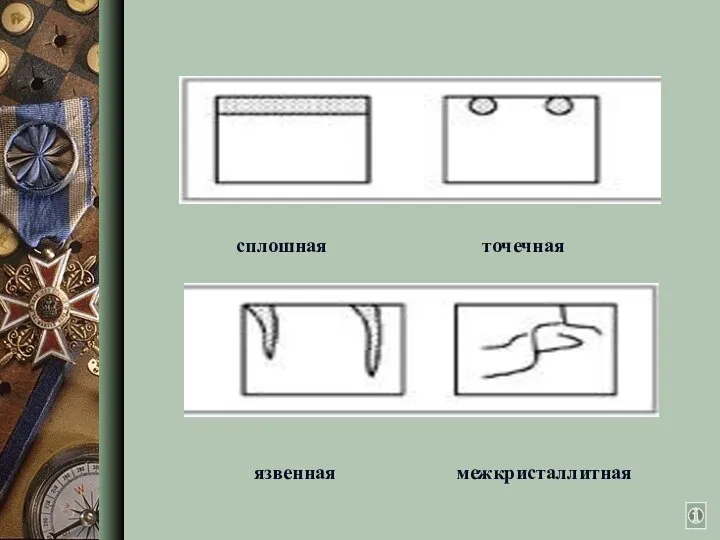
- 4. Виды коррозии
- 5. язвенная межкристаллитная сплошная точечная
- 6. Причины коррозии - химические и электрохимические процессы окисления, происходящие на поверхности металлических тел при их взаимодействии
- 7. Химическая коррозия - металл разрушается в результате его химического взаимодействия с агрессивной средой (сухими газами, жидкостями-неэлектролитами).
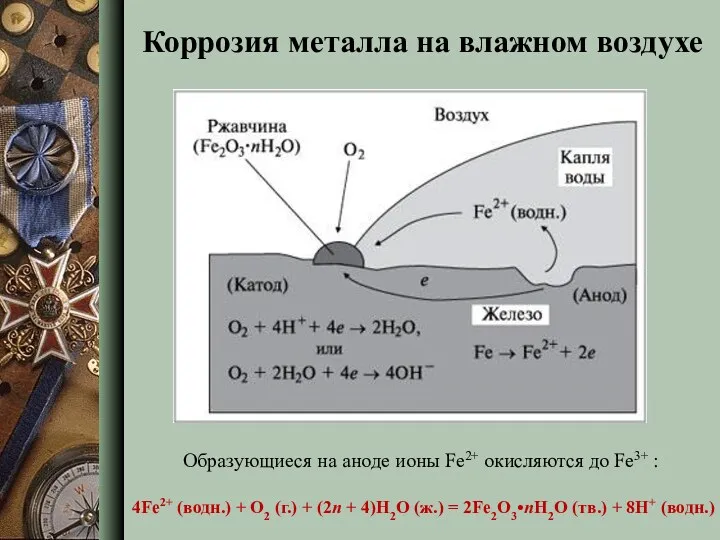
- 8. Коррозия металла на влажном воздухе Образующиеся на аноде ионы Fe2+ окисляются до Fe3+ : 4Fe2+ (водн.)
- 9. Электрохимическая коррозия - в среде электролита возникает электрический ток при контакте двух металлов (или на поверхности
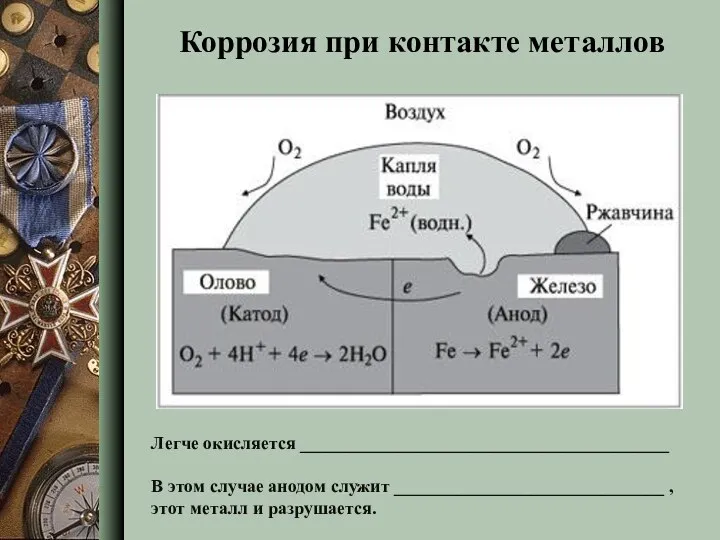
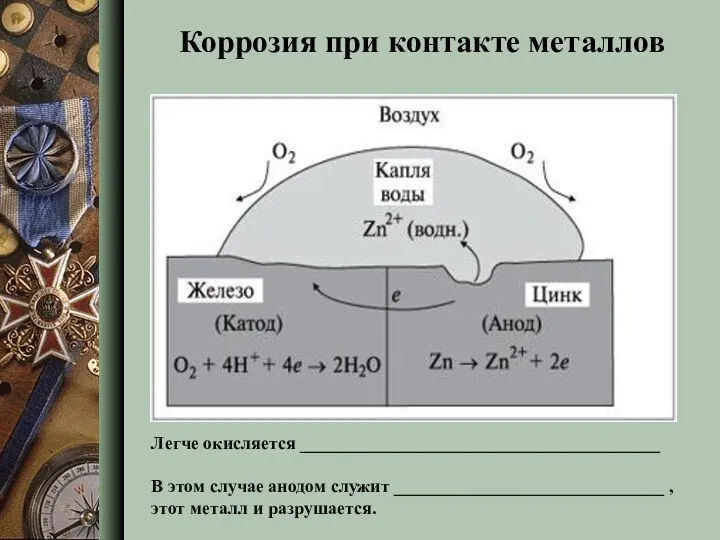
- 10. Коррозия при контакте металлов Легче окисляется _________________________________________ В этом случае анодом служит ______________________________ , этот металл
- 11. Легче окисляется ________________________________________ В этом случае анодом служит ______________________________ , этот металл и разрушается. Коррозия при
- 12. Защита от коррозии Изоляция металла от среды Изменение состава металла (сплава) Изменение среды
- 13. Барьерная защита - механическая изоляция поверхности при использовании поверхностных защитных покрытий : неметаллических (лаки, краски, смазки,
- 14. Изменение состава металла (сплава) Протекторная защита - добавление в материал покрытия порошковых металлов, создающих с металлом
- 15. Изменение состава металла (сплава) Введение в металл легирующих добавок: Cr, Ni, Ti, Mn, Mo, V, W
- 16. Пассивация поверхности Введение веществ, замедляющих коррозию (ингибиторов): для кислотной коррозии: азотсодержащие органические основания, альдегиды, белки, серосодержащие
- 17. Пассивация поверхности Удаление веществ, вызывающих коррозию – деаэрация: нагревание воды; пропускание воды через железные стружки; химическое
- 18. В III до нашей эры на острове Родос был построен маяк в виде огромной статуи Гелиоса.
- 19. 3. Поставьте опыты по коррозии железных гвоздей в «Фанте» и в растворе соды. Через неделю принесите
- 21. Скачать презентацию














 Химические свойства металлов
Химические свойства металлов Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? d-элементы
d-элементы Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Кислотные дожди
Кислотные дожди The Molecules of Life
The Molecules of Life Цинк и его соединения
Цинк и его соединения Фосфор и его соединения
Фосфор и его соединения Химия воды
Химия воды Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Классификация химических элементов
Классификация химических элементов Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7 НЮ 2.1.1. Металлы - общая характеристика
НЮ 2.1.1. Металлы - общая характеристика Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування Мінерали та гірські породи
Мінерали та гірські породи Серная кислота
Серная кислота Electrolysis
Electrolysis Вещества
Вещества Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Аминокислоты 2
Аминокислоты 2 Метаболизм углеводов
Метаболизм углеводов Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості