Содержание
- 3. Строение атомов металлов Внешний электронный уровень элементов, которые относят к металлам заполнен электронами менее чем наполовину
- 4. Строение простых веществ - металлов Часть атомов в кристаллической решетке ионизирована, т.е. потеряла электроны внешнего электронного
- 5. Физические свойства металлов металлы при н.у. находятся в твердом агрегатном состоянии, исключение – ртуть; все металлы
- 6. Химические свойства металлов Металлы в химических взаимодействиях могут только отдавать электроны, т.е. проявляют восстановительные свойства, на
- 9. 1. Окисляются неметаллами
- 10. 2. Окисляются ионами водорода в составе воды – металл должен находиться в ряду активности металлов до
- 11. 3. Окисляются ионами водорода в составе кислот
- 12. 4. Окисляются ионами металлов
- 13. Нахождение металлов в природе
- 14. Получение: восстановление металлов из их соединений Me+n + ne- → Me0 Mg + SnO2 → MgO
- 16. Скачать презентацию












 бензол
бензол Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Беймет алдар
Беймет алдар Классы неорганических веществ
Классы неорганических веществ Классификация и номенклатура неорганических веществ
Классификация и номенклатура неорганических веществ Эко-упаковка
Эко-упаковка IVA группа С, Si, Ge, Sn, Pb (подгруппа титана)
IVA группа С, Si, Ge, Sn, Pb (подгруппа титана) Закон сохранения массы вещества
Закон сохранения массы вещества Комплексні сполуки. Комплексоутворення в біологічних системах
Комплексні сполуки. Комплексоутворення в біологічних системах Влияние состава вещества на эффективность таяния льда и замерзания водных солевых растворов
Влияние состава вещества на эффективность таяния льда и замерзания водных солевых растворов Периодический закон Д.И. Менделеева. Строение атома. Химическая связь
Периодический закон Д.И. Менделеева. Строение атома. Химическая связь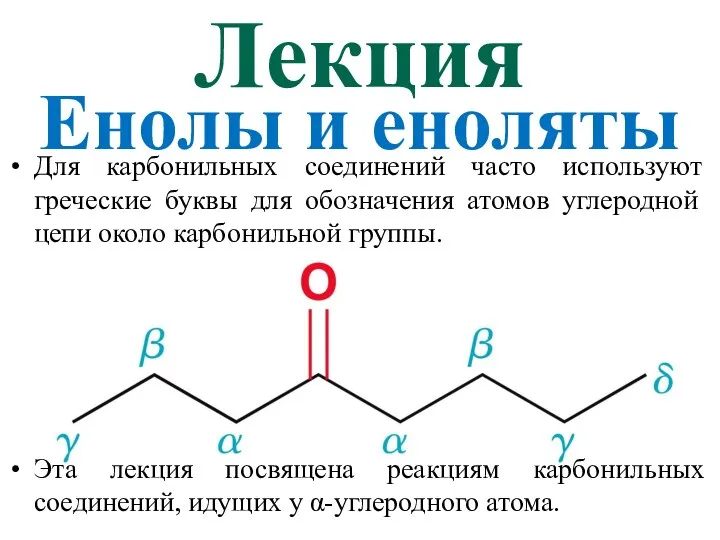 Енолы и еноляты
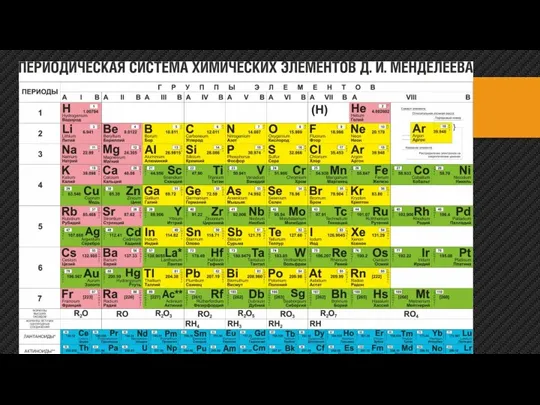
Енолы и еноляты Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Кислород. Общая характеристика и нахождение в природе. 8 класс
Кислород. Общая характеристика и нахождение в природе. 8 класс Гниение. Брожение
Гниение. Брожение Щелочноземельные металлы
Щелочноземельные металлы Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Химические элементы в организме человека
Химические элементы в организме человека Полімерні композиційні матеріали
Полімерні композиційні матеріали Белки. 9 класс
Белки. 9 класс Введение в органическую химию
Введение в органическую химию Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Задачи на смеси и сплавы. Метод Пирсона
Задачи на смеси и сплавы. Метод Пирсона Гигиена труда при работе с пестицидами и минеральными удобрениями
Гигиена труда при работе с пестицидами и минеральными удобрениями ГИДРОЛИЗ СОЛЕЙ 9 класс
ГИДРОЛИЗ СОЛЕЙ 9 класс Классификация химических реакций
Классификация химических реакций Химия. Отличие химических свойств от физических
Химия. Отличие химических свойств от физических