Содержание
- 2. Гидролиз (от греч. hydro – вода, lysis – разложение) означает разложение вещества водой.
- 3. 1. Гидролиз галогеналканов. С2Н5Сl + Н2О ⇄ С2Н5ОН + НСl 2. Гидролиз сложных эфиров. СН3-СОО-С2Н5 +
- 4. 4. Гидролиз жиров-сложных эфиров. Гидролиз органических веществ 5. Гидролиз полисахаридов. (С6Н10О5)n + nН2О → nС6Н12О6
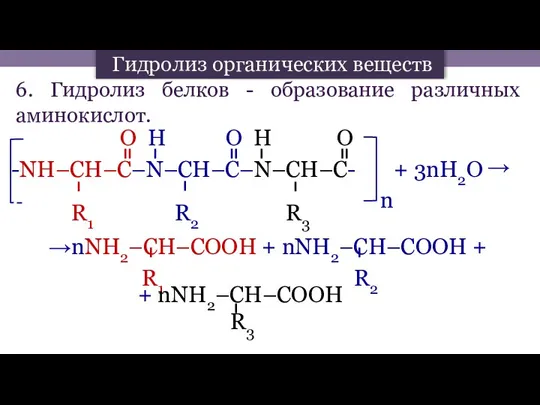
- 5. 6. Гидролиз белков - образование различных аминокислот. O H O H O -NH–CH–C–N–CH–C–N–CH–C- + 3nH2O R1
- 6. Диссоциация воды [H+]=[OH–] – среда нейтральная [H+] > [OH–] – среда кислая [H+] H2O H+ +
- 7. Соль Кислота Основание 4 типа солей: 1. Соли, образованные сильным основанием и слабой кислотой (КСN, CH3COONa).
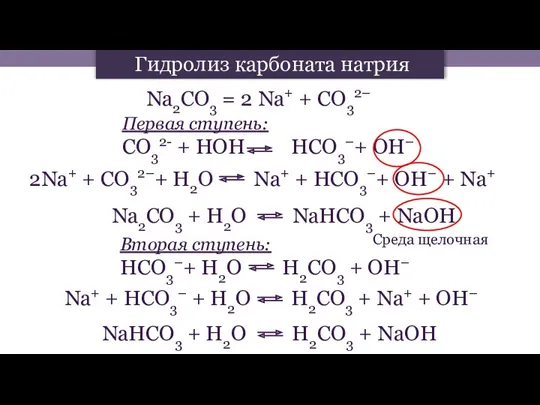
- 8. Первая ступень: СО32- + НОН НCO3–+ ОН– 2Nа+ + CO32–+ Н2О Nа+ + НCO3–+ ОН– +
- 9. Первая ступень: Al3++ HOH AlOH2+ + H+ Al3+ + 3Сl– + H2O AlOH 2++ 2Сl– +
- 10. NaCl = Na+ + Cl– HOH H+ + OH– Na+ + Cl– + НОН Na+ +
- 11. Гидролиз полный Слабый электролит Слабый электролит CH3COONH4 = NH4+ + CH3COO– NH4+ +HOH NH4OH + Н+
- 12. Гидролиз по аниону, если соль образована сильным основанием и слабой кислотой, среда щелочная, образуется кислая соль
- 13. Количественно гидролиз характеризуется безразмерной величиной α, называемой степенью гидролиза и показывающей, какая часть от общего количества
- 14. Анионы: F–> NO2– > CH3COO–> HCO3– > HS–>SO32– > >HPO42– > CO32– > S2– >SiO32– Катионы:
- 15. Добавить воды (разбавление раствора). Нагреть раствор (увеличится диссоциация воды). Связать один из продуктов гидролиза в труднорастворимое
- 16. Увеличить концентрацию растворённого вещества. Охладить раствор. Ввести в раствор один из продуктов гидролиза: подкислять (если рН
- 17. ВаCl2 – ZnSO4 – KF – NaBr – Na3PO4 – CuCl2 – Li2SO3 – нейтральная кислотная
- 18. 1. Na2SO3 2. MgSO4 3. LiCl Упражнение 2. Выразить сущность гидролиза солей, формулы которых:
- 19. ? В каком направлении будет протекать химическая реакция, если слить одинаковые объемы растворов двух солей, имеющих
- 20. Соль алюминия образована катионом очень слабого основания и, вследствие достаточно сильного гидролиза, имеет кислую среду раствора
- 21. катионы водорода Н+ взаимодействуют с анионами НCO3–: Н+ + НCO3– = Н2О + CО2↑ гидроксид-анионы ОН–
- 22. Уравнение реакции взаимодействия растворов двух солей с учетом их гидролиза в ионной форме Al3++ 3CO32–+ 3Н2О=
- 23. Некоторые соли полностью разлагаются водой, т.е. их гидролиз является необратимым процессом Fe2S3 + 6Н2О = 2Fe(ОН)3↓
- 24. К 50 г раствора карбоната натрия с массовой долей растворенного вещества 10,6% прилили избыток раствора сульфата
- 26. Скачать презентацию



![Диссоциация воды [H+]=[OH–] – среда нейтральная [H+] > [OH–] –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/614095/slide-5.jpg)

















 Хімічне виробництво сталі
Хімічне виробництво сталі Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения Химия в искусстве
Химия в искусстве Соли
Соли Кислородсодержащие соединения серы. Оксиды, кислоты, соли
Кислородсодержащие соединения серы. Оксиды, кислоты, соли Функциональные производные карбоновых кислот
Функциональные производные карбоновых кислот Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Своя игра по химии
Своя игра по химии Мыло. Мылящие вещества в природе
Мыло. Мылящие вещества в природе Золото. История открытия
Золото. История открытия Сера и её соединения
Сера и её соединения Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Рецепты литературы в химических опытах
Рецепты литературы в химических опытах Нуклеиновые кислоты
Нуклеиновые кислоты Горение топлива
Горение топлива Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Гравиметрический метод анализа
Гравиметрический метод анализа Растворы ВМС
Растворы ВМС Основы коррозии и защиты металлов. Химическая коррозия
Основы коррозии и защиты металлов. Химическая коррозия Алюминий және оның қосылыстары
Алюминий және оның қосылыстары АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері алкадиены
алкадиены Монокристаллы CdTe и твердые растворы на его основе. Свойства, получение, применение
Монокристаллы CdTe и твердые растворы на его основе. Свойства, получение, применение Транспортное обеспечение внесения удобрений
Транспортное обеспечение внесения удобрений Щелочные металлы
Щелочные металлы 20230816_belki_2
20230816_belki_2 Электроотрицательность. Степень окисления. Валентность
Электроотрицательность. Степень окисления. Валентность Основные понятия органической химии. Лекция № 1
Основные понятия органической химии. Лекция № 1