Содержание
- 2. КЛАССИФИКАЦИЯ ВМС ВМС – это вещества с М=104 – 106 моль/л. Макромолекулы состоят из повторяющихся звеньев
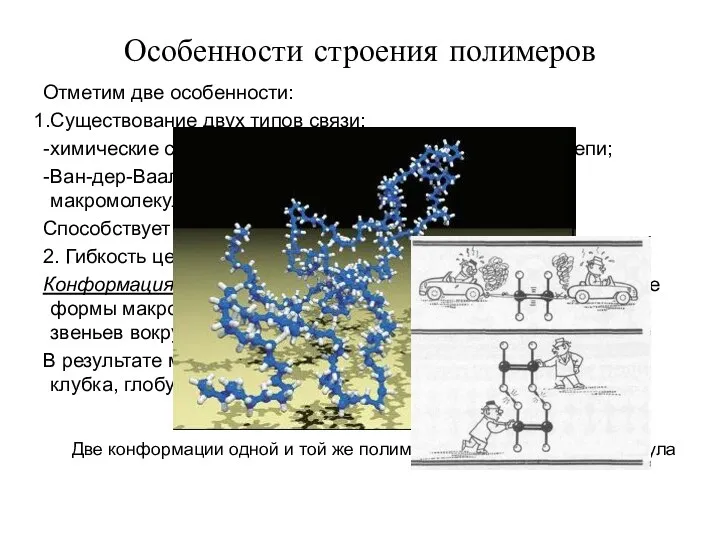
- 3. Особенности строения полимеров Отметим две особенности: Существование двух типов связи: химические связи, соединяющие атомы в полимерной
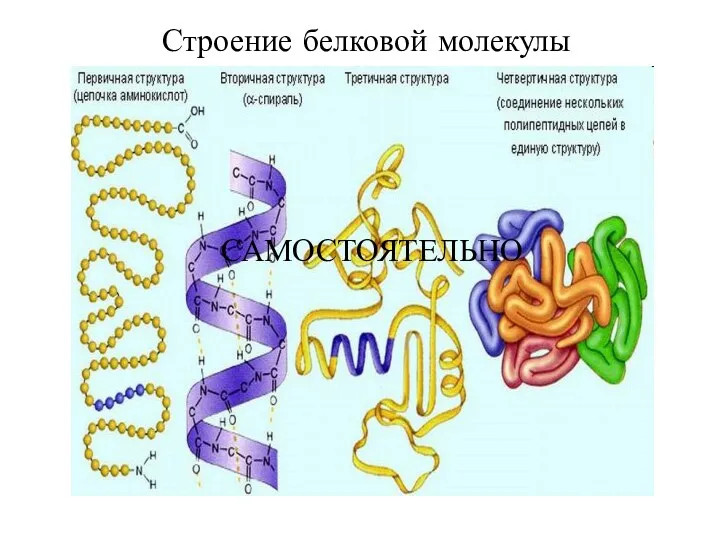
- 4. Строение белковой молекулы САМОСТОЯТЕЛЬНО
- 5. СВОЙСТВА ВМС Набухание и растворение. Осмотическое давление. Вязкость.
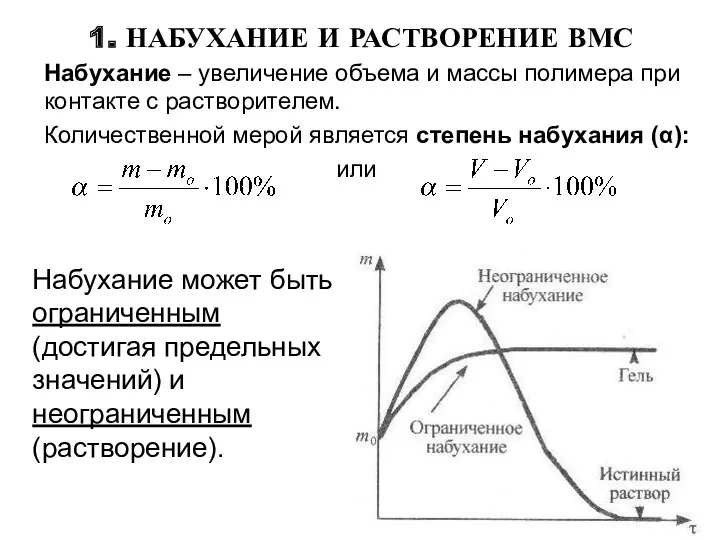
- 6. Набухание может быть ограниченным (достигая предельных значений) и неограниченным (растворение). 1. НАБУХАНИЕ И РАСТВОРЕНИЕ ВМС Набухание
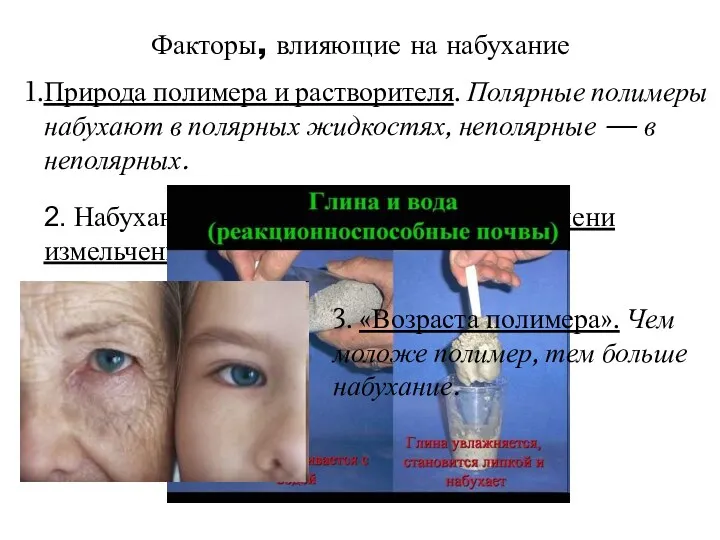
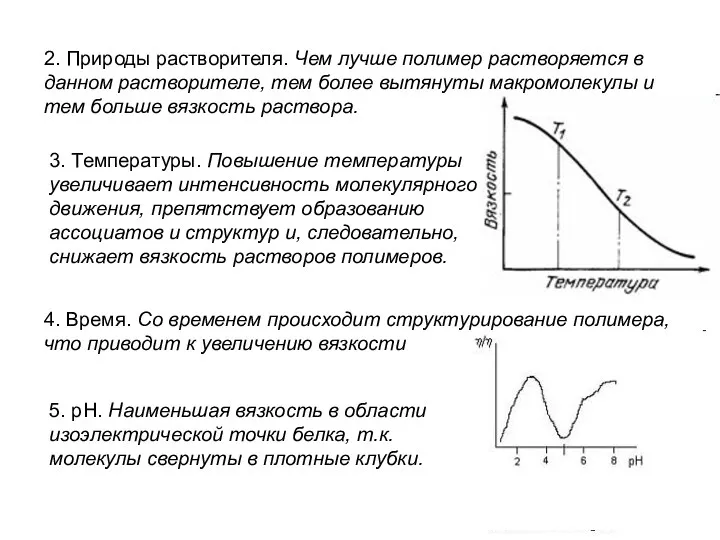
- 7. 2. Набухание зависит от температуры и степени измельченности - прямопропорционально. Факторы, влияющие на набухание Природа полимера
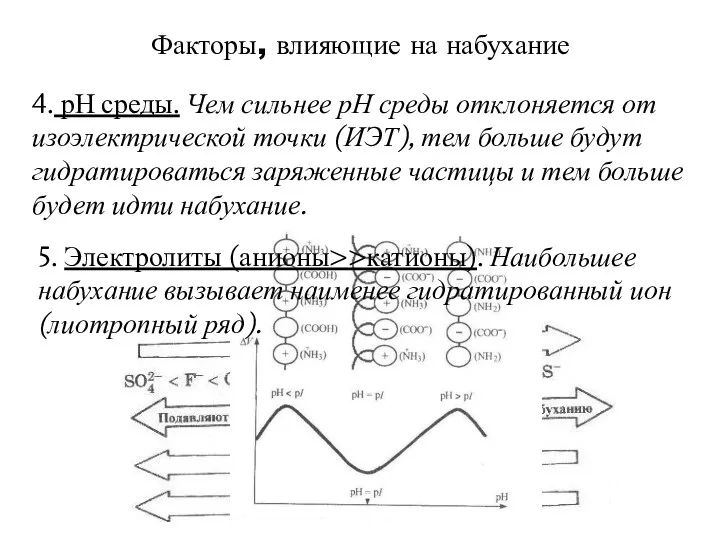
- 8. Факторы, влияющие на набухание 4. рН среды. Чем сильнее рН среды отклоняется от изоэлектрической точки (ИЭТ),
- 9. а/ сильное набухание коллоидов в период утробной жизни младенца и у детей младшего возраста обеспечивает интенсивный
- 10. 2. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ растворов ВМС Экспериментальное π для растворов ВМС значительно превышает вычисленное по закону Вант-Гоффа,
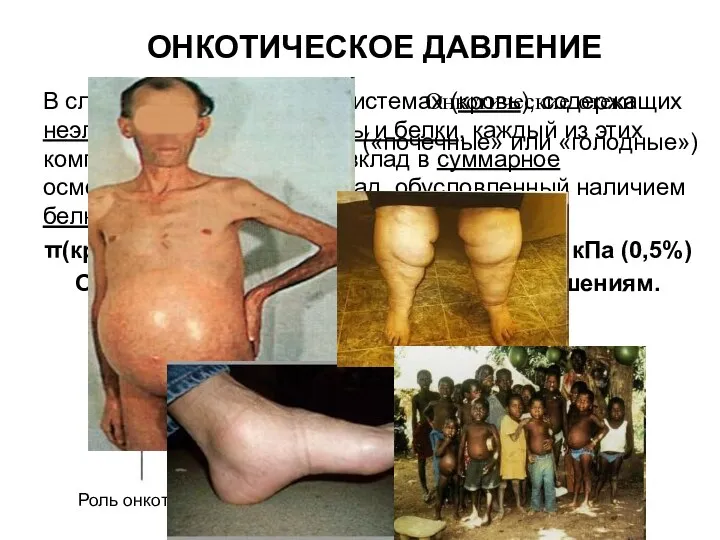
- 11. ОНКОТИЧЕСКОЕ ДАВЛЕНИЕ В сложных биологических системах (кровь), содержащих неэлектролиты, электролиты и белки, каждый из этих компонентов
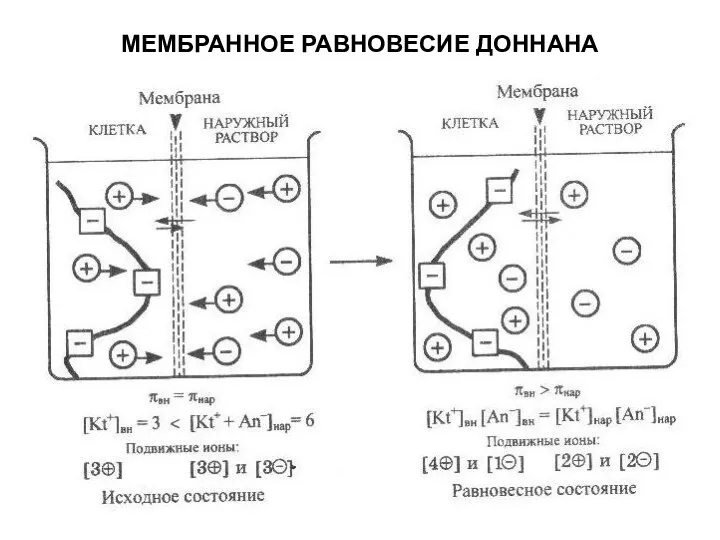
- 12. МЕМБРАННОЕ РАВНОВЕСИЕ ДОННАНА Наличие в клетке ионов белков, которые, в отличие от ионов обычных электролитов, не
- 13. МЕМБРАННОЕ РАВНОВЕСИЕ ДОННАНА
- 14. 3. ВЯЗКОСТЬ ВМС Зависит от: 1. Концентрации полимера. Высокая вязкость, даже при низкой концентрации, объясняется наличием
- 15. 2. Природы растворителя. Чем лучше полимер растворяется в данном растворителе, тем более вытянуты макромолекулы и тем
- 16. Нарушение устойчивости растворов ВМС Основным фактором устойчивости растворов ВМС является их высокая гидрофильность. В них гидратированы
- 17. Механизм процесса высаливания Осаждение белков проводится в мягких условиях без нарушения их нативной природы. После промывки
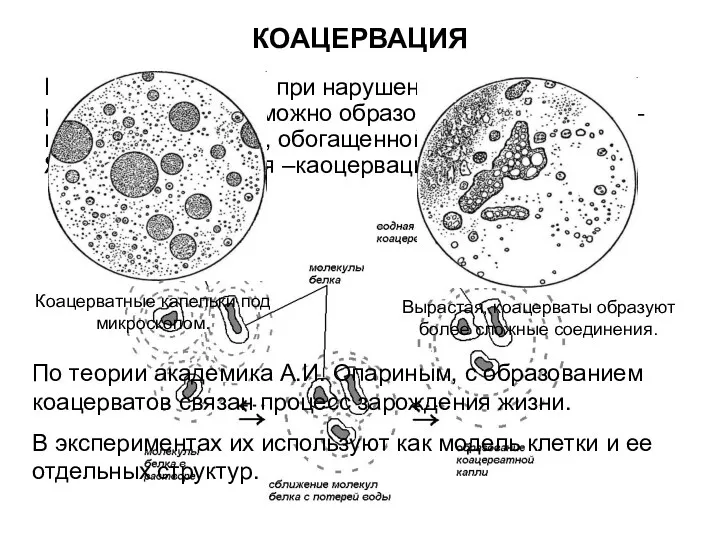
- 18. КОАЦЕРВАЦИЯ Кроме высаливания при нарушении устойчивости раствора белка возможно образование каоцервата – новой жидкой фазы, обогащенной
- 19. Структурообразование в растворах ВМС
- 20. К явлениям нарушения устойчивости коллоидов и полимеров относят и протекающие в них процессы структурообразования. Для наименования
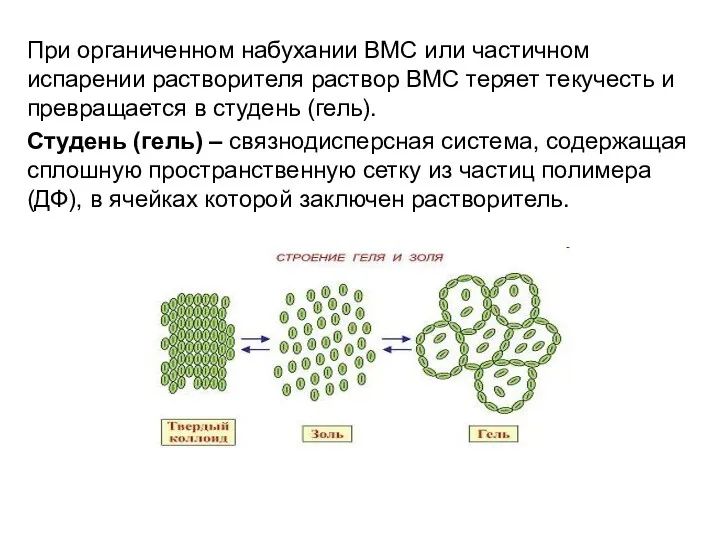
- 21. При органиченном набухании ВМС или частичном испарении растворителя раствор ВМС теряет текучесть и превращается в студень
- 22. Студнеобразование напоминает процесс коагуляции, но при коагуляции ДСи разделяется на две фазы – ДС и ДФ.
- 23. СВОЙСТВА ГЕЛЕЙ Многие студни (гели) под влиянием механических воздействий могут разжижаться и самопроизвольно восстанавливать свои свойства
- 25. Скачать презентацию











 Types of chemical bonds in crystals
Types of chemical bonds in crystals Индикаторные ошибки кислотно-основного титрования
Индикаторные ошибки кислотно-основного титрования Подгруппа азота
Подгруппа азота Материаловедение. Контрольная работа
Материаловедение. Контрольная работа Вода - розчинник. Урок 41
Вода - розчинник. Урок 41 Щелочные металлы
Щелочные металлы Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Тағам қоспалары
Тағам қоспалары Оксиды в минералогии
Оксиды в минералогии Классификация минералов по химическому принципу. Занятие 14
Классификация минералов по химическому принципу. Занятие 14 Закон сохранения массы вещества. Уравнения химических
Закон сохранения массы вещества. Уравнения химических Строение и свойства циклоалканов
Строение и свойства циклоалканов Кислород. Общая характеристика и нахождение в природе. 8 класс
Кислород. Общая характеристика и нахождение в природе. 8 класс Галогены
Галогены Алюминий и его соединения
Алюминий и его соединения Решение экспериментальных задач по теме Металлы и их соединения. Практическая работа №4
Решение экспериментальных задач по теме Металлы и их соединения. Практическая работа №4 Chemistry of Coordination Compounds
Chemistry of Coordination Compounds Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Знаки химических элементов. Химические формулы. Химический диктант
Знаки химических элементов. Химические формулы. Химический диктант kremniy
kremniy Соли, их классификация и свойства
Соли, их классификация и свойства Коллоидная химия
Коллоидная химия Тема 6-Альдегиды и кетоны
Тема 6-Альдегиды и кетоны Хімія і здоров'я людини
Хімія і здоров'я людини Особенности строения соединений органической химии. 10 класс
Особенности строения соединений органической химии. 10 класс Металлы главных подгрупп
Металлы главных подгрупп 20230419_soli
20230419_soli Агрегатные состояния вещества
Агрегатные состояния вещества