Содержание
- 2. Органическая химия. Классическое определение науки органической химии дал немецкий химик К.Шорлеммер более 150 лет назад. «Органическая
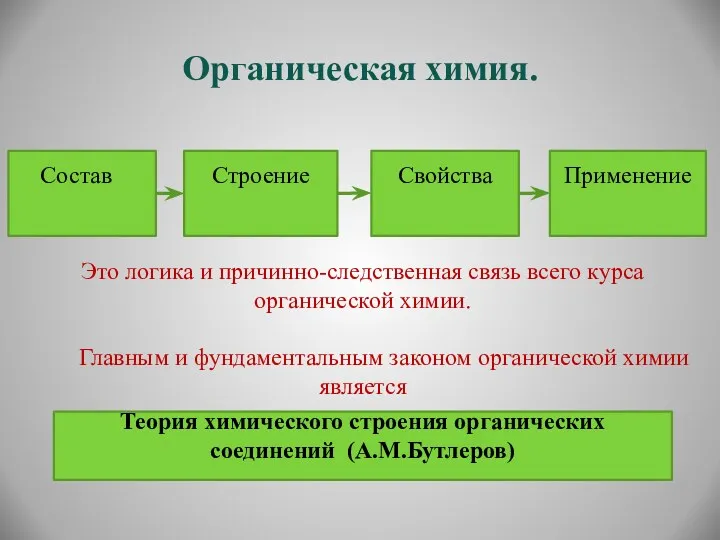
- 3. Органическая химия. Состав Строение Свойства Применение Это логика и причинно-следственная связь всего курса органической химии. Главным
- 4. Органическая химия. На сегодняшний день органическая химия – один из самых крупных и важных разделов химии.
- 5. Особенности строения соединений углерода. Специфика органических соединений: Углерод – единственный элемент ПСХЭ, атомы которого способны образовывать
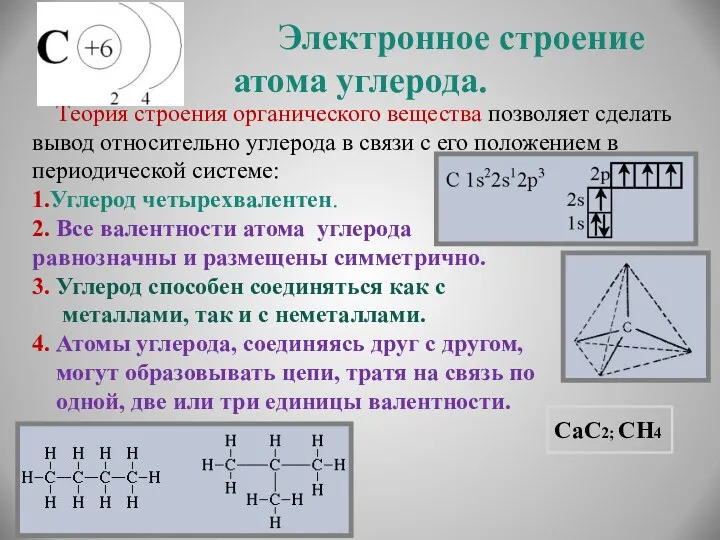
- 6. Электронное строение атома углерода. Теория строения органического вещества позволяет сделать вывод относительно углерода в связи с
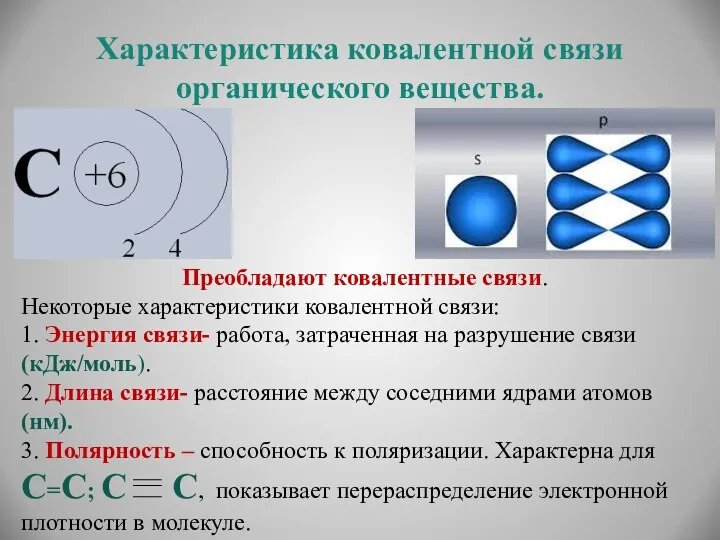
- 7. Характеристика ковалентной связи органического вещества. Преобладают ковалентные связи. Некоторые характеристики ковалентной связи: 1. Энергия связи- работа,
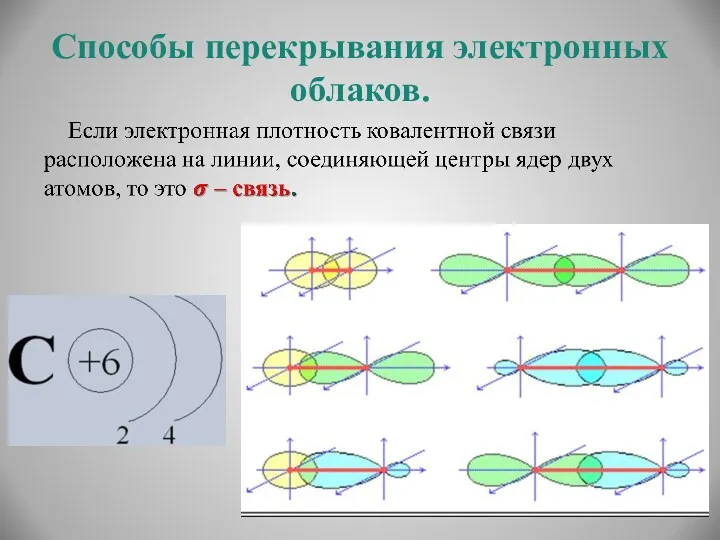
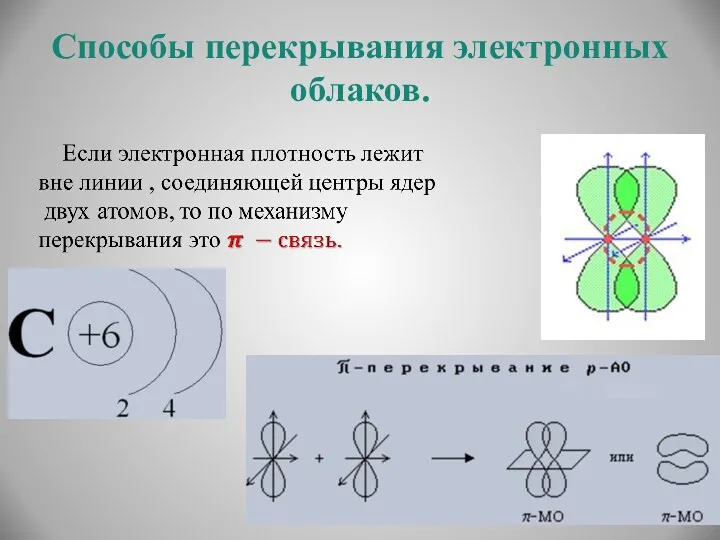
- 8. Способы перекрывания электронных облаков.
- 9. Способы перекрывания электронных облаков.
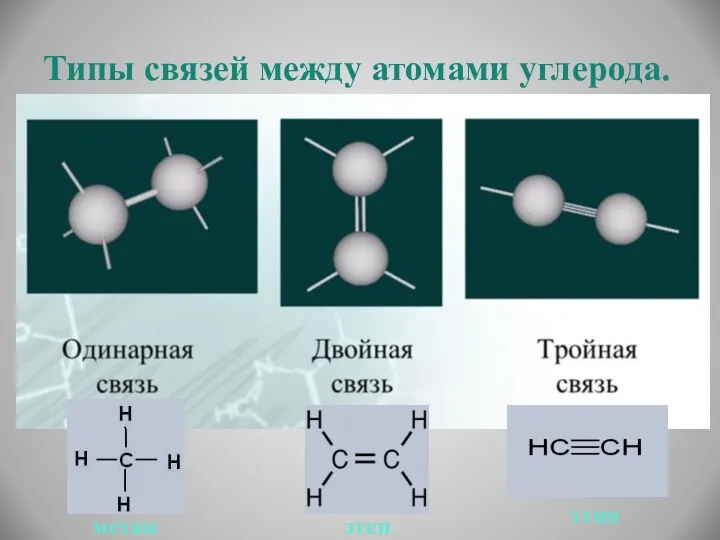
- 10. Типы связей между атомами углерода. метан этен этин
- 11. Способы разрыва ковалентной связи. Гомолитический (симметричный) – разрыв связи, при котором каждый атом получает по одному
- 12. Гибридизация атома углерода. Лайнус Карл Полинг (28.02.1901- 19.08.1994) Американский ученый. Первым успешно предсказал вторичную структуру белка.
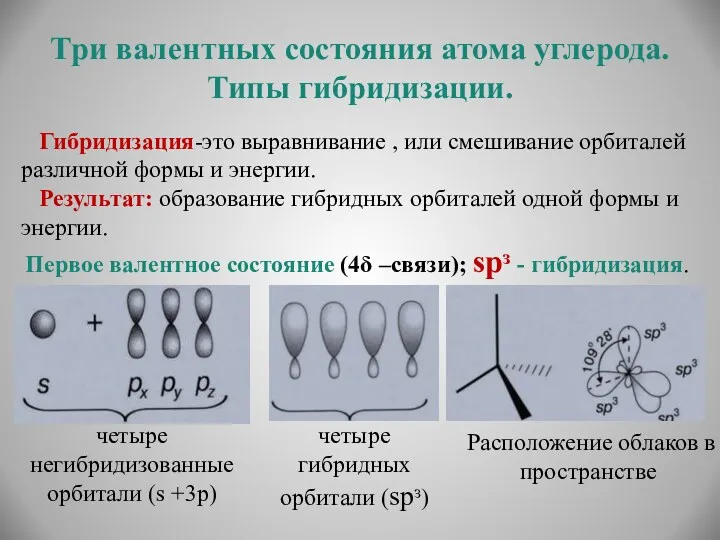
- 13. Три валентных состояния атома углерода. Типы гибридизации. Гибридизация-это выравнивание , или смешивание орбиталей различной формы и
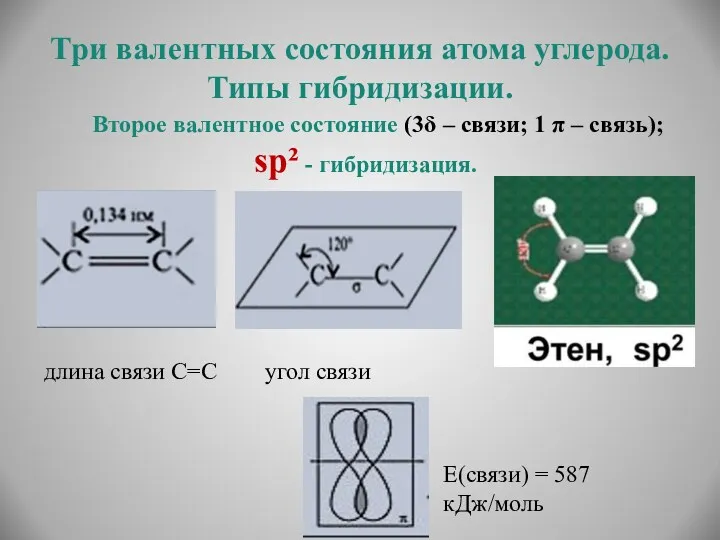
- 14. Три валентных состояния атома углерода. Типы гибридизации. Второе валентное состояние (3δ – связи; 1 π –
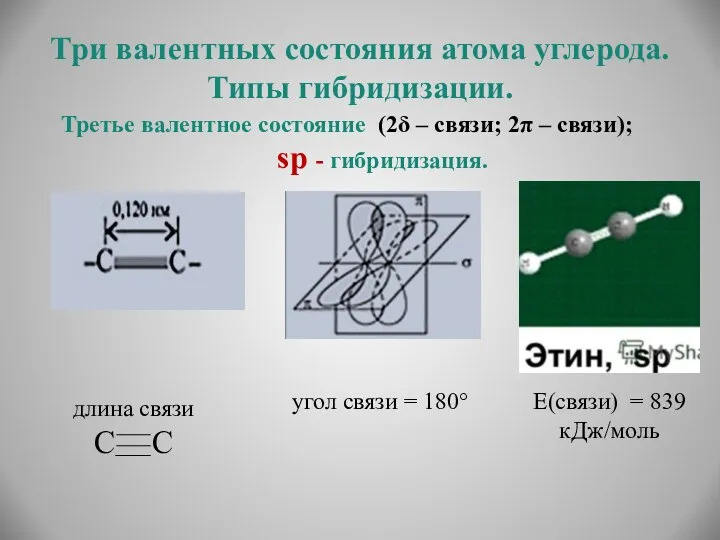
- 15. Три валентных состояния атома углерода. Типы гибридизации. Третье валентное состояние (2δ – связи; 2π – связи);
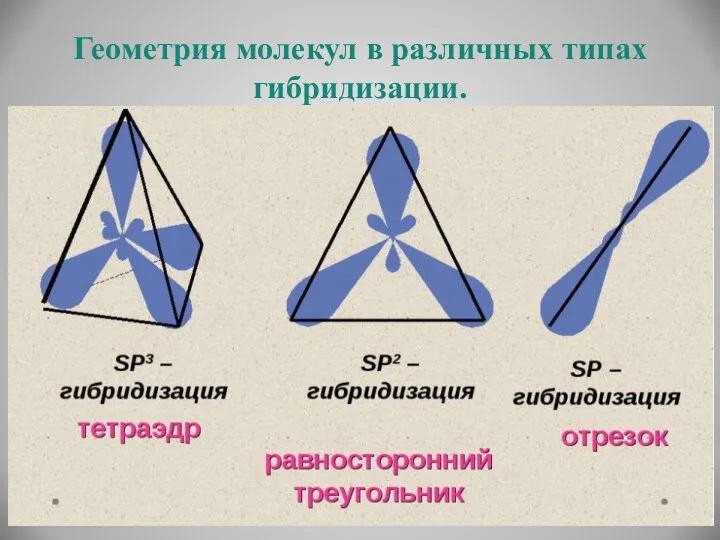
- 16. Геометрия молекул в различных типах гибридизации.
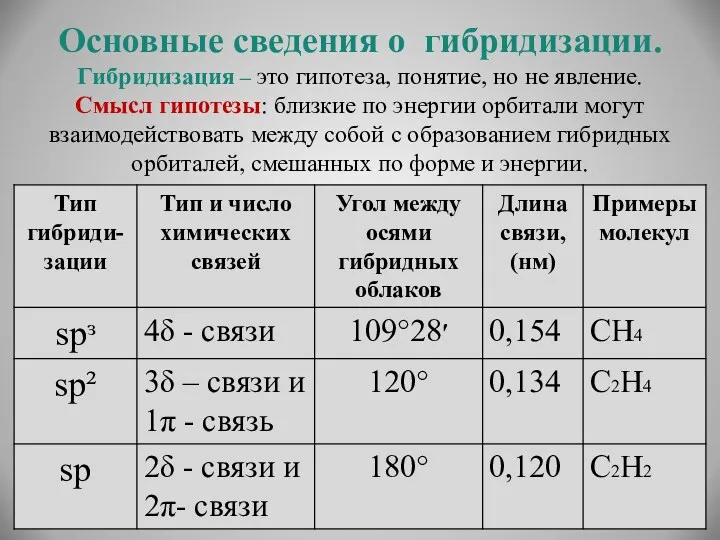
- 17. Основные сведения о гибридизации. Гибридизация – это гипотеза, понятие, но не явление. Смысл гипотезы: близкие по
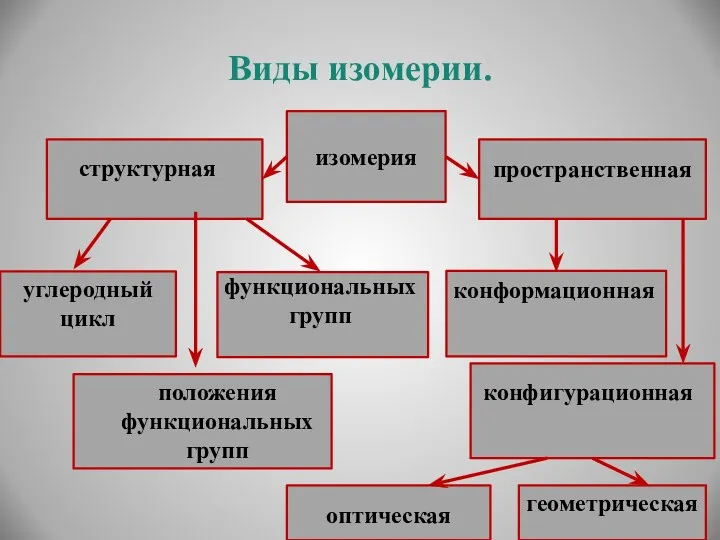
- 18. Виды изомерии. изомерия структурная пространственная углеродный цикл функциональных групп положения функциональных групп конфигурационная оптическая геометрическая конформационная
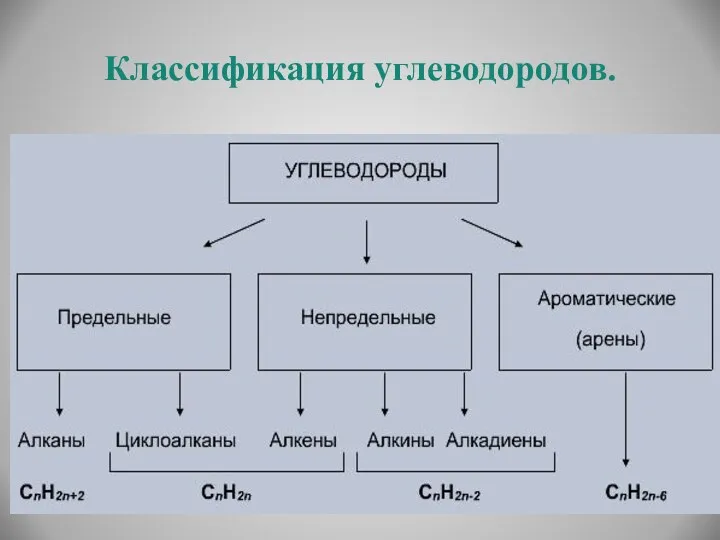
- 19. Классификация углеводородов.
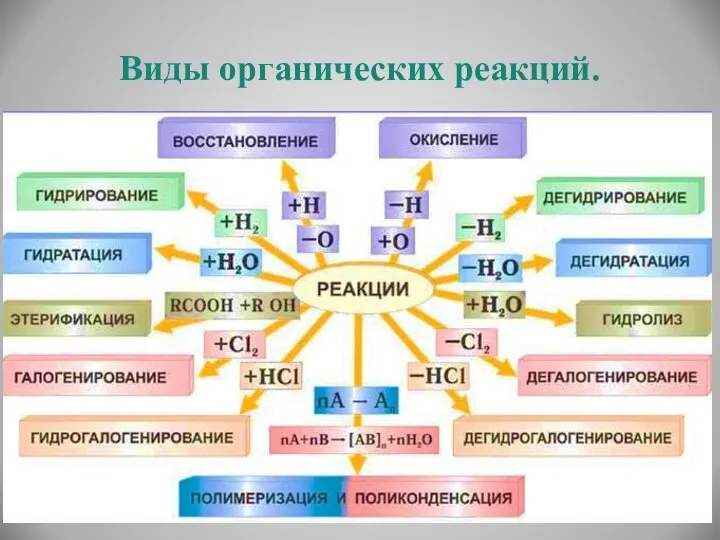
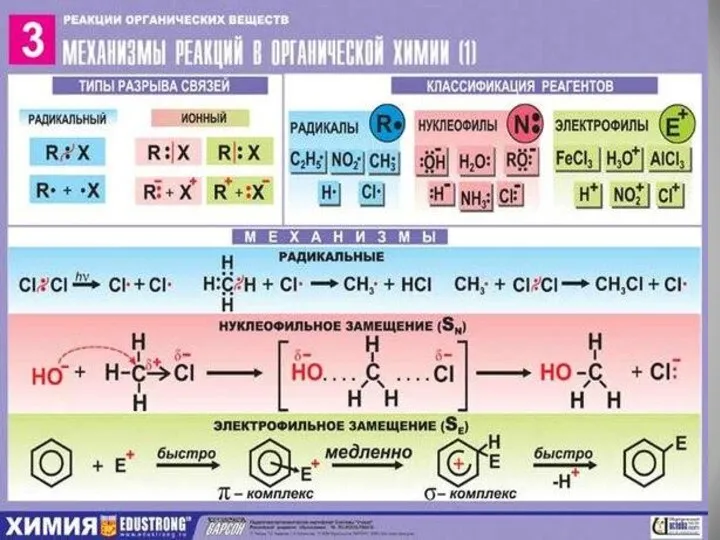
- 20. Виды органических реакций.
- 23. Скачать презентацию





 Валентность элементов. Определение валентности по формулам
Валентность элементов. Определение валентности по формулам Электролиз Урок для 11 класса
Электролиз Урок для 11 класса Двойной электрический слой. Теория Гельмгольца
Двойной электрический слой. Теория Гельмгольца Расчет процесса горения: состав горючей системы и расчет количества воздуха, необходимого для горения
Расчет процесса горения: состав горючей системы и расчет количества воздуха, необходимого для горения Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения
Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения Летучие яды. Токсичные газы
Летучие яды. Токсичные газы Минералдар
Минералдар Химическая кинетика
Химическая кинетика Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Гидролиз солей
Гидролиз солей Спирти. Загальні відомості про спирти
Спирти. Загальні відомості про спирти Силикат өнеркəсібі
Силикат өнеркəсібі Химические реакторы
Химические реакторы Закон Авогадро. Молярный объем газов
Закон Авогадро. Молярный объем газов Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Свойства воды
Свойства воды Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Химия и современный быт человека
Химия и современный быт человека Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Вещества. Чистые вещества. Смеси
Вещества. Чистые вещества. Смеси Углеводороды. Предельные (насыщенные) углеводороды
Углеводороды. Предельные (насыщенные) углеводороды Р-элементы IV А группы. Углерод и кремний
Р-элементы IV А группы. Углерод и кремний Химия в продуктах питания
Химия в продуктах питания Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе
Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе Синтез высокомолекулярных соединений
Синтез высокомолекулярных соединений Геохимия
Геохимия Проектная деятельность школьников в процессе обучения химии
Проектная деятельность школьников в процессе обучения химии