Слайд 2

ЦЕЛИ УРОКА:
ОЗНАКОМИТЬСЯ С О СТРОЕНИЕМ МОЛЕКУЛЫ ВОДЫ
РАССМОТРЕТЬ ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ
РАССМОТРЕТЬ ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
Слайд 3
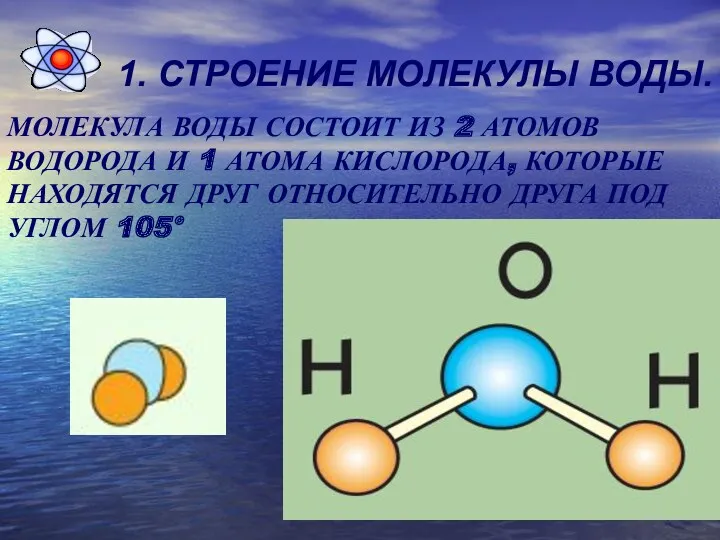
1. СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ.
МОЛЕКУЛА ВОДЫ СОСТОИТ ИЗ 2 АТОМОВ ВОДОРОДА И
1 АТОМА КИСЛОРОДА, КОТОРЫЕ НАХОДЯТСЯ ДРУГ ОТНОСИТЕЛЬНО ДРУГА ПОД УГЛОМ 105°
Слайд 4

2. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ.
ЧИСТАЯ (ДИСТИЛЛИРОВАННАЯ) ВОДА – БЕСЦВЕТНАЯ ЖИДКОСТЬ, БЕЗ
ЗАПАХА И ВКУСА
ЕДИНСТВЕННОЕ ВЕЩЕСТВО, КОТОРОЕ НА ЗЕМЛЕ СУЩЕСТВУЕТ В ТРЕХ АГРЕГАТНЫХ СОСТОЯНИЯХ
ТЕМПЕРАТУРА КИПЕНИЯ 100°С
ТЕМПЕРАТУРА КРИСТАЛЛИЗАЦИИ (ПЛАВЛЕНИЯ) 0°С
Слайд 5

В XVIII ВЕКЕ ВОДА ПОСЛУЖИЛА ЭТАЛОНОМ ДЛЯ ВЫБОРА ЕДИНИЦЫ МАССЫ:
МАССЕ 1 куб. см. БЫЛО ПРИПИСАНО ЗНАЧЕНИЕ 1г
МАКСИМАЛЬНАЯ ПЛОТНОСТЬ ПРИ 4°С ПРИНЯТА ЗА 1г/мл, ВСЕ ОСТАЛЬНЫЕ ВЕЩЕСТВА СРАВНИВАЮТСЯ ПО ПЛОТНОСТИ И МАССЕ С ВОДОЙ
ПЛОТНОСТЬ ЛЬДА МЕНЬШЕ, ЧЕМ У ЖИДКОЙ ВОДЫ, ЧТО ЯВЛЯЕТСЯ АНОМАЛЬНЫМ СВОЙСТВОМ ВОДЫ
ВОДА ОБЛАДАЕТ САМОЙ БОЛЬШОЙ ТЕПЛОЕМКОСТЬЮ
ОНА НЕ ПРОВОДИТ
ЭЛЕКТРИЧЕСКИЙ ТОК
Слайд 6

3. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ.
1. С МЕТАЛЛАМИ.
а) очень активные металлы при взаимодействии
с водой образуют гидроксид и водород
2Na + 2H2O = 2NaOH + H2
гидроксид натрия
2K + 2H2O = 2KOH + H2
гидроксид калия
Ca + 2H2O = Ca(OH)2 + H2
гидроксид кальция
Слайд 7

б) средние по активности металлы при взаимодействии с водой при нагревании
образуют оксид металла и водород
t
Zn + H2O = ZnO + H2
t оксид цинка
3Fe + 4H2O = Fe3O4 + 4H2
в) малоактивные металлы Cu, Hg, Ag, Pt, Au
с водой не реагируют
Слайд 8

2. С ОКСИДАМИ.
а) оксиды металлов при взаимодействии с водой образуют гидроксиды
CaO + H2O = Ca(OH)2
гидроксид кальция
б) оксиды неметаллов при взаимодействии с водой образуют кислоты
SO3 + H2O = H2SO4
серная кислота
Слайд 9

P2O5 + 3H2O = 2H3PO4
фосфорная кислота
Слайд 10
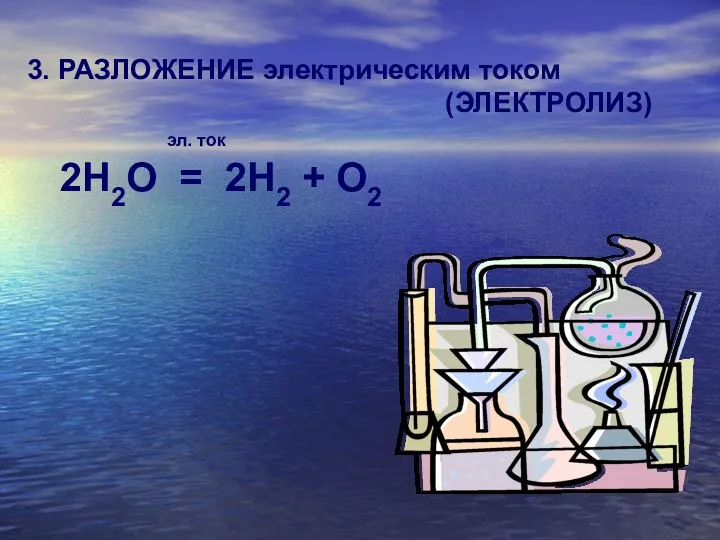
3. РАЗЛОЖЕНИЕ электрическим током
(ЭЛЕКТРОЛИЗ)
эл. ток
2H2O = 2H2
+ O2
Слайд 11

Допишите уравнения реакций
SO2 + H2O= Ca + H2O=
CrO3 + H2O=
Cu + H2O=
BaO + H2O= Li + H2O=
K2O + H2O= Ba + H2O=
Задача.
Вычислите массовую долю сахара в сиропе, если для его приготовления потребовалось 300г сахара и 1000г воды










 Ионоселективные электроды
Ионоселективные электроды Дисперсные системы. Дисперсное состояние вещества. Лекция 10
Дисперсные системы. Дисперсное состояние вещества. Лекция 10 Роль побутової хімії у житті
Роль побутової хімії у житті Мыло. Его состав и моющее действие. Синтетические моющие средства
Мыло. Его состав и моющее действие. Синтетические моющие средства Основні закони хімії.Класи та номенклатура неорганічних сполук
Основні закони хімії.Класи та номенклатура неорганічних сполук Медь и её сплавы
Медь и её сплавы Общая характеристика неметаллов
Общая характеристика неметаллов Химия - тұрмыста
Химия - тұрмыста Металдар арасындағы беттік керіліс
Металдар арасындағы беттік керіліс Теоретические аспекты
Теоретические аспекты Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Коррозия металлов
Коррозия металлов Кристаллические решётки и их виды
Кристаллические решётки и их виды Галогены. Положение в ПСХЭ Д.И. Менделеева
Галогены. Положение в ПСХЭ Д.И. Менделеева Серная кислота H2SO4
Серная кислота H2SO4 Аллотропия
Аллотропия Растворы. Процесс растворения
Растворы. Процесс растворения Общие свойства металлов
Общие свойства металлов Определение качества нефтепродуктов (на примере бензинов и дизельного топлива)
Определение качества нефтепродуктов (на примере бензинов и дизельного топлива) Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Задачник. Основные физические величины в химии
Задачник. Основные физические величины в химии Новое направление в бизнесе компании – катализаторы синтеза метанола
Новое направление в бизнесе компании – катализаторы синтеза метанола Сложноэфирная конденсация Кляйзена-Шмидта
Сложноэфирная конденсация Кляйзена-Шмидта Warm-Up
Warm-Up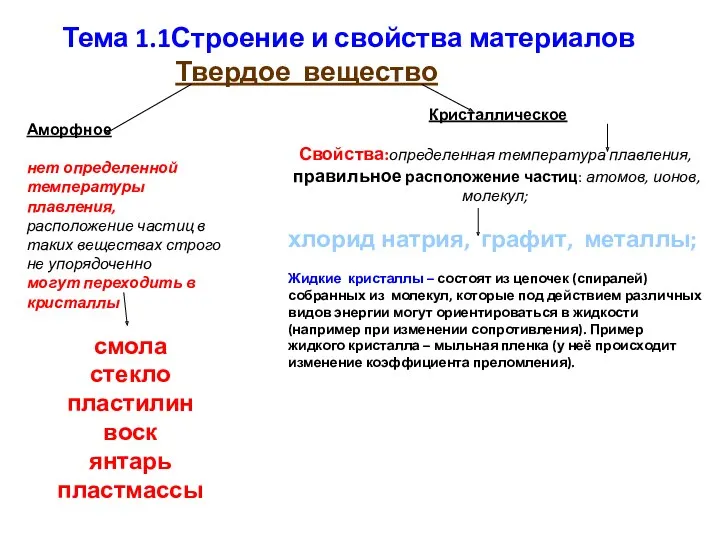 Строение и свойства материалов. Тема 1.1
Строение и свойства материалов. Тема 1.1