Содержание
- 2. Содержание: 1. Основные физические величины в химии. 2. Основные уравнения связи. 3. Правило пользования треугольником. 4.
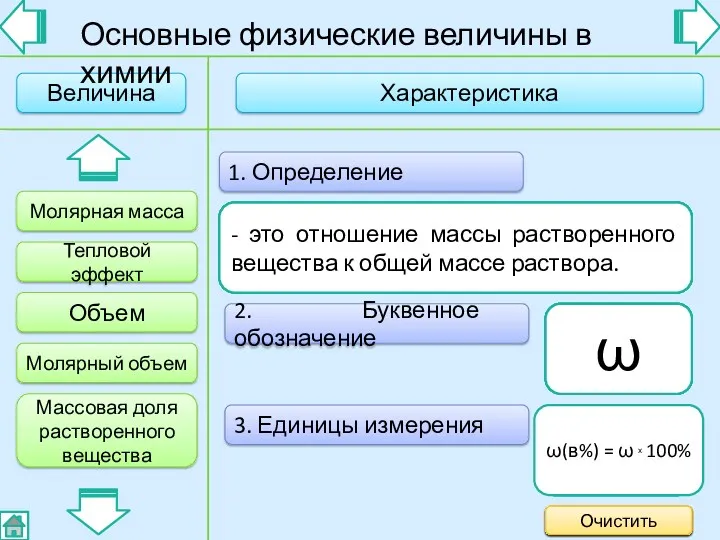
- 3. Основные физические величины в химии 2. Буквенное обозначение 3. Единицы измерения 1. Определение - это величина,
- 4. 2. Буквенное обозначение 3. Единицы измерения 1. Определение - это масса одного моля вещества. M г/моль
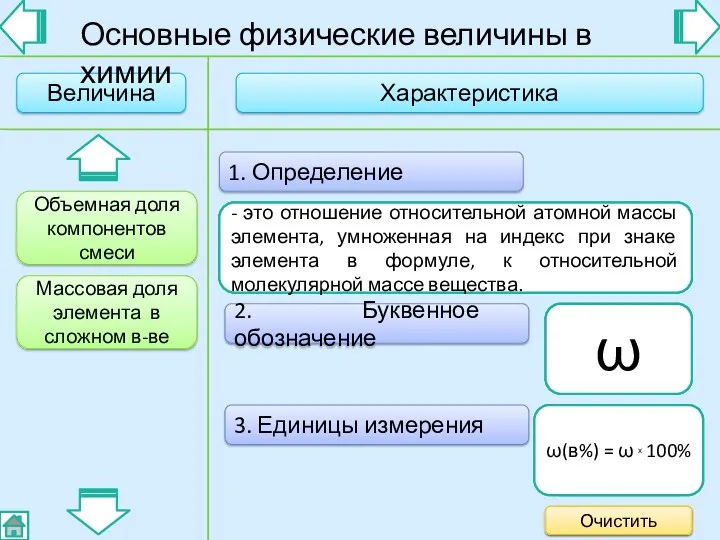
- 5. 2. Буквенное обозначение 3. Единицы измерения 1. Определение - это отношение объема компонента смеси к общему
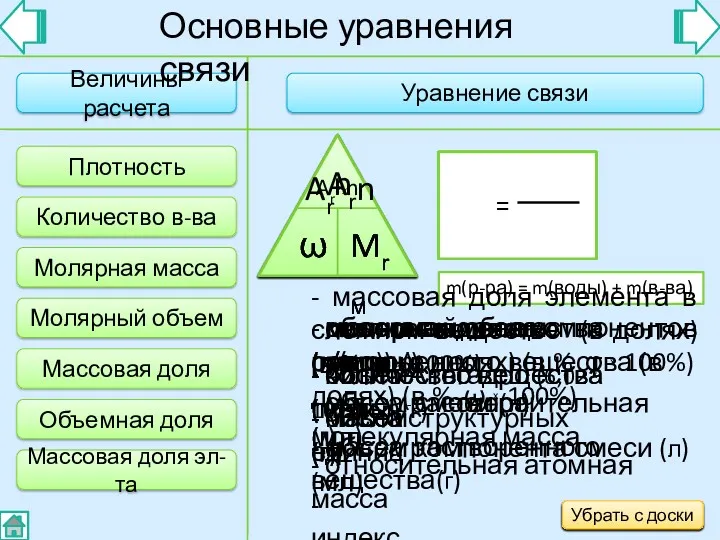
- 6. Величины расчета Уравнение связи Плотность ρ - плотность (г/мл) - объем (мл) - масса (г) V
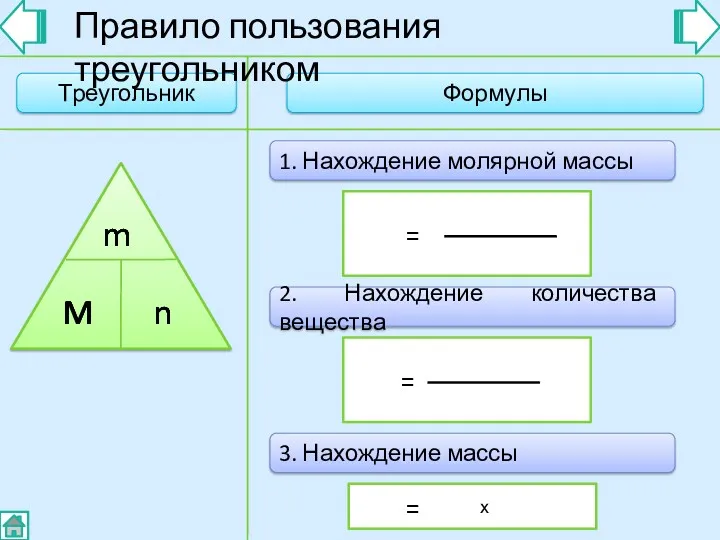
- 7. Треугольник Формулы M Правило пользования треугольником = 1. Нахождение молярной массы m n 2. Нахождение количества
- 8. Задача Найти: Решение: Рассчитайте объем водорода (н.у.), который потребуется для взаимодействия с 480 г оксида железа
- 9. Задача №1 Сборник задач и их решений. Сколько молекул содержится в 11 г углекислого газа СО2.
- 10. Сборник задач и их решений. Задача №8 Найдите массу азота, полученного из 280 л воздуха (н.у.),
- 11. Задача №1 Задачи по теме: «Количество вещества» Дано: Найти: Решение: 1 2 3 Ответ: Сколько молекул
- 12. Задача №2 Дано: Найти: Решение: 1 2 3 Ответ: Найдите массу 15 x 1023 молекул кислорода.
- 13. Задача №3 Дано: Найти: Решение: 1 2 3 Ответ: Найдите массу 33,6 л аммиака NH3 при
- 14. Задача №4 Дано: Найти: Решение: 1 2 Ответ: Найдите объем при н.у., который имеют 18 x
- 15. Задача №5 Дано: Найти: Решение: 1 2 Ответ: В 150 г воды растворили 50 г фосфорной
- 16. Задача №6 Дано: Найти: Решение: 1 2 Ответ: Сколько граммов воды и нитрата натрия нужно взять,
- 17. Задача №7 Дано: Найти: Решение: 1 Ответ: Сколько литров кислорода может быть получено из 800л жидкого
- 18. Задача №8 Дано: Найти: Решение: 1 2 3 Ответ: Найдите массу азота, полученного из 280 л
- 19. Найти: Расчеты по химическим уравнениям Дано: m(Al) =270г V(O2) - ? 1 4Al + 3O2 ?
- 20. Найти: Расчеты по химическим уравнениям Дано: mр-ра(HCl) =730г V(H2) - ? 1 Zn + 2HCl ?
- 22. Скачать презентацию














 Типичные окислители
Типичные окислители Количество вещества. 8 класс
Количество вещества. 8 класс Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Основания. Классификация оснований
Основания. Классификация оснований Водородный показатель
Водородный показатель Химические свойства металлов. Взаимодействие с простыми веществами
Химические свойства металлов. Взаимодействие с простыми веществами Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Использование технологии уровневой дифференциации на уроках химии
Использование технологии уровневой дифференциации на уроках химии Кристаллические решётки и их виды
Кристаллические решётки и их виды Алкалоиды, производные тропана
Алкалоиды, производные тропана Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров фосфор и его соединения
фосфор и его соединения Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Жидкое и растворимое стекло
Жидкое и растворимое стекло Основы химической термодинамики и кинетики химических реакций
Основы химической термодинамики и кинетики химических реакций O-alkylation catalysts
O-alkylation catalysts Электролитическая диссоциация
Электролитическая диссоциация Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Псевдоморфозы. Образование псевдоморфоз
Псевдоморфозы. Образование псевдоморфоз Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу
Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу Топырақ биоремедиациясы
Топырақ биоремедиациясы Равновесие в растворах электролитов
Равновесие в растворах электролитов Галогены. Свойства галогенов
Галогены. Свойства галогенов Ртуть
Ртуть Циклоалканы. 10 класс
Циклоалканы. 10 класс Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов