Содержание
- 2. Способность проводить электрический ток — одна из важнейших характеристик растворов веществ. Что такое электрический ток?
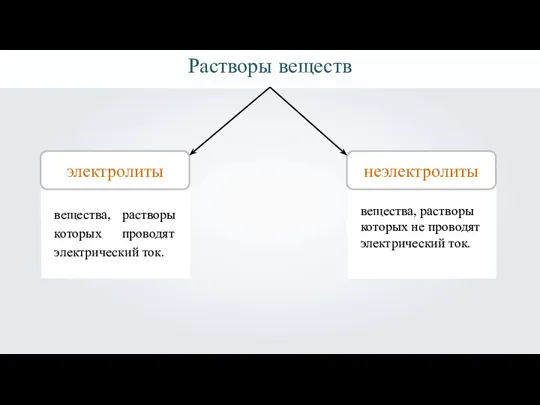
- 3. Растворы веществ электролиты 1 неэлектролиты вещества, растворы которых проводят электрический ток. вещества, растворы которых не проводят
- 4. Электролитическая диссоциация — процесс распада электролита на ионы.
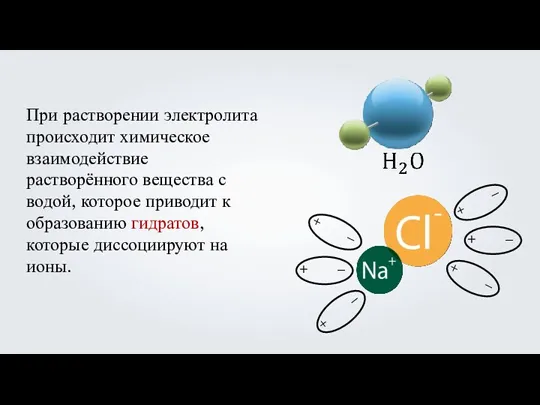
- 5. При растворении электролита происходит химическое взаимодействие растворённого вещества с водой, которое приводит к образованию гидратов, которые
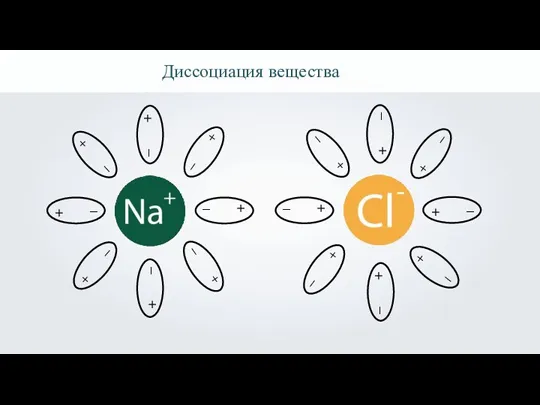
- 6. Диссоциация вещества
- 7. Диссоциация вещества
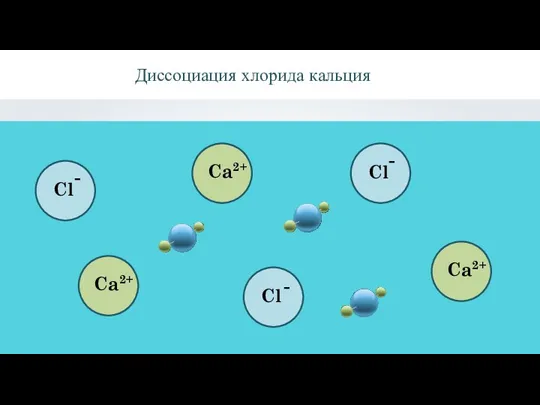
- 8. H2O CaCl2 хлорид кальция вода Диссоциация хлорида кальция
- 9. Диссоциация хлорида кальция - - -
- 10. Процессы при диссоциации веществ в воде 1. Ориентация двухполярных молекул воды около ионов кристалла. 2. Взаимодействие
- 11. CaCl2 = Ca2+ + 2Cl Уравнение диссоциации хлорида кальция Каждая частица хлорида кальция диссоциирует на катионы
- 12. Ассоциация — процесс, при котором хаотически движущиеся гидратированные ионы могут столкнуться и объединиться.
- 13. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. Основные положения теории электролитической
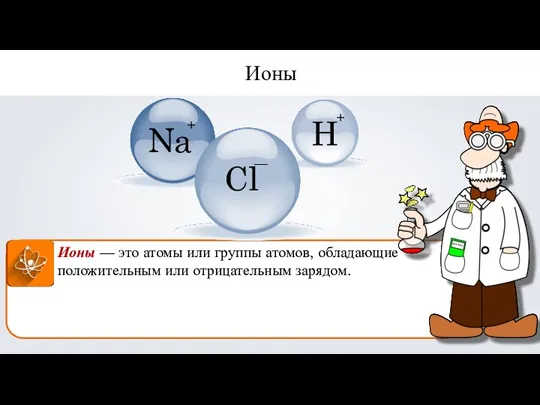
- 14. Ионы — это атомы или группы атомов, обладающие положительным или отрицательным зарядом. Ионы
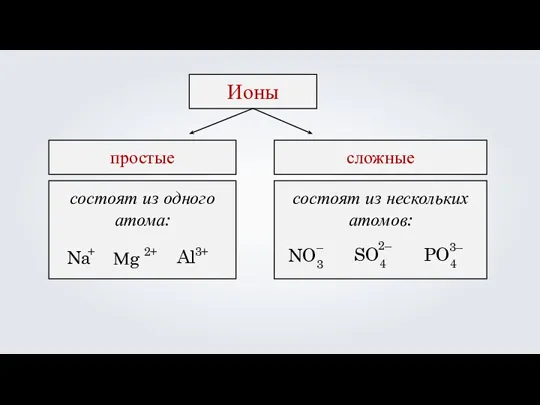
- 15. состоят из одного атома: Ионы простые сложные состоят из нескольких атомов:
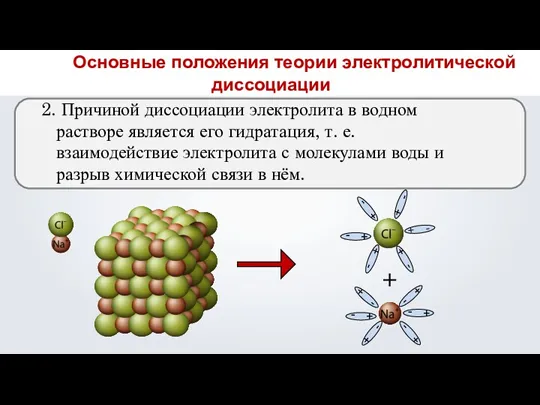
- 16. 2. Причиной диссоциации электролита в водном растворе является его гидратация, т. е. взаимодействие электролита с молекулами
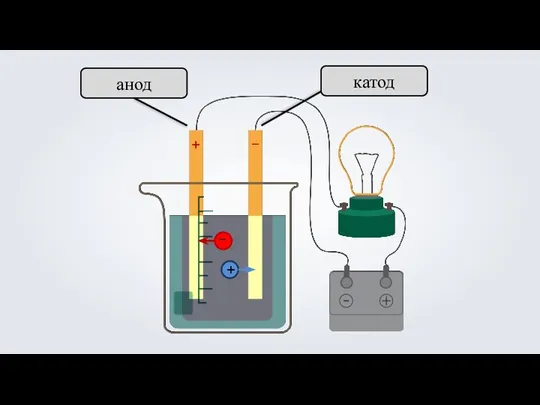
- 17. 3. Под действием электрического тока, положительно заряженные ионы движутся к отрицательно заряженному полюсу источника тока —
- 18. анод катод + –
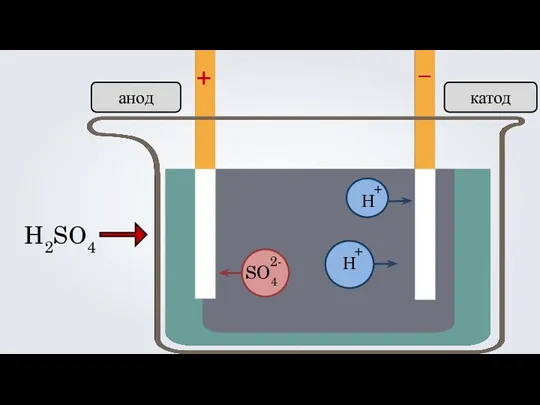
- 19. + – H2SO4 Н Н анод катод SO4 + + 2-
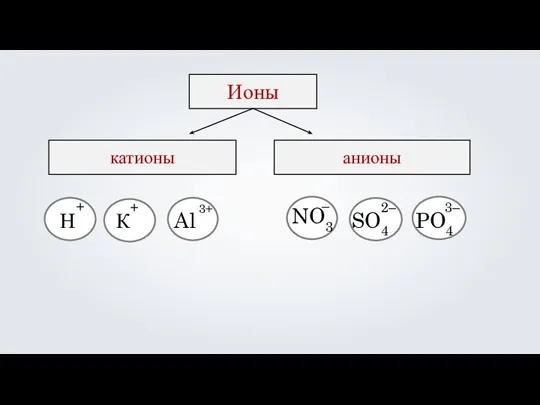
- 20. Ионы катионы анионы Н К Al NO3 – SO4 2– PO4 3– + + 3+
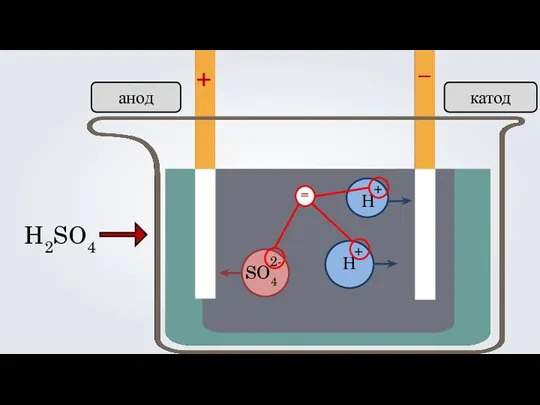
- 21. + – H2SO4 Н Н анод катод SO4 + + 2- =
- 22. 4. Электролитическая диссоциация — процесс обратимый для слабых электролитов. Н2СО3 2Н + СО3 + 2- Основные
- 23. Степень диссоциации (α) — это отношение количества вещества электролита, распавшегося на ионы (nД), к общему количеству
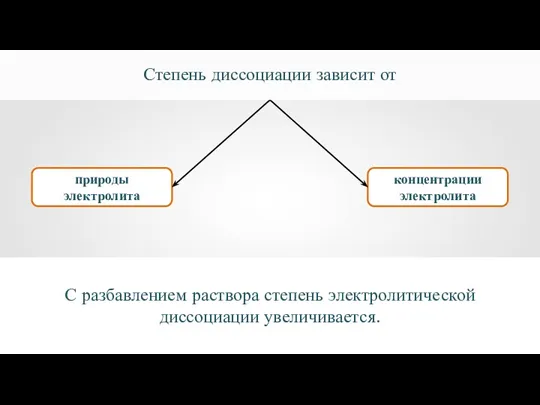
- 24. природы электролита концентрации электролита Степень диссоциации зависит от С разбавлением раствора степень электролитической диссоциации увеличивается.
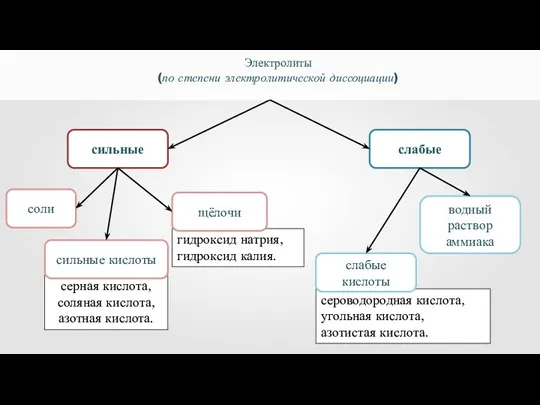
- 25. сильные слабые Электролиты (по степени электролитической диссоциации) соли гидроксид натрия, гидроксид калия. щёлочи водный раствор аммиака
- 27. Скачать презентацию











 Кристаллические решётки и их виды
Кристаллические решётки и их виды Enantioselective Total Synthesis
Enantioselective Total Synthesis Химические свойства солей
Химические свойства солей Закон постоянства состава. Молекулярная формула вещества
Закон постоянства состава. Молекулярная формула вещества Группа ультраосновных пород
Группа ультраосновных пород Строение атома
Строение атома Серная кислота
Серная кислота 20230419_izomery
20230419_izomery Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату kremniy
kremniy Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Типы химических реакций. Систематизация и обобщение знаний
Типы химических реакций. Систематизация и обобщение знаний Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Методы получения органических галогенидов
Методы получения органических галогенидов Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном
Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном Химия аминокислот. Лекция № 4
Химия аминокислот. Лекция № 4 Стратегия химической промышленности
Стратегия химической промышленности Вещества
Вещества Химия 20 века
Химия 20 века Газовые смеси
Газовые смеси Правила техники безопасности при работе в химическом кабинете
Правила техники безопасности при работе в химическом кабинете Формы парфюмерно-косметической продукции
Формы парфюмерно-косметической продукции Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Создание косметических средств
Создание косметических средств Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Металлы в природе. Способы получения металлов
Металлы в природе. Способы получения металлов