Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном презентация
Содержание
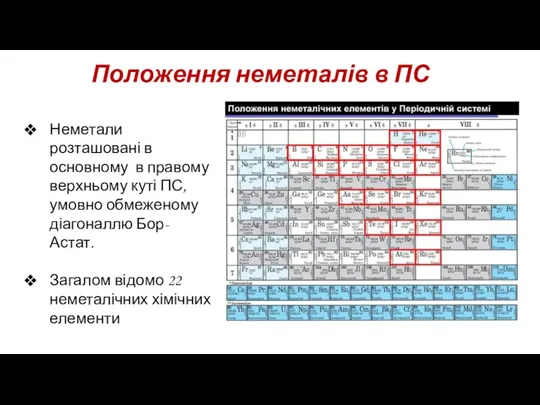
- 2. Положення неметалів в ПС Неметали розташовані в основному в правому верхньому куті ПС, умовно обмеженому діагоналлю
- 3. Особливості будови атомів неметалів Атоми неметалічних елементів на зовнішньому енергетичному рівні мають, як правило, від 4
- 4. Неметалічні властивості в ПС зростають зліва направо та знизу вгору. Чому? в періоді зі збільшенням зарядів
- 6. Загальні фізичні властивості неметалів За нормальних умов неметали — водень Н2, фтор F2, хлор Cl2, кисень
- 7. Загальні фізичні властивості неметалів Неметали не мають металічного блиску Неметали мають різний колір: йод — фіолетовий,
- 8. Що ж таке явище адсорбції? https://www.youtube.com/watch?v=cAyS8wabNas&ab_channel=%D0%95%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D1%96%D0%BA%D0%BD%D0%B8%D0%B3%D0%B8%22%D0%A0%D0%90%D0%9D%D0%9E%D0%9A%22
- 9. 1. Взаємодія неметалів з металами: а) Сu0 + Cl20 = Сu+2 Cl2-1 – купрум (ІІ) хлорид
- 10. 2. Взаємодія неметалів з неметалами: а) Cl20 + Р0 = Р +3Cl3-1 – фосфор (ІІІ) хлорид
- 11. 4. Взаємодія неметалів з воднем: а) Cl20 + H20 = H+1Cl−1 – гідроген хлорид Cl20 +
- 12. 1. Неметали, за винятком інертних газів, є досить хімічно активними простими речовинами, що взаємодіють із металами,
- 13. Утворення сполук неметалічних елементів з Гідрогеном
- 14. Загальна формула сполук елементів з Гідрогеном має два варіанти написання — НnЕ і ЕНn
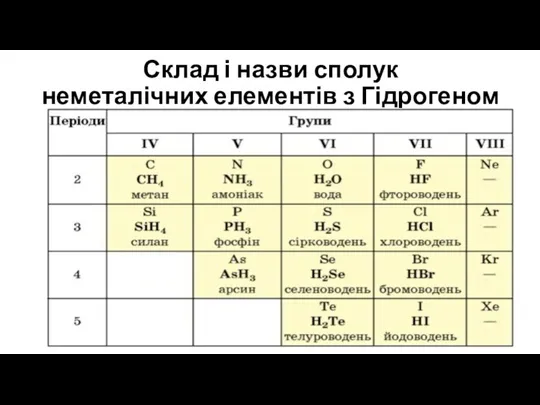
- 15. Склад і назви сполук неметалічних елементів з Гідрогеном
- 16. Методи одержання хлоридної кислоти 1. У лабораторії хлороводень добувають взаємодією кристалічного натрій хлориду з концентрованою сульфатною
- 17. Хімічні властивості хлоридної кислоти 1. Взаємодія з металами Хлоридна кислота взаємодіє з металами, що розміщені в
- 18. Хімічні властивості хлоридної кислоти 3. Взаємодія з основними і амфотерними гідроксидами Наприклад, при додаванні хлоридної кислоти
- 19. Хімічні властивості хлоридної кислоти 4. Взаємодія з солями слабких кислот Хлоридна кислота — сильний електроліт, тому
- 20. Хімічні властивості хлоридної кислоти 5. Взаємодія з амоніаком При додаванні хлоридної кислоти до амоніаку виділяється білий
- 21. Методи одержання аміаку У лабораторії амоніак добувають нагріванням суміші солей амонію з лугами. Найчастіше для цього
- 22. Хімічні властивості аміаку 1) Окиснення для молекули амоніаку є мало-характерним, оскільки молекула амоніаку стійка. а) На
- 23. Хімічні властивості аміаку 2) Для амоніаку характерні реакції приєднання з утворенням іона амонію. а) Взаємодія з
- 24. Методи одержання сірководню У лабораторії для добування сірководню використовують реакцію між сульфідом металічного елемента і хлоридною
- 25. Хімічні властивості сірководню Взаємодія сірководню з киснем. Сірководень горить блакитним полум’ям в атмосфері кисню або на
- 26. Хімічні властивості сірководню Сульфідна кислота реагує з основними оксидами, основами, солями з утворенням двох видів солей:
- 28. Скачать презентацию























 Основания. 8 класс
Основания. 8 класс Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Поняття про побутові хімікати
Поняття про побутові хімікати Цинковое покрытие
Цинковое покрытие Кремний и его соединения. Аллотропные модификации
Кремний и его соединения. Аллотропные модификации Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Группы сходных химических элементов
Группы сходных химических элементов Кислород
Кислород Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ
Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ Свойства фосфора
Свойства фосфора Бытовая химическая грамотность
Бытовая химическая грамотность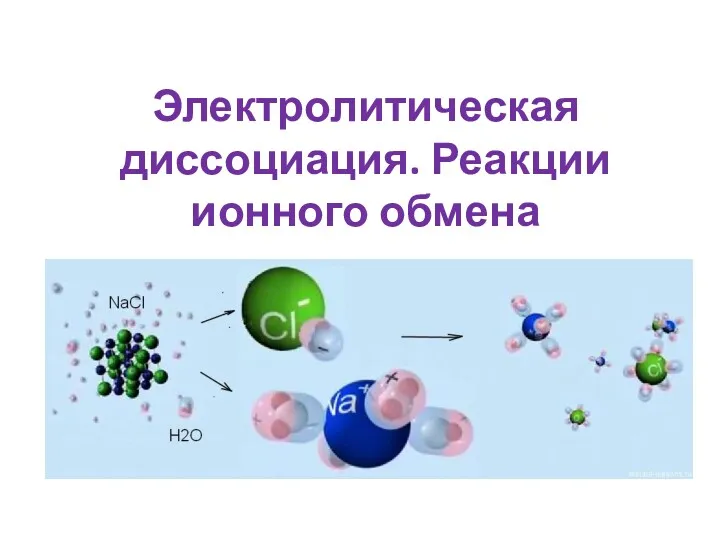 Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Алмазы. Бриллианты
Алмазы. Бриллианты Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Арены. Бензол
Арены. Бензол Камни и Скорпион
Камни и Скорпион Наноматериалы. Свойства наноматериалов. Особенности свойств
Наноматериалы. Свойства наноматериалов. Особенности свойств Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Reactors for catalytic alkylation
Reactors for catalytic alkylation Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы
Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы Домашнее задание по теме Химические свойства альдегидов, их получение
Домашнее задание по теме Химические свойства альдегидов, их получение Кинетика процессов твердофазного взаимодействия
Кинетика процессов твердофазного взаимодействия Тяжёлая вода
Тяжёлая вода Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) Двовимірний ямр. Приклади
Двовимірний ямр. Приклади Чистые вещества и смеси
Чистые вещества и смеси Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс Методы титрования. Перманганатометрия. (Лекция 24)
Методы титрования. Перманганатометрия. (Лекция 24)