Содержание
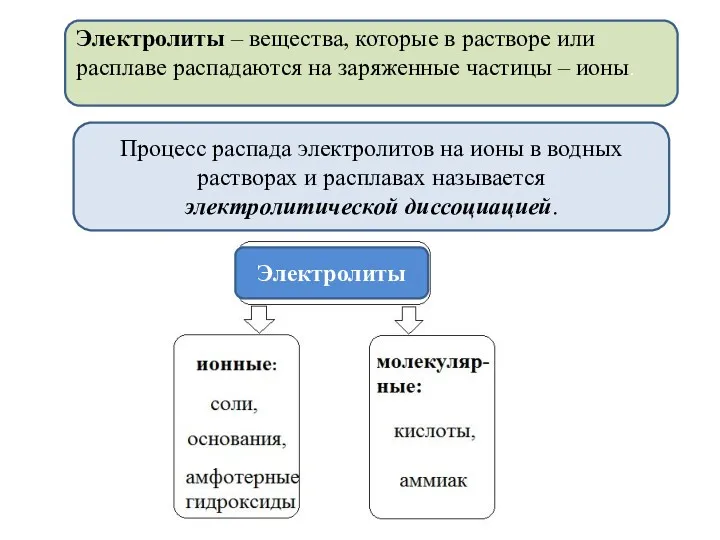
- 2. Электролиты – вещества, которые в растворе или расплаве распадаются на заряженные частицы – ионы. Процесс распада
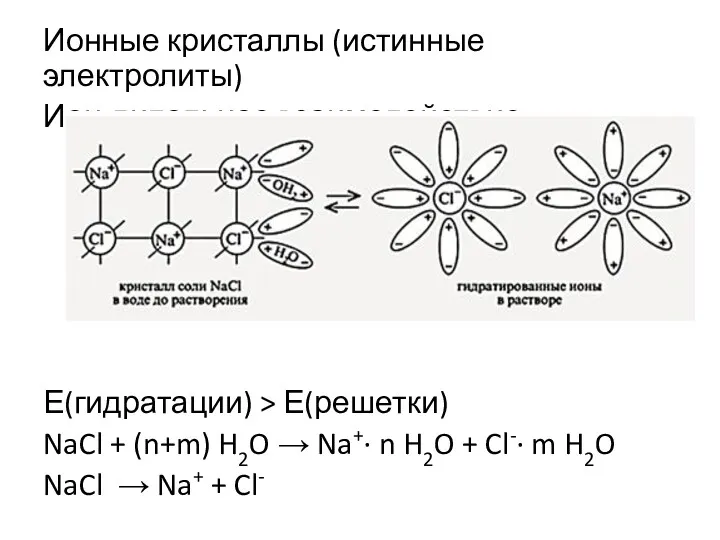
- 3. Ионные кристаллы (истинные электролиты) Ион-дипольное взаимодействие Е(гидратации) > Е(решетки) NaCl + (n+m) H2O → Na+· n
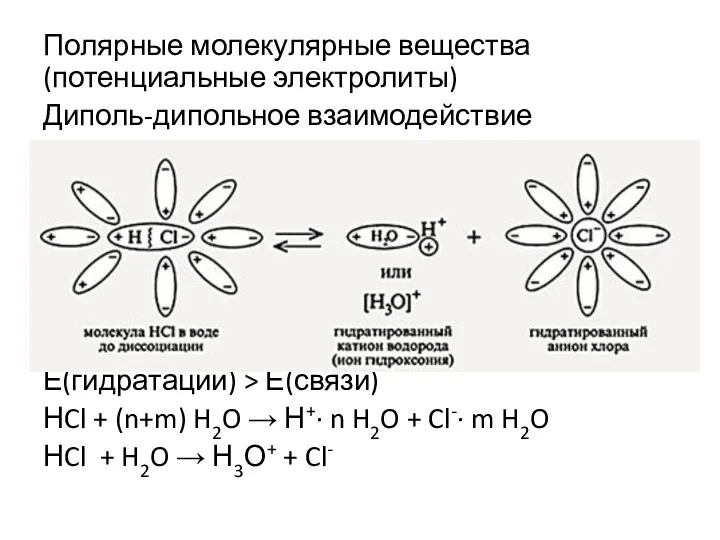
- 4. Полярные молекулярные вещества (потенциальные электролиты) Диполь-дипольное взаимодействие Е(гидратации) > Е(связи) НCl + (n+m) H2O → Н+·
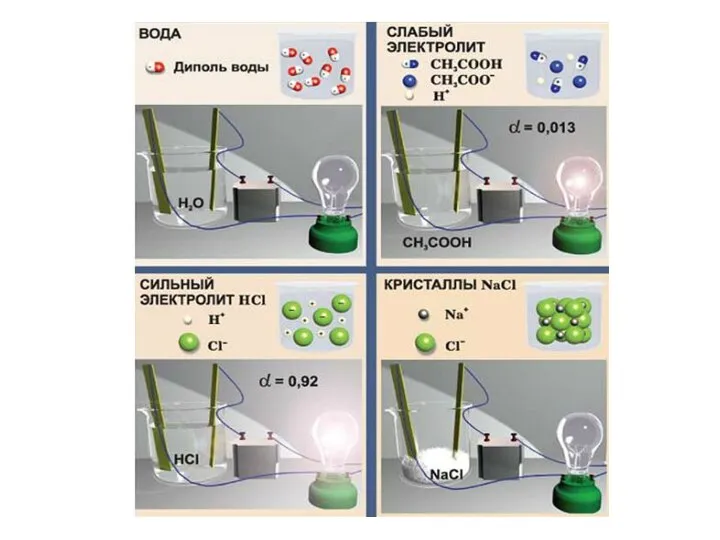
- 5. Для молекулярных электролитов Степень диссоциации (ионизации): Сильные электролиты: 1) соли; 2) щелочи – LiOH, NaOH, KOH,
- 7. Кислоты – электролиты, которые при диссоциации в качестве катионов образуют только ионы Н+ HCl → H+
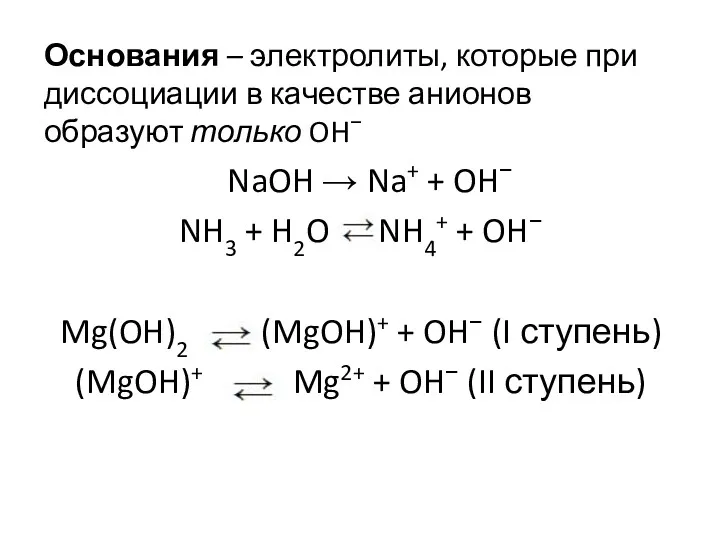
- 8. Основания – электролиты, которые при диссоциации в качестве анионов образуют только OH− NaOH → Na+ +
- 9. Амфотерные гидроксиды (амфолиты) – электролиты, которые могут диссоциировать как по кислотному, так и по основнóму типу
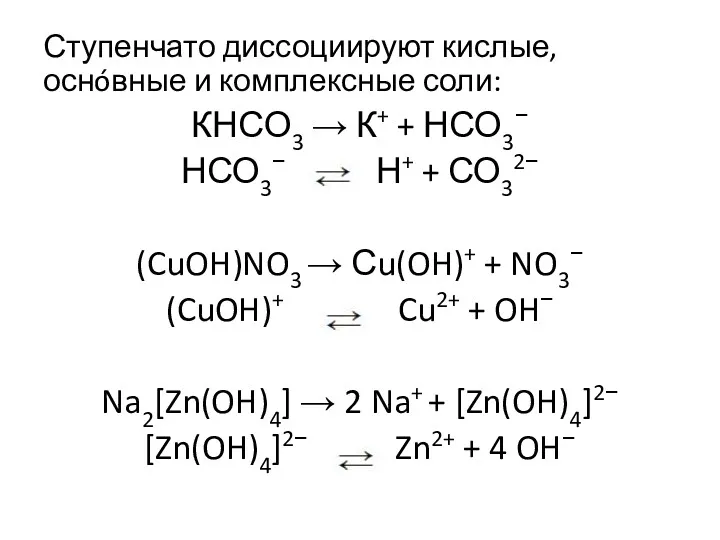
- 10. Ступенчато диссоциируют кислые, оснóвные и комплексные соли: КНСО3 → К+ + НСО3− НСО3− Н+ + СО32−
- 11. Средние, двойные и смешанные соли диссоциируют в одну стадию! CaCl2 → Ca2+ + 2Cl− Al2(SO4)3 →
- 12. Диссоциация воды H2O ↔ H+ + OH− [H+]·[OH−] = KW – константа автопротолиза KW = 10-14
- 13. При [H+]=[OH−] =10-7, рН = – lg10-7 =7 – нейтральная среда при [H+] > 10-7, рН
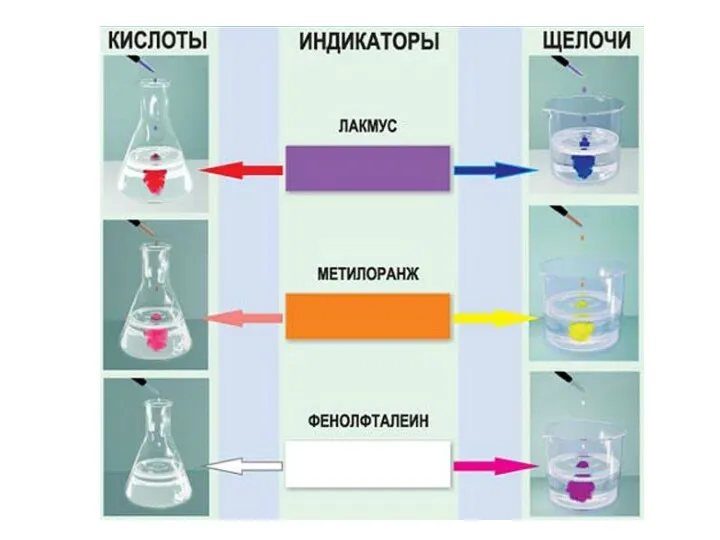
- 14. Окраска лакмуса:
- 15. Реакции ионного обмена В виде ионов записываются только сильные и растворимые в воде электролиты Реакции ионного
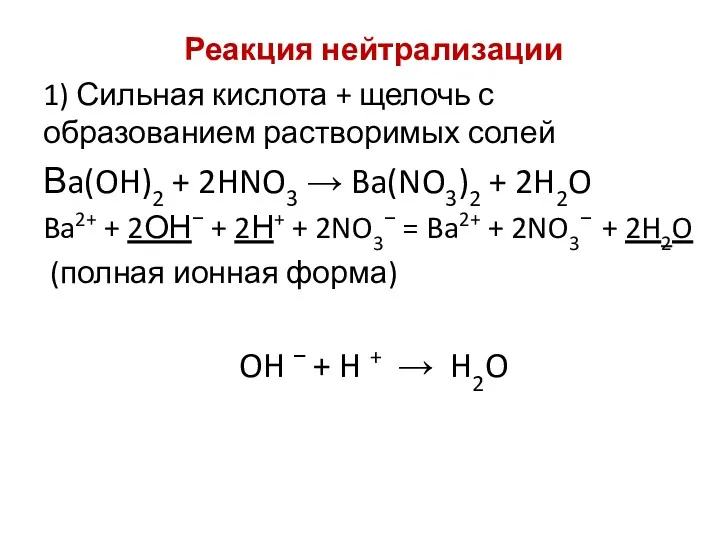
- 16. Реакция нейтрализации 1) Сильная кислота + щелочь с образованием растворимых солей Вa(OH)2 + 2HNO3 → Ba(NO3)2
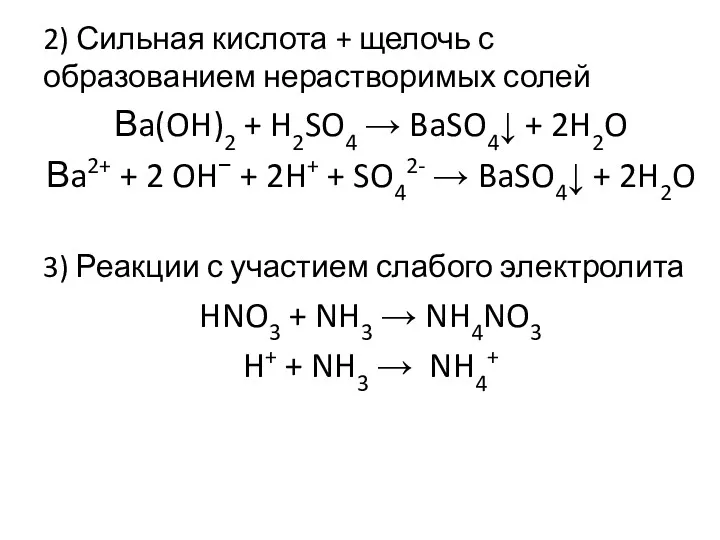
- 17. 2) Сильная кислота + щелочь с образованием нерастворимых солей Вa(OH)2 + H2SO4 → BaSO4↓ + 2H2O
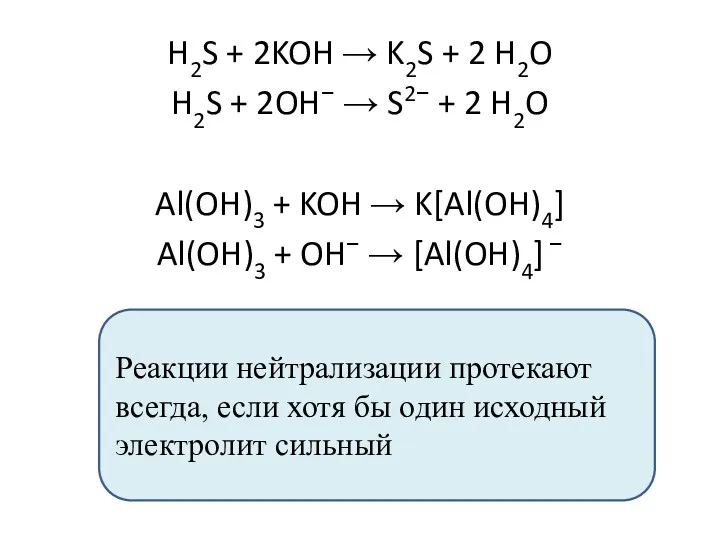
- 18. H2S + 2KOH → K2S + 2 H2O H2S + 2OH− → S2− + 2 H2O
- 19. 4) H2S + 2NH3 → (NH4)2S H2S + 2NH3 → 2NH4+ + S2− Mg(OH)2 + 2HF
- 20. 5) Неполная нейтрализация в избытке кислоты: H2SО4 + KOH → KНSО4 + H2O 2H+ + SО42−
- 21. Гидролиз солей Не подвергаются гидролизу соли: Образованные только сильными электролитами (NaCl, KNO3, RbBr, Cs2SO4, KClO3 и
- 22. 1) Соль, образованная сильным основанием и слабой кислотой - гидролиз ПО АНИОНУ K3PO4 – соль, образованная
- 23. 2) Соль, образованная слабым основанием и сильной кислотой - гидролиз ПО КАТИОНУ CuCl2 – соль, образованная
- 24. 3) Соль, образованная слабым основанием и слабой кислотой - гидролиз ПО КАТИОНУ И ПО АНИОНУ Гидролизуются
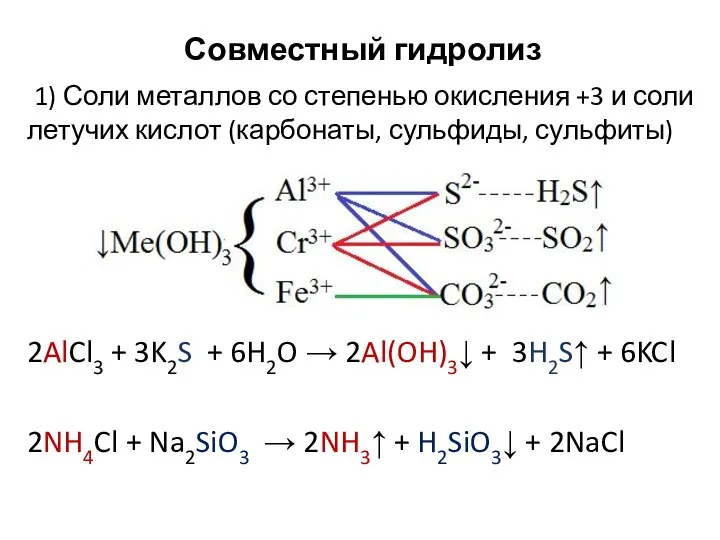
- 25. Совместный гидролиз 1) Соли металлов со степенью окисления +3 и соли летучих кислот (карбонаты, сульфиды, сульфиты)
- 26. 2) Соли металлов со степенью окисления +2 (кроме кальция, стронция и бария) и растворимые карбонаты -
- 28. Скачать презентацию




![Диссоциация воды H2O ↔ H+ + OH− [H+]·[OH−] = KW](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/286134/slide-11.jpg)
![При [H+]=[OH−] =10-7, рН = – lg10-7 =7 – нейтральная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/286134/slide-12.jpg)








 Кристаллические решётки и их виды
Кристаллические решётки и их виды Enantioselective Total Synthesis
Enantioselective Total Synthesis Химические свойства солей
Химические свойства солей Закон постоянства состава. Молекулярная формула вещества
Закон постоянства состава. Молекулярная формула вещества Группа ультраосновных пород
Группа ультраосновных пород Строение атома
Строение атома Серная кислота
Серная кислота 20230419_izomery
20230419_izomery Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату kremniy
kremniy Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Типы химических реакций. Систематизация и обобщение знаний
Типы химических реакций. Систематизация и обобщение знаний Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Методы получения органических галогенидов
Методы получения органических галогенидов Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном
Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном Химия аминокислот. Лекция № 4
Химия аминокислот. Лекция № 4 Стратегия химической промышленности
Стратегия химической промышленности Вещества
Вещества Химия 20 века
Химия 20 века Газовые смеси
Газовые смеси Правила техники безопасности при работе в химическом кабинете
Правила техники безопасности при работе в химическом кабинете Формы парфюмерно-косметической продукции
Формы парфюмерно-косметической продукции Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Создание косметических средств
Создание косметических средств Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Металлы в природе. Способы получения металлов
Металлы в природе. Способы получения металлов