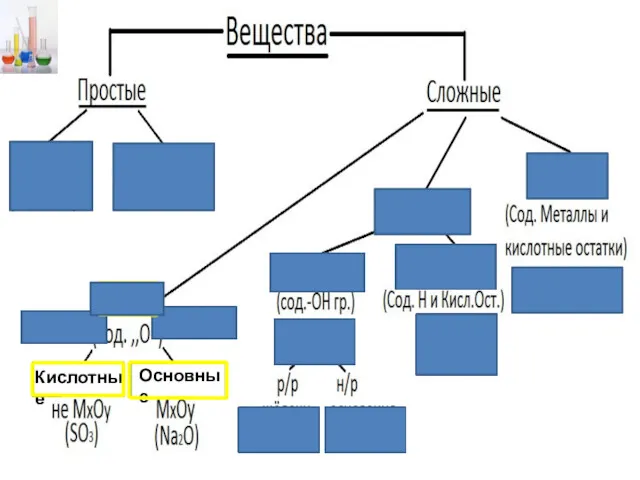
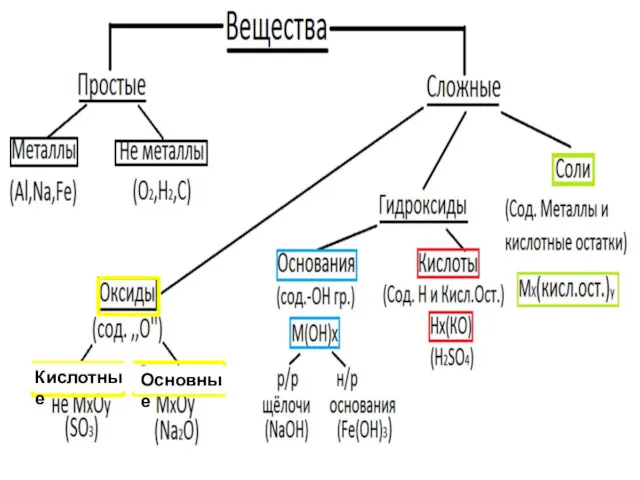
Содержание
- 2. Кислотные Основные
- 3. Кислотные Основные
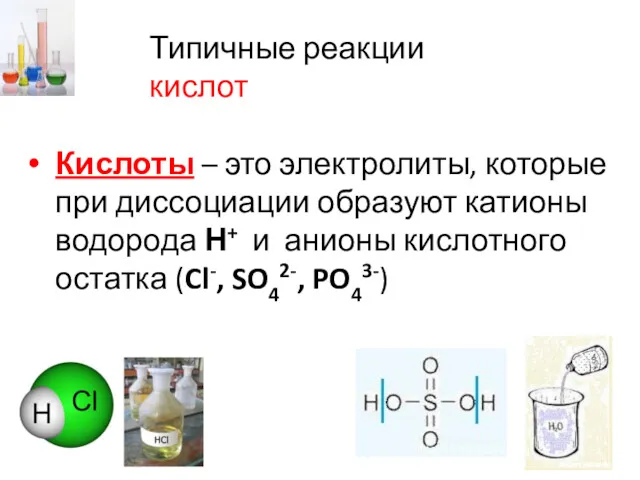
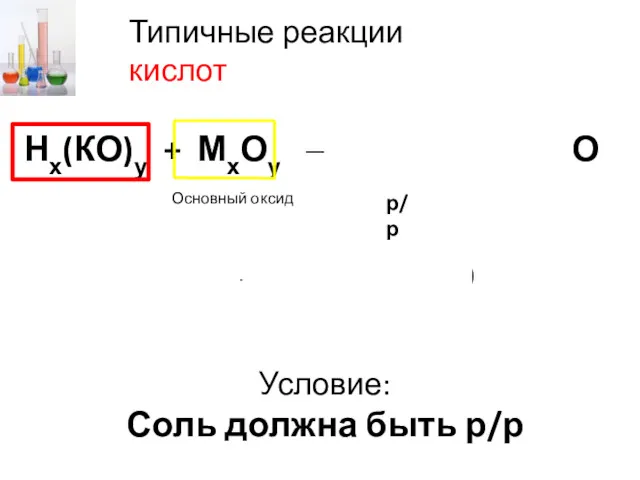
- 4. Типичные реакции кислот Кислоты – это электролиты, которые при диссоциации образуют катионы водорода Н+ и анионы
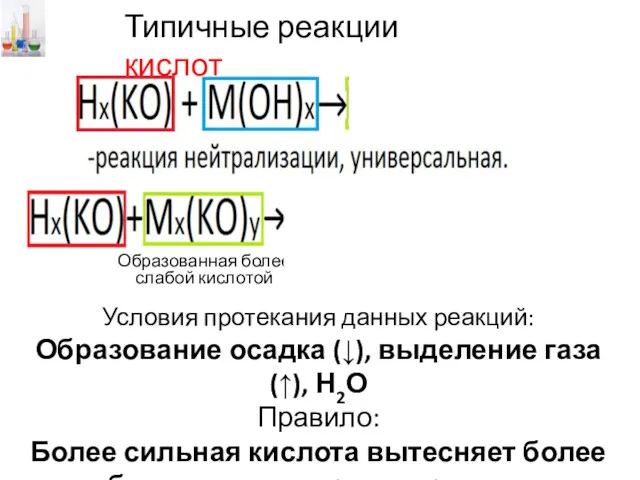
- 6. Типичные реакции кислот Образованная более слабой кислотой Условия протекания данных реакций: Образование осадка (↓), выделение газа
- 7. Нх(КО)у + МхОу → Мх(КО)у + Н2О НCl + СаО → CaCl2 + Н2О Основный оксид
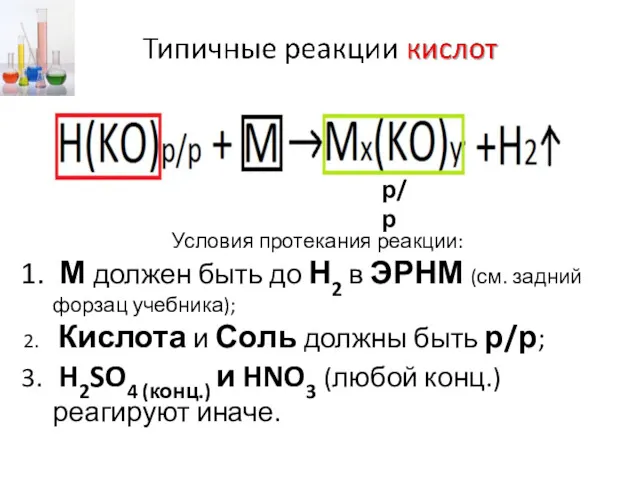
- 8. Условия протекания реакции: М должен быть до Н2 в ЭРНМ (см. задний форзац учебника); Кислота и
- 9. Закончите уравнения возможных реакций: Cu + H2SO4 (разб.) → HCl + CaS → CaCl2 + H2S↑
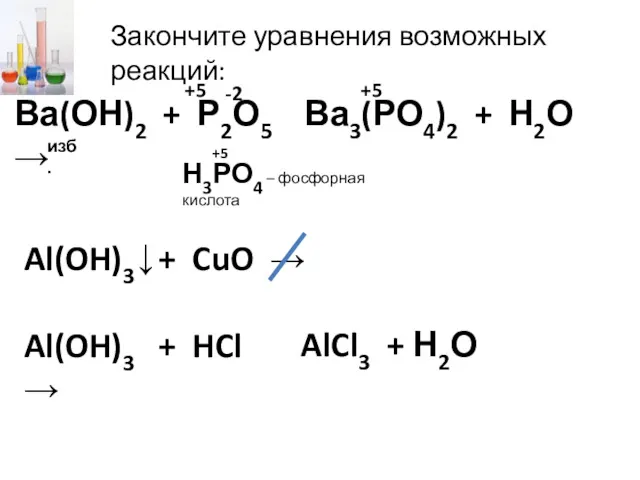
- 10. Закончите уравнения возможных реакций: 2Al(OH)3 + 6HCl → 2AlCl3 + 3H2O Напишите ионное уравнение, полное и
- 11. Д/З: § 39 (все: 1,2 – у., 3-6 – п.)
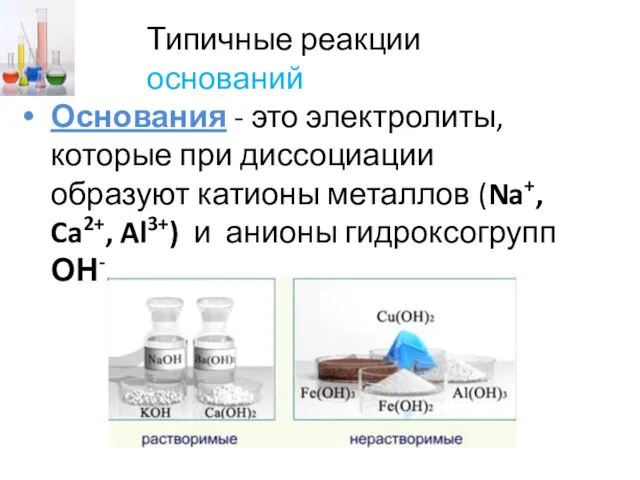
- 12. Типичные реакции оснований Основания - это электролиты, которые при диссоциации образуют катионы металлов (Na+, Ca2+, Al3+)
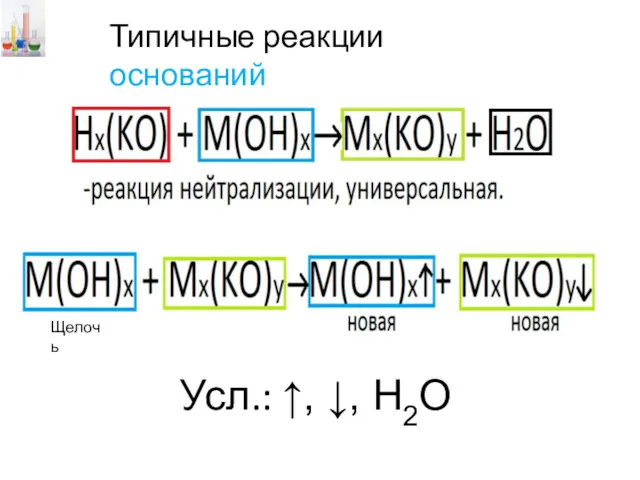
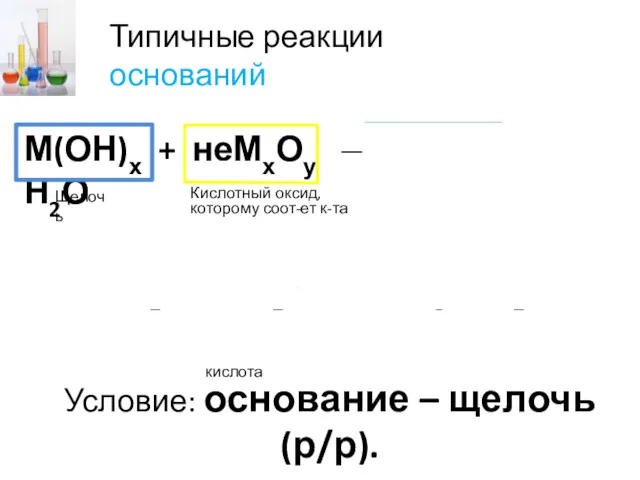
- 13. Типичные реакции оснований Усл.: ↑, ↓, Н2О Щелочь
- 14. М(ОН)х + неМхОу → Мх(КО)у + Н2О Кислотный оксид, которому соот-ет к-та Щелочь Условие: основание –
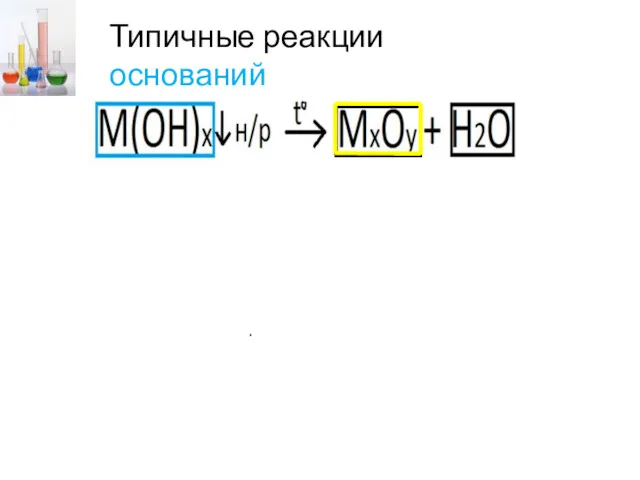
- 15. Типичные реакции оснований Fe(OH)3 → Fe2O3 + H2O Fe(OH)2 → FeO + H2O +3 +2 +2
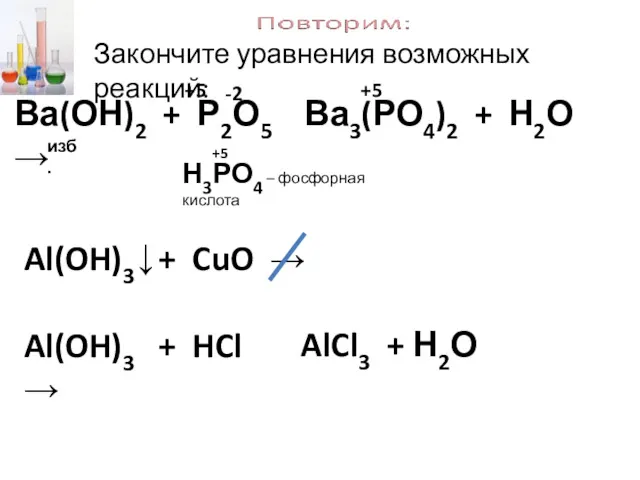
- 16. Закончите уравнения возможных реакций: Ва(ОН)2 + Р2О5 → Ва3(РО4)2 + Н2О -2 +5 +5 Н3РО4 –
- 17. Д/З: § 39 (1,2 – у., 3-5 – п.)
- 18. Самостоятельная работа 8 класс Кислоты, основания Кислоты и основания. Типичные реакции.
- 19. 1 вариант 2 вариант Нап. ур. возможных р-ций в молекул. и ионном виде Если реакция не
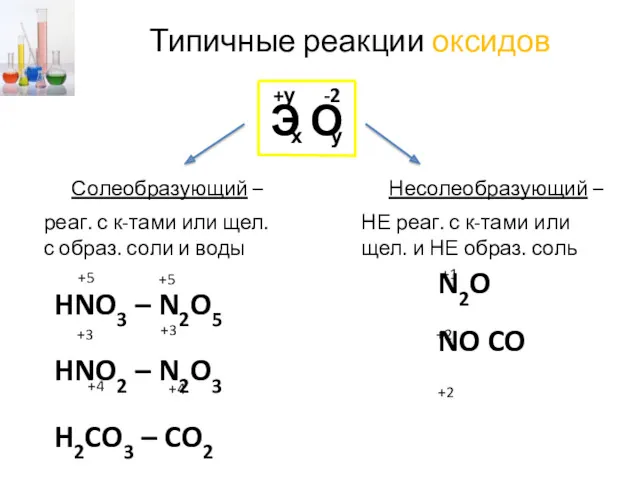
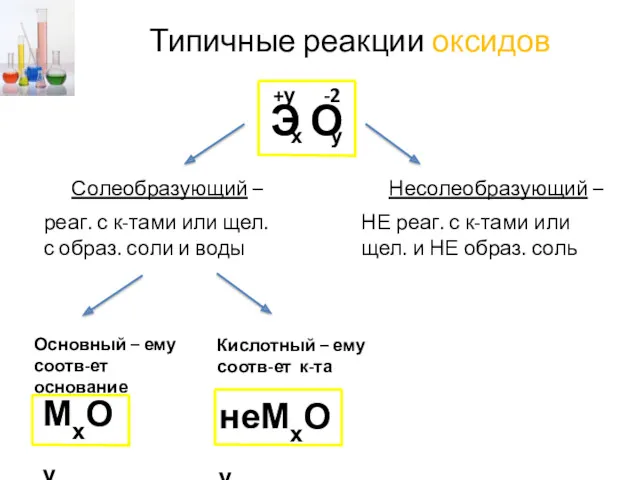
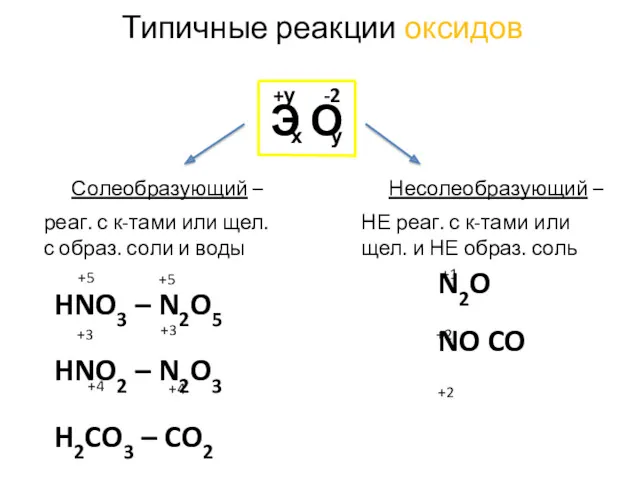
- 20. Типичные реакции оксидов Э О х -2 +у у Солеобразующий – Несолеобразующий – реаг. с к-тами
- 21. Типичные реакции оксидов Э О х -2 +у у Солеобразующий – Несолеобразующий – реаг. с к-тами
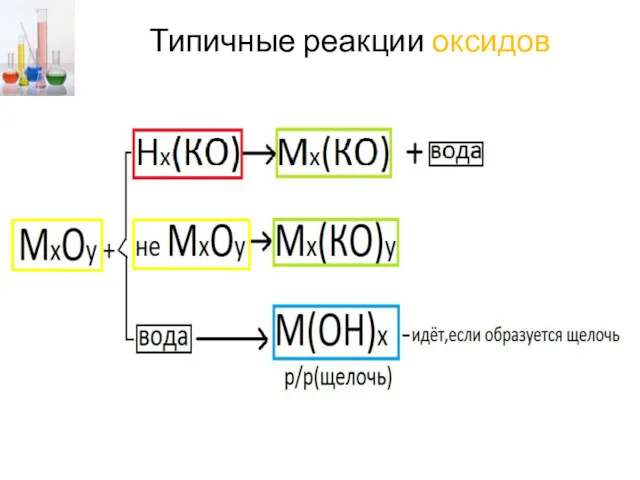
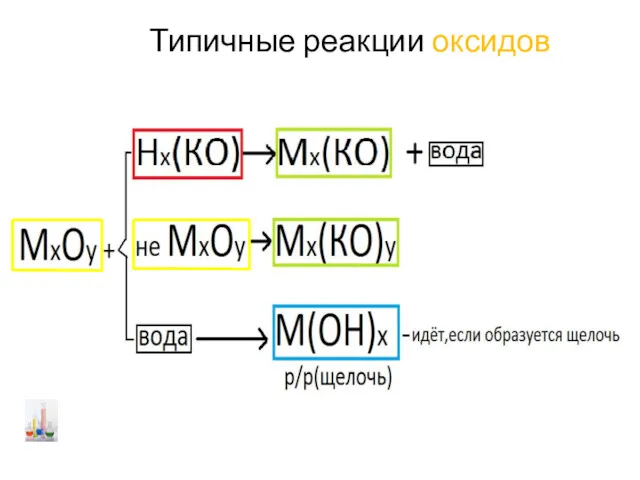
- 22. Типичные реакции оксидов
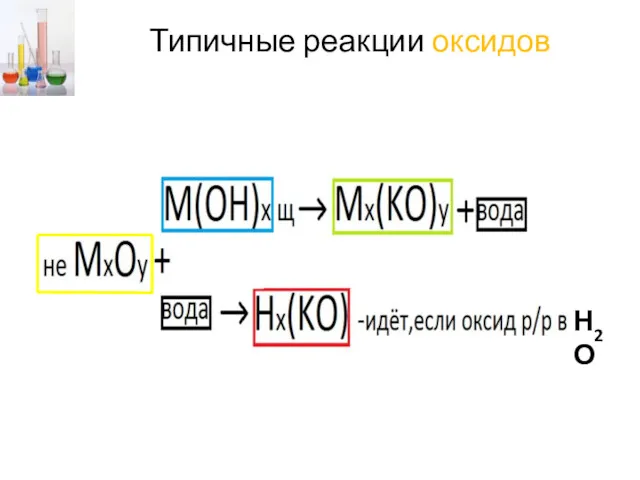
- 23. Типичные реакции оксидов Н2О
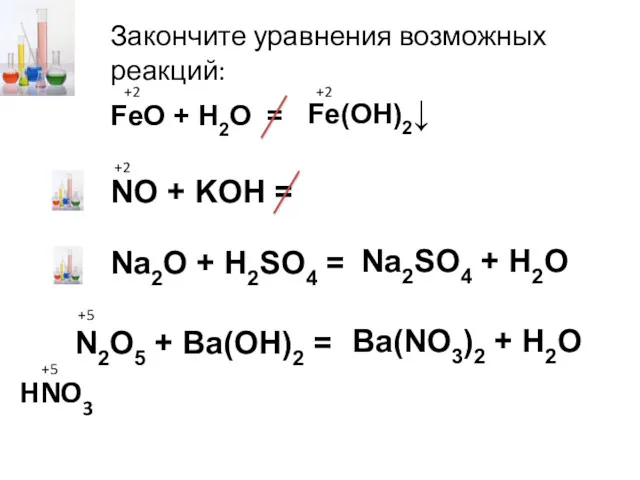
- 24. Закончите уравнения возможных реакций: FeO + H2O = +2 Fe(OH)2↓ +2 NO + KOH = +2
- 25. Типичные реакции оксидов Э О х -2 +у у Солеобразующий – Несолеобразующий – реаг. с к-тами
- 26. Типичные реакции оксидов
- 27. Закончите уравнения возможных реакций: Cu + H2SO4 (разб.) → HCl + CaS → CaCl2 + H2S↑
- 28. Закончите уравнения возможных реакций: 2Al(OH)3 + 6HCl → 2AlCl3 + 3H2O Напишите ионное уравнение, полное и
- 29. Закончите уравнения возможных реакций: Ва(ОН)2 + Р2О5 → Ва3(РО4)2 + Н2О -2 +5 +5 Н3РО4 –
- 30. Д/З: § 41 (1, 3)
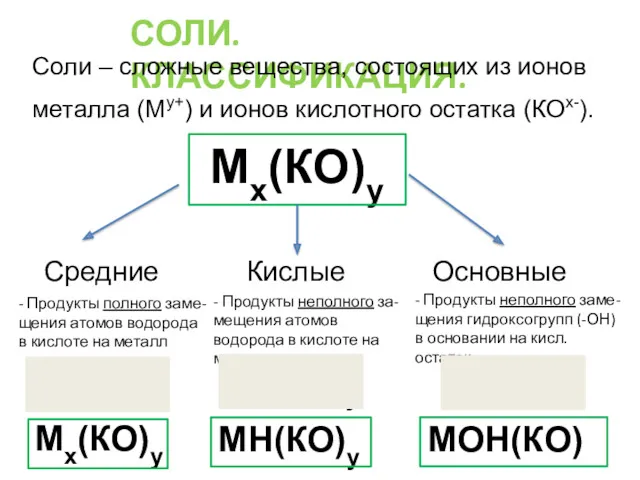
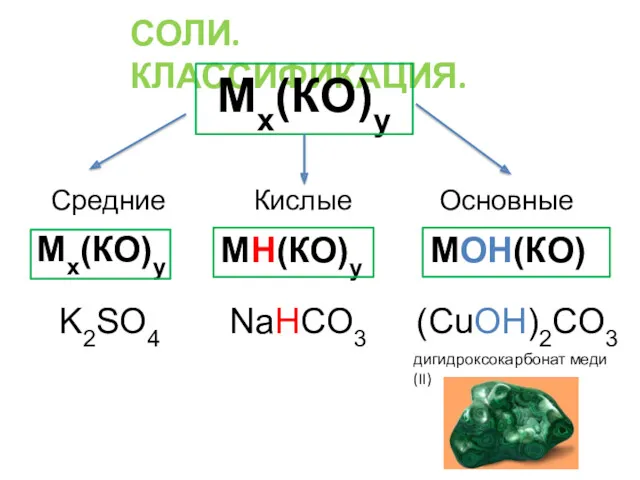
- 31. СОЛИ. КЛАССИФИКАЦИЯ. Мх(КО)у Средние Кислые Основные Мх(КО)у Соли – сложные вещества, состоящих из ионов металла (Му+)
- 32. СОЛИ. КЛАССИФИКАЦИЯ. Мх(КО)у Средние Кислые Основные Мх(КО)у МН(КО)у МОН(КО) K2SO4 NaHCO3 (CuOH)2CO3 дигидроксокарбонат меди(II)
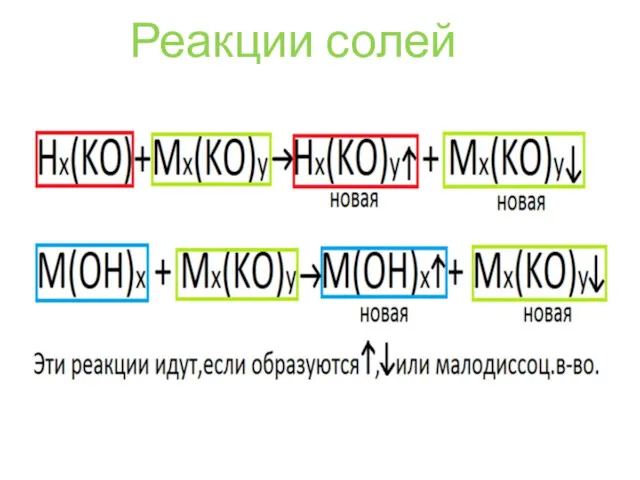
- 33. Реакции солей
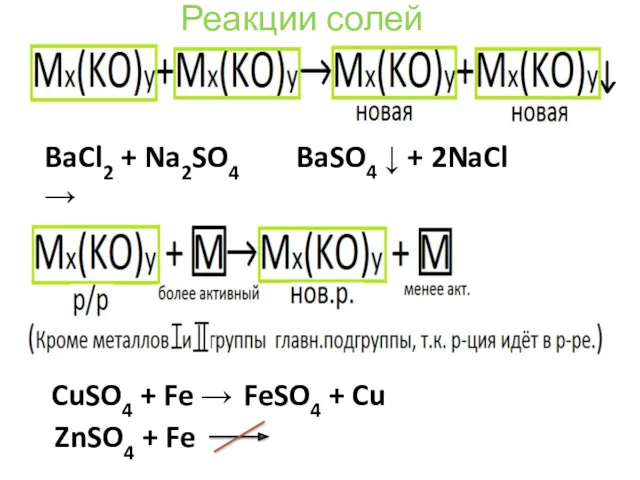
- 34. BaCl2 + Na2SO4 → ZnSO4 + Fe BaSO4 ↓ + 2NaCl CuSO4 + Fe → FeSO4
- 35. Игры – интерактивная доска Состав и номенклатура кислот Номенклатура солей Номенклатура солей 2 Формулы и названия
- 36. Д/З: § 42 (1,2)
- 37. Теперь вы знаете что такое вещества, а также их типичные реакции.
- 38. Реакции солей
- 40. Типичные реакции кислот и оснований Кислоты – это электролиты, которые при диссоциации образуют катионы водорода Н+
- 43. Скачать презентацию

















 Минералды тыңайтқыштар
Минералды тыңайтқыштар Тотығу-тотықсыздану титрлеу әдісі
Тотығу-тотықсыздану титрлеу әдісі Пены. Пенообразование
Пены. Пенообразование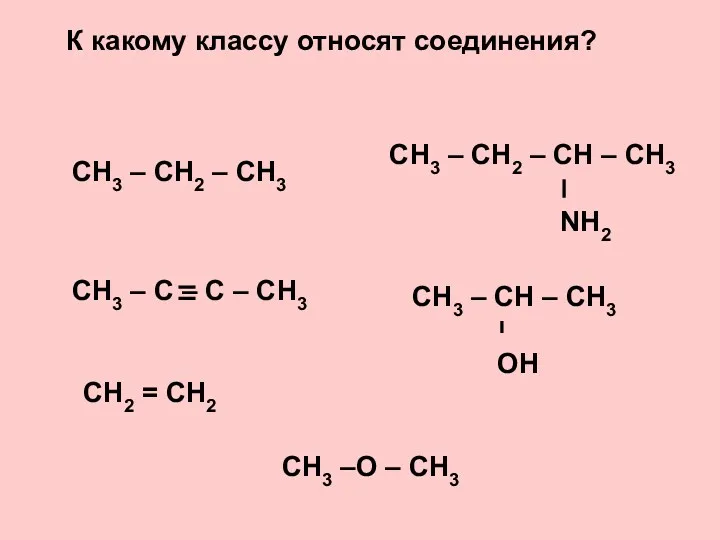 16_OP_05_Alkany
16_OP_05_Alkany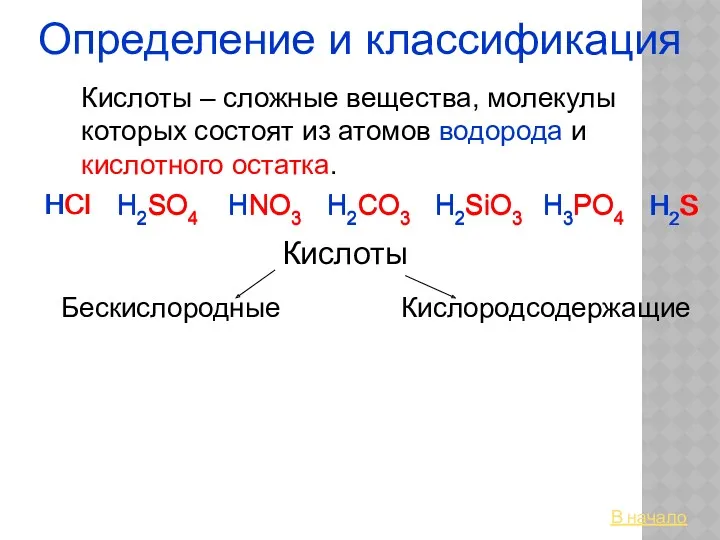 Кислоты. Определение и классификация
Кислоты. Определение и классификация Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы
Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы Квантово-механический подход к описанию строения атомов
Квантово-механический подход к описанию строения атомов d-элементы
d-элементы Химия и живопись
Химия и живопись Ароматические углеводороды (арены)
Ароматические углеводороды (арены)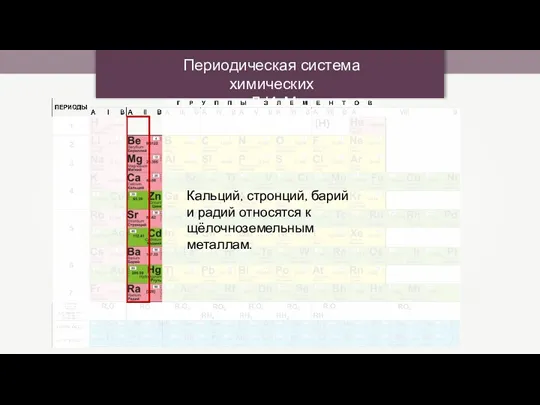 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Химическое равновесие
Химическое равновесие Тест: полимеры
Тест: полимеры Платина. Физические и химические свойства
Платина. Физические и химические свойства Минералогия с основами кристаллографии
Минералогия с основами кристаллографии Химические реакции
Химические реакции Бордың адам ағзасына әсері
Бордың адам ағзасына әсері Гідроліз солей
Гідроліз солей Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2)
Гетероциклические соединения природного и синтетического происхождения. Производные фурана и бензофурана. (Лекция 1-2) Соединения железа. Охарактеризуйте Fe
Соединения железа. Охарактеризуйте Fe Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM)
Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM) Вычисление массовой доли растворенного вещества. 8 класс
Вычисление массовой доли растворенного вещества. 8 класс Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Structural, substructural properties and chemical composition
Structural, substructural properties and chemical composition Водород
Водород Композиционные материалы
Композиционные материалы Реакции ионного обмена
Реакции ионного обмена Галогенопроизводные углеводородов 1
Галогенопроизводные углеводородов 1