Содержание
- 2. Охарактеризуйте Fe как химический элемент, составив предложения со словами и словосочетаниями: Порядковый номер, номер периода ,
- 3. Проверьте ошибки и коэффициенты Fe + S→ Fe S 3Fe + 2O2 → Fe3O4 2Fe +3СI₂
- 4. Проверьте ошибки и коэффициенты Fe + 2HCI → FeCI₂ + H₂ Fe + H₂SO₄ → FeSO₄
- 5. СЕГОДНЯ НА УРОКЕ: 1. Оксиды и гидроксиды железа +2 и +3, их характер 2. Получение гидроксидов
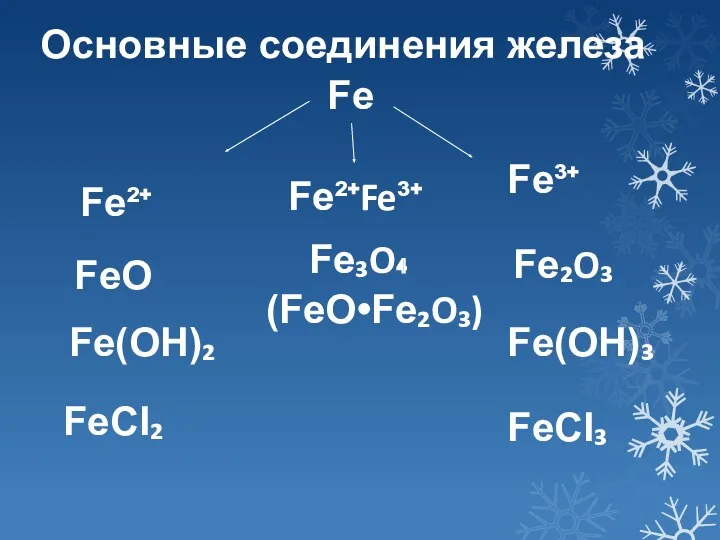
- 6. Fe Fe²⁺ Fe³⁺ FeO Fe(OH)₂ FeCI₂ Fe₂O₃ Fe(OH)₃ FeCI₃ Основные соединения железа Fe²⁺Fe³⁺ Fe₃O₄ (FeO•Fe₂O₃)
- 7. Экспериментальная Соблюдайте ПТБ!
- 8. Получение гидроксидов железа FeCI₂ + 2NaOH = Fe(OH)₂↓ +2NaCI FeCI₃ + 3NaOH = Fe(OH)₃↓ + 3NaCI
- 9. Качественные реакции на ионы Fe²⁺ и Fe³⁺ Fe³⁺ реактив – роданид калия KSCN Fe³⁺ реактив –
- 10. Нахождение в природе В свободном виде в метеоритах В живых организмах
- 11. Биологическая Железо входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железо -белковых комплексов, которые
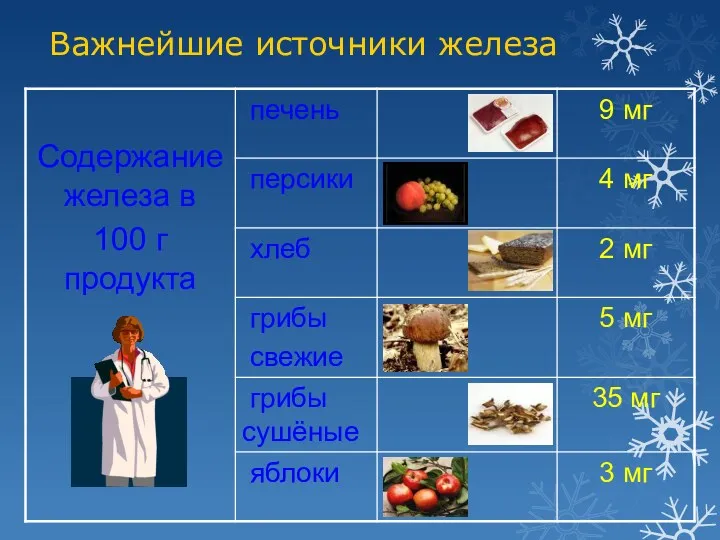
- 12. Важнейшие источники железа
- 13. Токсичность железа Избыточная доза железа – 200мг и выше может вызвать отравление Железо занимает 5 –е
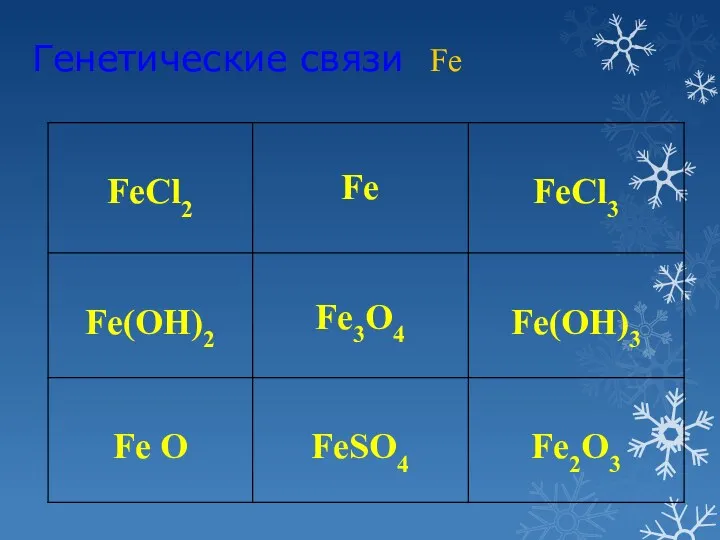
- 14. Генетические связи Fe
- 15. СЕГОДНЯ Я УЗНАЛ… Я УДИВИЛСЯ… ТЕПЕРЬ Я УМЕЮ… Я ХОТЕЛ БЫ…
- 16. Домашнее задание § 14, составить уравнения по записанным генетическим рядам
- 18. Скачать презентацию












 Выдающиеся открытия в области химии
Выдающиеся открытия в области химии Жесткость воды. Способы ее устранения
Жесткость воды. Способы ее устранения Характеристика s,p,d,f - элементов
Характеристика s,p,d,f - элементов Растворы неэлектролитов и электролитов
Растворы неэлектролитов и электролитов Protein and amino acid metabolism
Protein and amino acid metabolism Понятие об алкинах
Понятие об алкинах Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Спирты. Классификация спиртов
Спирты. Классификация спиртов Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Аммиак
Аммиак Растворы и растворители
Растворы и растворители Простые вещества — металлы и неметаллы
Простые вещества — металлы и неметаллы Полипропилен
Полипропилен Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Основные понятия органической химии
Основные понятия органической химии Природный газ и нефть
Природный газ и нефть Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Аммиак. Состав. Строение
Аммиак. Состав. Строение Химическая связь
Химическая связь Общие способы получения металлов
Общие способы получения металлов Алкадиены
Алкадиены Титрование в неводных средах. (Лекция 26)
Титрование в неводных средах. (Лекция 26) Ионная хроматография
Ионная хроматография Хімічний зв'язок
Хімічний зв'язок Неметаллические материалы
Неметаллические материалы Гидролиз солей
Гидролиз солей Елементи VІ групи головної підгрупи
Елементи VІ групи головної підгрупи Химические опасности. Нитраты
Химические опасности. Нитраты