Содержание
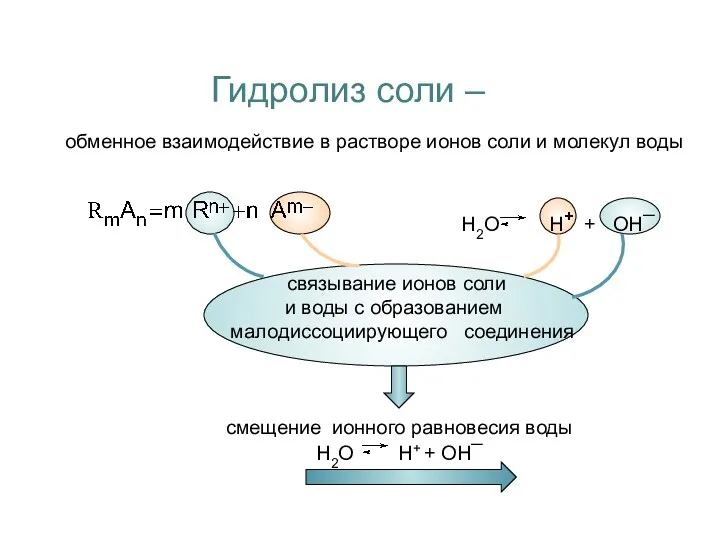
- 2. обменное взаимодействие в растворе ионов соли и молекул воды Н2О Н+ + ОН¯ связывание ионов соли
- 3. Типы солей по отношению к гидролизу соль подвергается гидролизу по аниону по катиону по катиону и
- 4. по аниону: HА + OH− cреда щелочная по катиону: ROH + H+ среда кислая Схема гидролиза
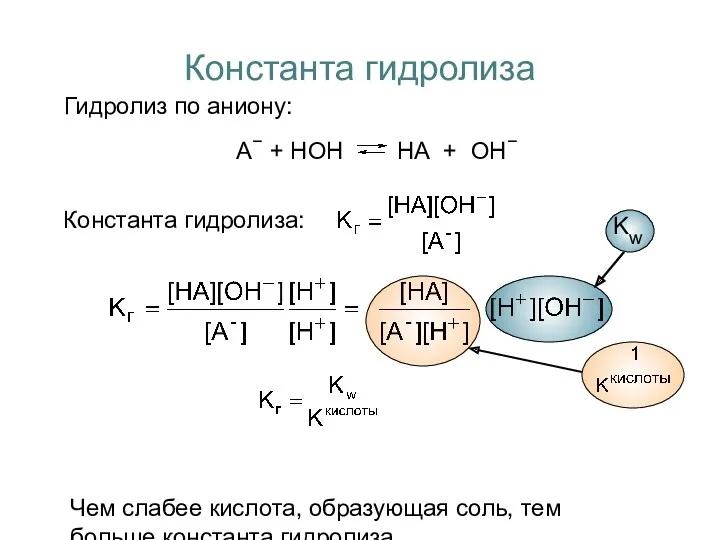
- 5. Константа гидролиза Гидролиз по аниону: А− + НОН НА + ОН− Константа гидролиза: Чем слабее кислота,
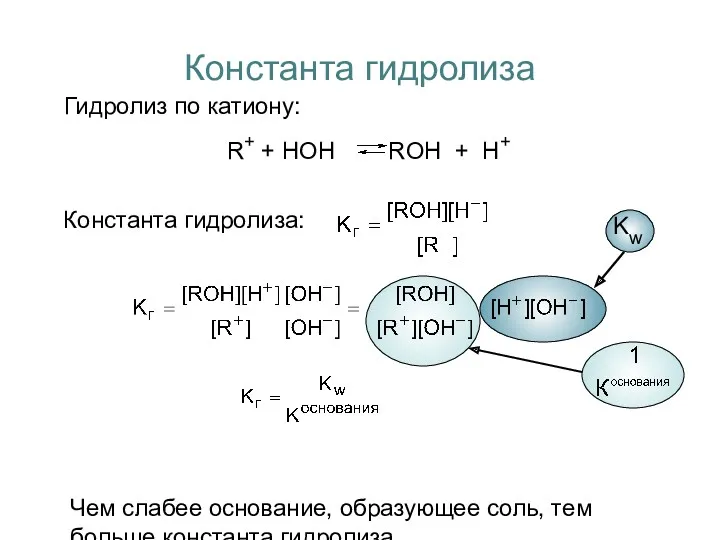
- 6. Константа гидролиза Гидролиз по катиону: R+ + НОН ROН + Н+ Константа гидролиза: Чем слабее основание,
- 8. Степень гидролиза соли - отношение количества вещества (соли), подвергшегося гидролизу, к общему количеству растворенного вещества Размерность
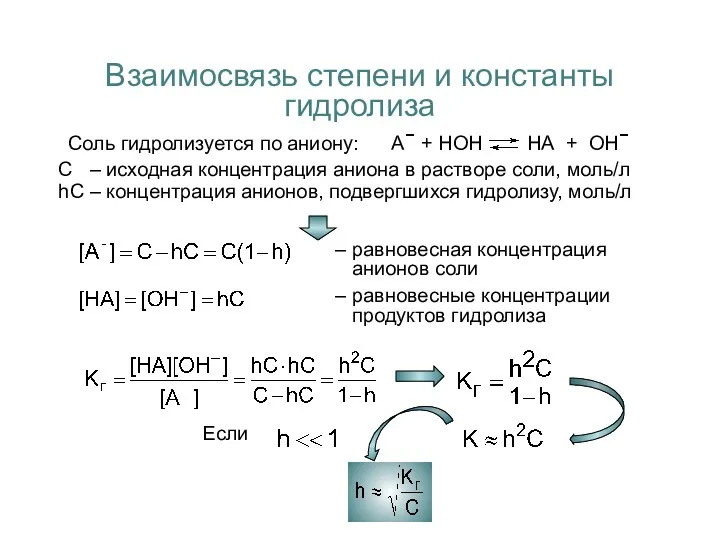
- 9. Взаимосвязь степени и константы гидролиза Соль гидролизуется по аниону: А− + НОН НА + ОН− С
- 11. Влияние природы соли слабее основание или кислота, образующие соль меньше значение К - константы диссоциации больше
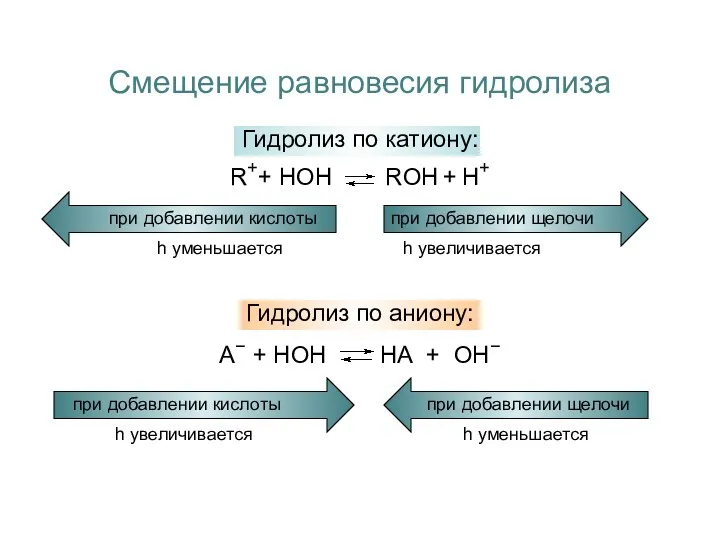
- 12. Смещение равновесия гидролиза Гидролиз по катиону: R++ HOH ROH + H+ Гидролиз по аниону: А− +
- 13. Ионное уравнение гидролиза СH3COO− + HOH СH3COOH + OH− Степень гидролиза Концентрация ионов Н+ и рН
- 15. соль образована сильным основанием и слабой одноосновной кислотой, гидролиз идет по аниону NaNO2 = Na+ +
- 16. Гидролиз соли К2СО3 K2CO3 = 2K+ + CO32− Соль образована сильным основанием и слабой двухосновной кислотой.
- 17. По первой ступени: По второй ступени: Расчет констант гидролиза К2СО3 гидролиз протекает преимущественно по I ступени
- 18. Гидролиз соли Cd(NO3)2 Cd(NO3)2 = Cd2+ + 2NO3− Соль образована слабым основанием и сильной кислотой. Гидролиз
- 19. Гидролиз соли CH3COONH4 Соль образована слабым основанием и слабой одноосновной кислотой CH3COONH4 = NH4+ + CH3COO−
- 20. Гидролиз солей слабых кислот и слабых оснований Соли слабого основания и слабой многоосновной кислоты в растворе
- 22. Скачать презентацию














 Азотсодержащие органические соединения. Аминокислоты (часть 2)
Азотсодержащие органические соединения. Аминокислоты (часть 2) Липиды. Классификация липидов
Липиды. Классификация липидов Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов
Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Аурум
Аурум Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Сравнение нормативов некоторых веществ
Сравнение нормативов некоторых веществ Строение атома
Строение атома Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Кислоты, их состав и названия
Кислоты, их состав и названия Ненасыщенные (непредельные) алифатические углеводороды. Алкены
Ненасыщенные (непредельные) алифатические углеводороды. Алкены Строение атома. Периодический закон Д. И. Менделеева
Строение атома. Периодический закон Д. И. Менделеева Химическая связь и ее типы. Кристаллические решетки
Химическая связь и ее типы. Кристаллические решетки Теория электролитической диссоциации. Кислотно-основные равновесия в водных растворах
Теория электролитической диссоциации. Кислотно-основные равновесия в водных растворах Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Фенол и его свойства
Фенол и его свойства Проект на тему Екзо- та ендотермічні реакції на службі людства
Проект на тему Екзо- та ендотермічні реакції на службі людства Частицы вещества: молекула, атом, ион
Частицы вещества: молекула, атом, ион Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Физические и химические явления. Признаки химических реакций
Физические и химические явления. Признаки химических реакций Некоторые закономерности протекания химических реакций: тепловой эффект реакции, скорость реакции, химическое равновесие
Некоторые закономерности протекания химических реакций: тепловой эффект реакции, скорость реакции, химическое равновесие Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Хроматографические методы в аналитической химии
Хроматографические методы в аналитической химии Мінеральні добрива
Мінеральні добрива Электролиз. 11 класс
Электролиз. 11 класс Щелочные металлы
Щелочные металлы Периодическая система элементов, предсказание химических свойств элементов на основе таблицы
Периодическая система элементов, предсказание химических свойств элементов на основе таблицы Углекислый газ
Углекислый газ