Фізичні властивості
Естери нижчих карбонових кислот і спиртів – безбарвні леткі рідини
з приємним фруктовим запахом. Оцтовоізоаміловий (ізобутилацетат)) естер має запах груші, масляно-бутиловий (етилбутаноат) – ананасу, етилформіат – ром, метилбутаноат – яблуко, ізобутилбутаноат – абрикос, бутилбутаноат – банан, бензилацетат – жасмин.
Естери мінеральних кислот – маслянисті рідини з приємним запахом, вищих спиртів і вищих карбонових кислот – тверді речовини, що майже не мають запаху. Вони мало розчинні у воді і добре – в спирті та інших органічних розчинниках.
Температури плавлення та кипіння сетерів нижчих спиртів менші, ніж у відповідних кислот.






 Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Растворы. Классификация, способы выражения концентрации, свойства растворов
Растворы. Классификация, способы выражения концентрации, свойства растворов Heavy metals
Heavy metals Химические методы выявления потожировых следов
Химические методы выявления потожировых следов Искусственные и трансурановые элементы
Искусственные и трансурановые элементы Карбонові кислоти
Карбонові кислоти Перманганат калия
Перманганат калия АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Вещественный состав магматических горных пород и петрохимические пересчеты
Вещественный состав магматических горных пород и петрохимические пересчеты Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Периодический закон Менделеева
Периодический закон Менделеева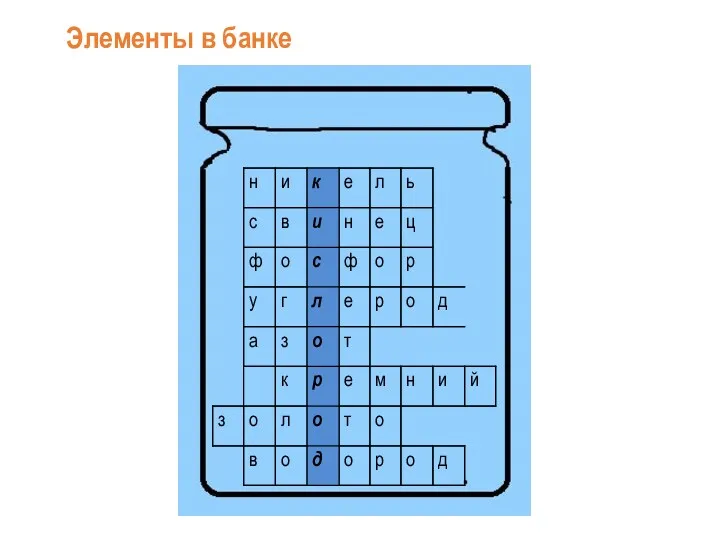 Кислород
Кислород Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины Аллотропия
Аллотропия Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Вещества и физические тела
Вещества и физические тела Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Алканы.Определение. Общая формула класса углеводородов
Алканы.Определение. Общая формула класса углеводородов Уникальная соль (для дошколников)
Уникальная соль (для дошколников)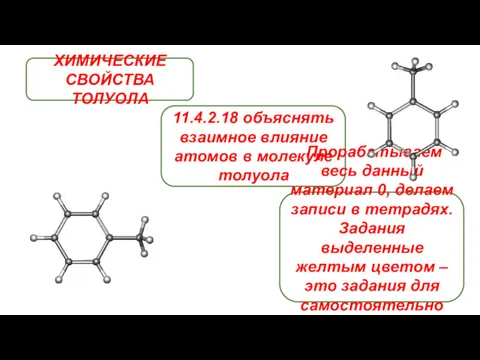 Химические свойства толуола
Химические свойства толуола Окислительно-восстановительные реакции. Основные положения электронной теории ОВР
Окислительно-восстановительные реакции. Основные положения электронной теории ОВР Перегонка с водяным паром
Перегонка с водяным паром Вода
Вода Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел 5.Алкины
5.Алкины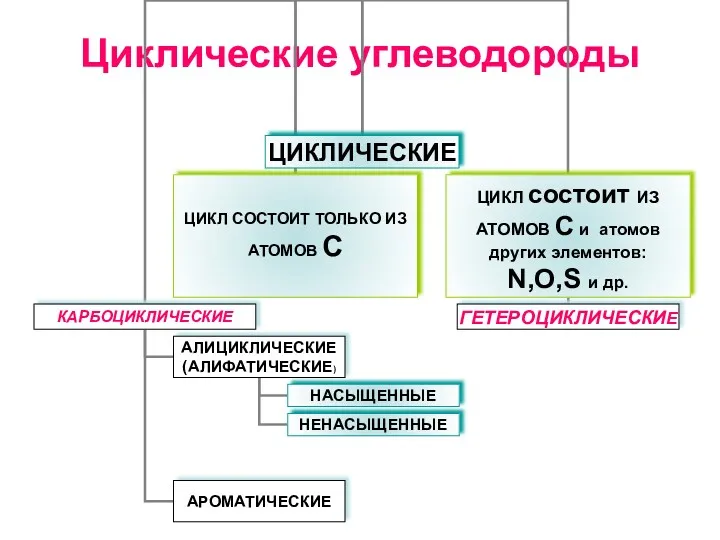 Циклические углеводороды
Циклические углеводороды Химический элемент водород
Химический элемент водород