Содержание
- 3. Кислород
- 4. Карл Вильгельм Шееле (шведский химик) в 1772 году получил и детально исследовал «огненный воздух», в котором
- 5. Джозеф Пристли (английский ученый) в 1774 году разложением оксида ртути (II) открыл кислород и изучил его
- 6. Антуан Лавуазье в 1774 году провел эксперимент и доказал, что воздух состоит на 1/5 часть из
- 7. В подгруппе сверху вниз увеличивается радиус, увеличивается число энергетических уровней, усиливаются металлические и восстановительные свойства
- 8. Я.Берцелиус К И С Л О Р О Д– это вещество, вокруг которого вращается вся земная
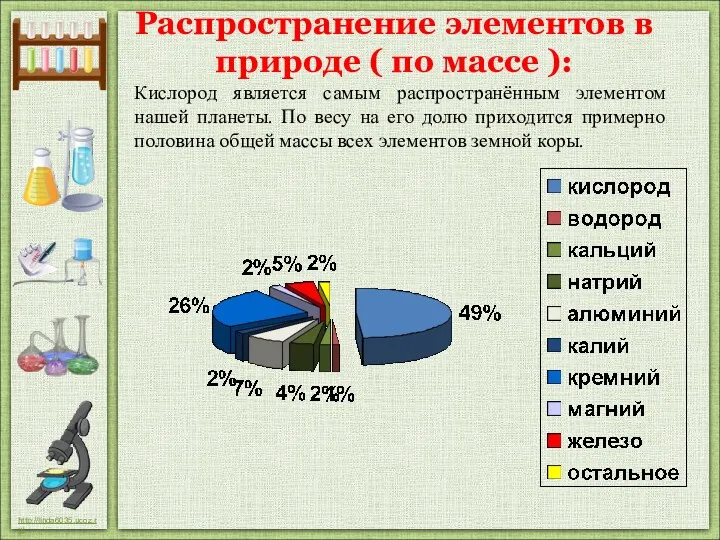
- 9. Распространение элементов в природе ( по массе ): Кислород является самым распространённым элементом нашей планеты. По
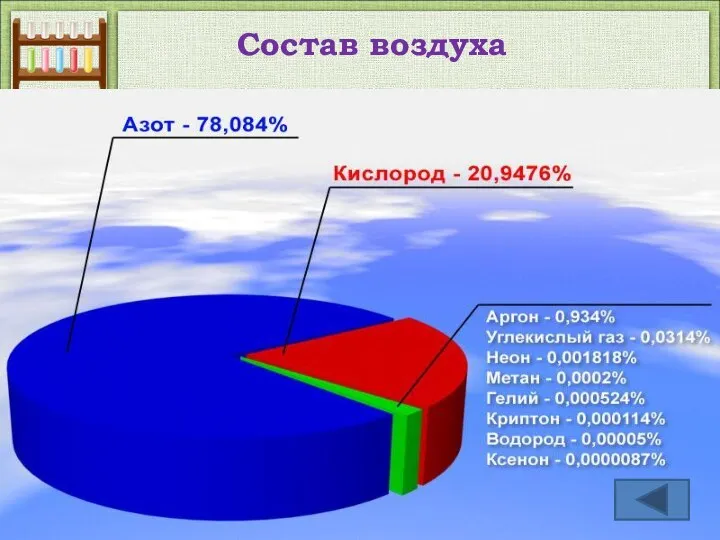
- 10. Состав воздуха
- 11. Газ - без цвета, вкуса и запаха; в 100V H2O растворяется 3V O2 (н.у.); t°кип= -183°С;
- 12. Аллотропия- существование какого-либо элемента в виде нескольких простых веществ.
- 13. Способы получения и собирания кислорода. А) В природе: Кислород в природе образуется в процессе фотосинтеза. 6СО2
- 14. Б) В промышленности: Перегонкой сжиженного воздуха при t = - 1830 С под давлением. В) В
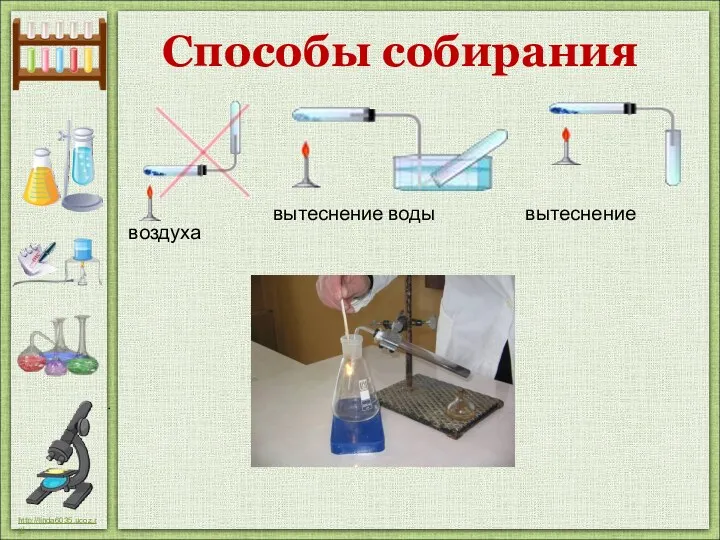
- 15. Способы собирания вытеснение воды вытеснение воздуха кислорода
- 16. Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au, Pt, He, Ne
- 17. Находит широкое применение в медицине и промышленности. При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- 19. Скачать презентацию













 Вред Coca-Cola на организм человека
Вред Coca-Cola на организм человека Правила техники безопасности при работе в химическом кабинете
Правила техники безопасности при работе в химическом кабинете Синтетические волокна
Синтетические волокна Ансамбль пор в реальном твердом теле
Ансамбль пор в реальном твердом теле Осмос. Онкотикалық қысым. Изотоникалық коэффицент. Гипо, гипер изотоникалық ерітінділер
Осмос. Онкотикалық қысым. Изотоникалық коэффицент. Гипо, гипер изотоникалық ерітінділер Электрохимический ряд напряжения металлов
Электрохимический ряд напряжения металлов Молекулы и атомы
Молекулы и атомы Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування
Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування Предельные одноатомные спирты
Предельные одноатомные спирты Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение 16_OP_05_Alkany
16_OP_05_Alkany Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Соединения азота. Оксиды азота
Соединения азота. Оксиды азота 20231110_amfoternye_oksidy_i_gidroksidy
20231110_amfoternye_oksidy_i_gidroksidy Неметаллы: общая характеристика
Неметаллы: общая характеристика Реакции ионного обмена
Реакции ионного обмена Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Бережём планету вместе. Нефть
Бережём планету вместе. Нефть Растворы. Лекция №5
Растворы. Лекция №5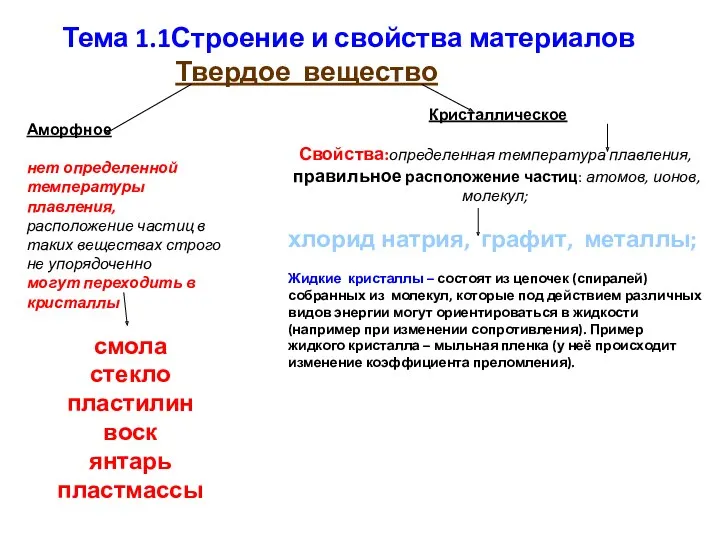 Строение и свойства материалов. Тема 1.1
Строение и свойства материалов. Тема 1.1 Методы измерения серы в нефтепродуктах
Методы измерения серы в нефтепродуктах Химия органических соединений. Углеводороды
Химия органических соединений. Углеводороды Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Обмен триацилглицеролов и жирных кислот
Обмен триацилглицеролов и жирных кислот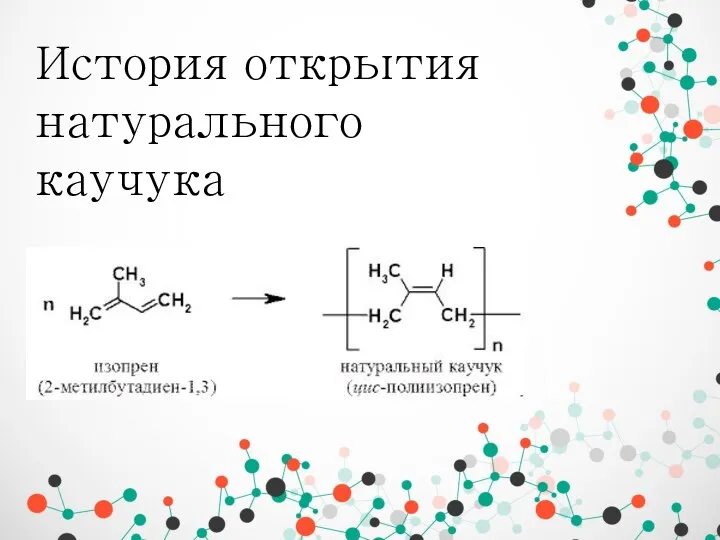 История открытия натурального каучука
История открытия натурального каучука Жидкостная хроматография
Жидкостная хроматография АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері Генетическая связь между классами органических веществ
Генетическая связь между классами органических веществ