Содержание
- 2. ОБЩАЯ ХАРАКТЕРИСТИКА РАСТВОРОВ Растворы – это физико-химические дисперсные системы состоящие из двух или более компонентов.
- 3. РАСТВОР – это гомогенная система, состоящая из растворителя, растворенных веществ и продуктов их взаимодействия. РАСТВОРИТЕЛЬ –это
- 4. КЛАССИФИКАЦИЯ РАСТВОРОВ В зависимости от агрегатного состояния растворителя растворы делятся на: ЖИДКИЕ РАСТВОРЫ (растворитель –жидкость) Например:
- 5. ТВЕРДЫЕ РАСТВОРЫ (растворитель –твердое вещество) Например: - металлический сплав (твердое в твердом); - кристаллы солей (жидкость
- 6. ГАЗОВЫЕ РАСТВОРЫ (растворитель –газ) Например: пыль в воздухе (твердое в газе); - туман (жидкость в газе);
- 7. В зависимости от размеров частиц вещества растворы бывают: ИСТИННЫЕ РАСТВОРЫ –это растворы с размером частиц растворенного
- 8. Коллоидные растворы легко отличить от истинных растворов, так как коллоидные частицы рассеивают свет. Если через коллоидный
- 9. В зависимости от количества растворенного вещества растворы бывают: НАСЫЩЕННЫЙ РАСТВОР – это раствор, содержащий максимально возможное
- 10. Растворимость – это способность вещества растворяться в том или ином растворителе. Растворимость выражается числом граммов растворенного
- 11. Растворимость Если молекулы растворителя неполярны или малополярны, то этот растворитель будет хорошо растворять вещества с неполярными
- 12. Растворимость К полярным растворителям относят воду и глицерин. К малополярным спирт и ацетон. К неполярным хлороформ,
- 13. Растворимость газов Растворимость газов в жидкостях увеличивается с повышением давления и понижением температуры. При нагревании растворимость
- 14. Растворимость твердых веществ Растворимость твердых веществ в жидкостях мало зависит от температуры и не зависит от
- 15. Растворимость жидкости Растворимость жидкости в жидкости увеличивается с повышением температуры и практически не зависит от давления.
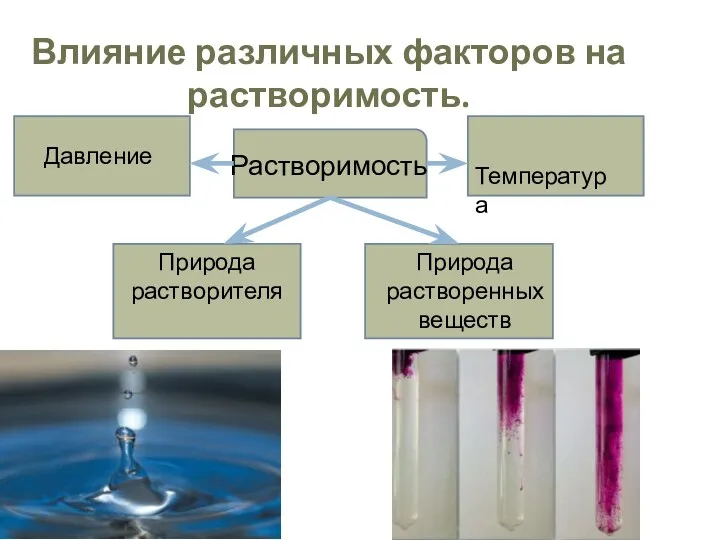
- 16. Влияние различных факторов на растворимость. Растворимость Температура Давление Природа растворенных веществ Природа растворителя
- 17. Концентрация раствора – это содержание вещества в определенной массе или объеме раствора.
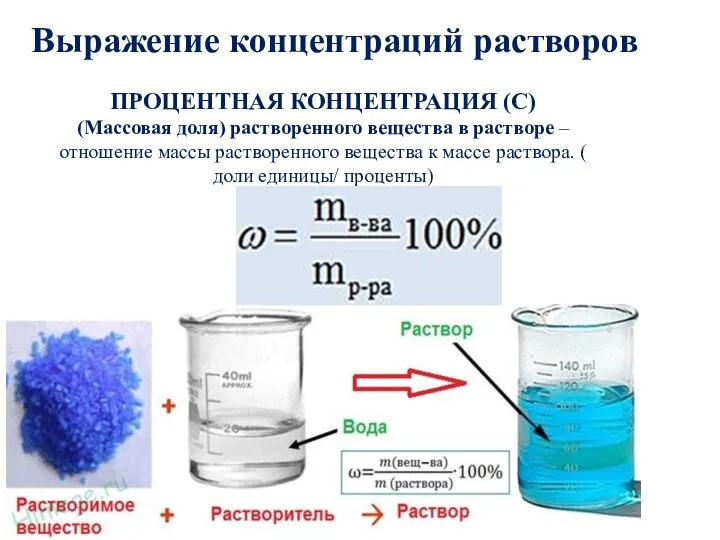
- 18. Выражение концентраций растворов ПРОЦЕНТНАЯ КОНЦЕНТРАЦИЯ (С) (Массовая доля) растворенного вещества в растворе – отношение массы растворенного
- 19. МОЛЬНАЯ ДОЛЯ (Ni) Это отношение количества вещества одного из компонентов раствора к сумме количеств веществ всех
- 20. Выражение концентраций растворов. Молярность - число молей растворенного вещества в 1 л раствора. ʋ - количество
- 21. Выражение концентраций растворов. Эквивалентная концентрация (нормальность) – число эквивалентов растворенного вещества в 1л раствора. ʋ экв.
- 22. Выражение концентраций растворов. Моляльная концентрация (моляльность) – число молей растворенного вещества на 1000 г растворителя.
- 23. Гидратная теория Менделеева К концу 19 века сформировались 2 противоположные точки зрения на природу раствора: физическая
- 24. КИПЕНИЕ И ЗАМЕРЗАНИЕ РАСТВОРОВ ЗАКОН РАУЛЯ Повышение температуры кипения и понижение температуры замерзания раствора по сравнению
- 26. Скачать презентацию





















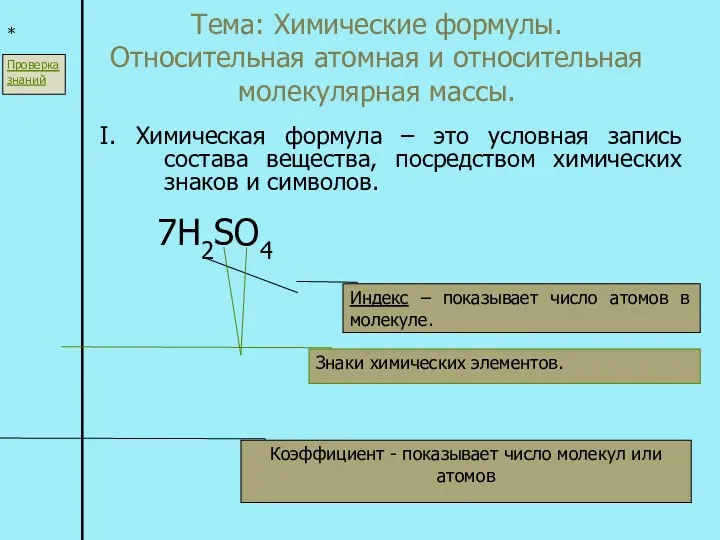 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Кислоты. Классификация кислот по строению кислотного остатка
Кислоты. Классификация кислот по строению кислотного остатка Химический элемент - фосфор
Химический элемент - фосфор Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Азот қышқылын өндіру
Азот қышқылын өндіру КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ Растворы. Классификация, способы выражения концентрации, свойства растворов
Растворы. Классификация, способы выражения концентрации, свойства растворов Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Алкины. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция №4
Алкины. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция №4 Тайна мыльного пузыря
Тайна мыльного пузыря Синтетические моющие средства. Механизм моющего действия
Синтетические моющие средства. Механизм моющего действия Азотовмисні та елементоорганічні сполуки
Азотовмисні та елементоорганічні сполуки Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Видатні вітчизняні вчені – творці хімічної науки
Видатні вітчизняні вчені – творці хімічної науки Аминокислоты
Аминокислоты Азотная кислота
Азотная кислота Молекулалық орбиталдың негіздері ТФП 315
Молекулалық орбиталдың негіздері ТФП 315 Основы химической термодинамики (лекция 6)
Основы химической термодинамики (лекция 6) Валентность и степень окисления
Валентность и степень окисления Основные классы неорганических веществ
Основные классы неорганических веществ Періодична система Д.І.Менделєєва
Періодична система Д.І.Менделєєва Диссоциация кислот, оснований, солей
Диссоциация кислот, оснований, солей Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Иондар және олардың түзілуі
Иондар және олардың түзілуі Структура легированной стали
Структура легированной стали Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Роль жиров в организме человека
Роль жиров в организме человека Изделия из металлов
Изделия из металлов