Содержание
- 2. План лекции 1. Основные понятия 2. Первый закон (первое начало) термодинамики 3. Термохимия 4. Второй закон
- 3. Термины Термодинамика – наука о превращениях различных форм энергии и законах этих превращений. Термохимия – раздел
- 4. Термины Система - конкретный объект исследования, выделенный из окружающего мира реально существующими или воображаемыми границами. Система
- 5. Состояние системы состояние системы определяется параметрами: Р (давление) V (объем) T (температура) С (концентрация) Изменение хотя
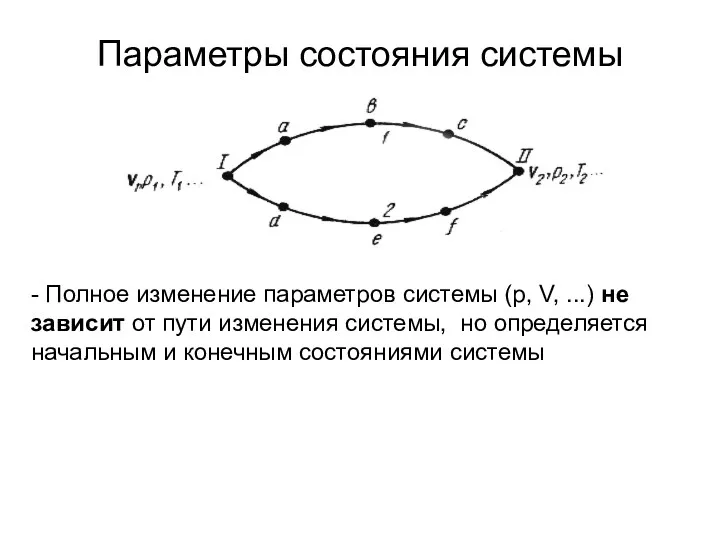
- 6. Параметры состояния системы - Полное изменение параметров системы (p, V, ...) не зависит от пути изменения
- 7. Свойства системы Свойства системы: U (внутренняя энергия) H (энтальпия) S (энтропия) G (энергия Гиббса) Изменение свойств
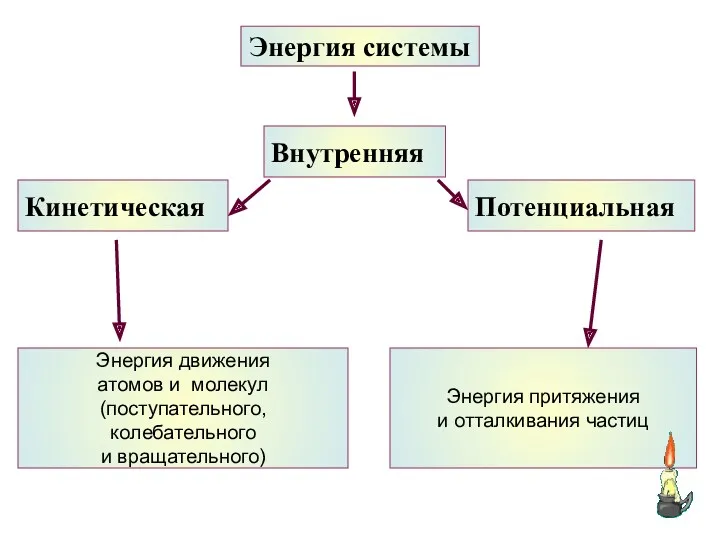
- 8. Внутренняя энергия Внутренняя энергия (U)– это совокупность энергий теплового движения молекул и молекулярных взаимодействий
- 9. Энергия движения атомов и молекул (поступательного, колебательного и вращательного) Энергия притяжения и отталкивания частиц Внутренняя Потенциальная
- 10. Внутренняя энергия Абсолютное значение не может быть определено. Измеряют только изменение при переходе системы из начального
- 11. Теплота и работа Предположим, что некоторая система за счет поглощения теплоты Q (Дж) перешла из состояния
- 12. I закон термодинамики Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы
- 13. Первый закон термодинамики М.В.Ломоносов:«... сколько... у одного тела отнимется, столько же присовокупится к другому» Дж.П. Джоуль:"В
- 14. Термодинамические процессы Если химическая реакция протекает при постоянном объеме (изохорный процесс, V = const), то выделение
- 15. изохорный процесс, V = const При нагревании изменение внутренней энергии определяется по теплоемкости вещества
- 16. Теплоемкость Теплоемкостью С называется количество теплоты, которую необходимо затратить для нагревания 1 г (удельная теплоемкость Дж*г-1*К-1)
- 17. Для изобарного химического процесса, (Р= const) – наиболее частый случай в химии, ∆V представляет разность между
- 18. Тогда QP = ∆U + P*∆V U + P * V = H Н – энтальпия
- 19. Стандартные тепловые эффекты принято обозначать ∆H0298. Стандартные условия: Р=101,32 кПа Т=298 0К Нормальные условия?
- 20. термохимическое уравнение: Н2(г) +Cl2(г) = HCl(г), ∆H0 = -92,25 кДж/моль или Н2(г) + Cl2(г) = HCl(г)
- 21. термохимическое уравнение: H2(г)+O2(г)=H2O(г), ΔH0=−286,8 кДж H2(г)+O2(г)=H2O(ж), ΔH 0=−241,83 кДж значение ∆H0 относится ко всей реакции с
- 22. Термины Стандартная энтальпия сгорания ∆H0сгор соединения – тепловой эффект реакции сгорания одного моль вещества из простых
- 23. Энтальпия образования простых веществ принята равной нулю, нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому
- 25. Следствия из закона Гесса Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций
- 26. Следствия из закона Гесса Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с
- 27. Изменение энтальпии системы не может служить единственным критерием самопроизвольного осуществления химической реакции Возможность самопроизвольного протекания эндотермических
- 28. II закон термодинамики Закон об энтропии и ее свойствах Энтропия (S) – количественная мера беспорядка, она
- 29. II закон термодинамики Сади Карно в своём исследовании «Размышления о движущей силе огня и о машинах,
- 31. Энтропия зависит агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к
- 32. Энтропия ∆S = ∑ ∆Sпрод. - ∑ ∆Sисх. веществ [кДж/моль*К] Энтропия обычно повышается при фазовом переходе:
- 33. Энтропия Произведение изменения энтропии системы на температуру T ΔS количественно оценивает эту тенденцию и называется энтропийным
- 34. Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным
- 35. Энергия Гиббса Джозайя-Уиллард Гиббс G = H – T * S – изобарно – изотермический потенциал
- 36. ΔG указывает на направленность протекания химической реакции ΔG ΔG = 0, при котором наступает равновесное состояние
- 38. Скачать презентацию




























![Энтропия ∆S = ∑ ∆Sпрод. - ∑ ∆Sисх. веществ [кДж/моль*К]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/611432/slide-31.jpg)




 Е-числа в школьном буфете
Е-числа в школьном буфете Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Особенности строения твердых тел
Особенности строения твердых тел Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Химия элементов
Химия элементов Элементы VI группы главной подгруппы
Элементы VI группы главной подгруппы Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами
Биологически важные пяти- и шестичленные гетероциклы с одним и двумя гетероатомами Законы химии
Законы химии Олигомеризация олефинов
Олигомеризация олефинов Комбинированные задачи. 11 класс
Комбинированные задачи. 11 класс Чистые вещества и смеси
Чистые вещества и смеси Полимеры. Структура и свойства
Полимеры. Структура и свойства Водород. Химические свойства
Водород. Химические свойства Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном
Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном Кислоты, основания, соли в свете ТЭД
Кислоты, основания, соли в свете ТЭД Шыны, әйнек
Шыны, әйнек Серебро. История
Серебро. История Химическая кинетика
Химическая кинетика Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения
Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения Способы выражения состава раствора
Способы выражения состава раствора альдегиды, свойства, получение
альдегиды, свойства, получение Coordination compounds
Coordination compounds Растворы. (Лекция 7)
Растворы. (Лекция 7) Сера. Нахождение в природе. Химические свойства серы
Сера. Нахождение в природе. Химические свойства серы Гравиметрический метод анализа
Гравиметрический метод анализа Оксид цинка
Оксид цинка Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии