Содержание
- 2. Контрольная работа № 3. Основы формальной кинетики Задание 1. Определение порядка и константы скорости реакции В
- 3. Порядок реакции - экспериментально определяемая величина, которую находят по результатам наблюдений за изменением концентраций реагирующих веществ
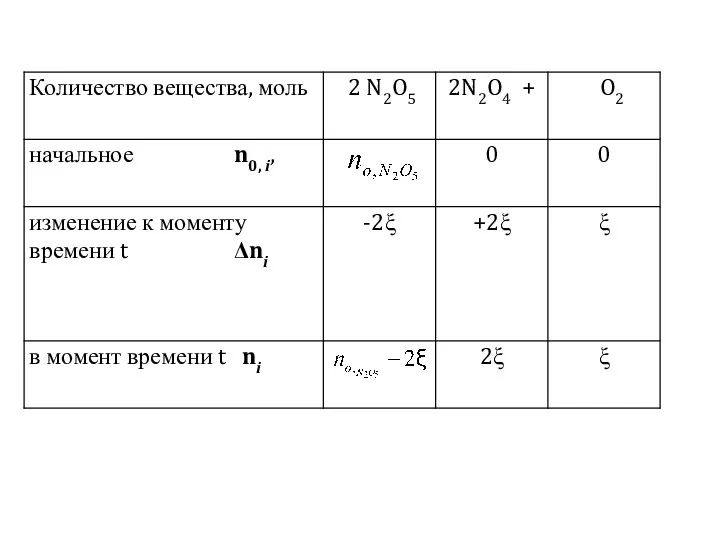
- 5. Начальное количество исходного реагента N2O5 рассчитывается на основании величины общего давления Pо в момент времени t
- 6. А также (из уравнения Клапейрона-Клаузиуса ) Pt – общее давление в реакторе в момент времени t
- 7. Отсюда рассчитывается концентрации исходного вещества в различные промежутки времени Результаты вычислений концентрации оксида азота(V) в каждый
- 8. Вот она
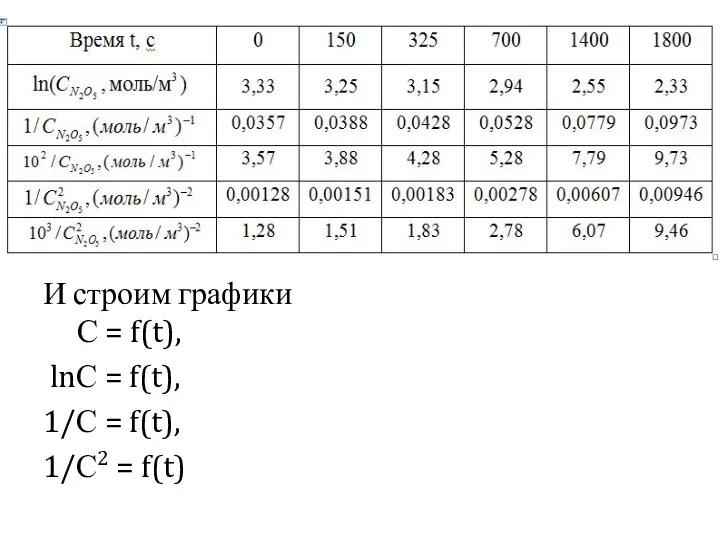
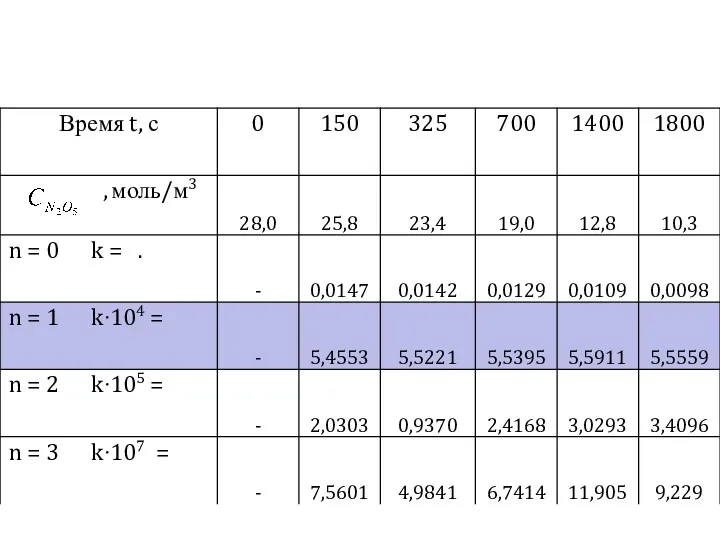
- 9. Далее переходим к определению порядка реакции графическим путем Для этого продолжим предыдущую таблицу, рассчитав для N2O5
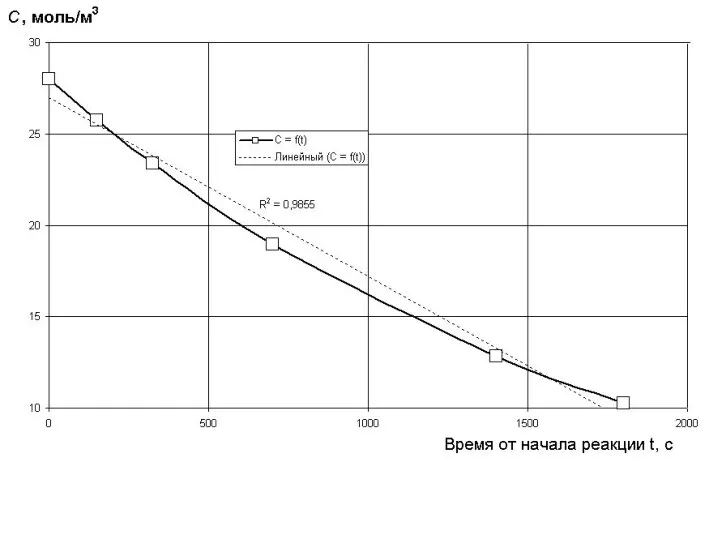
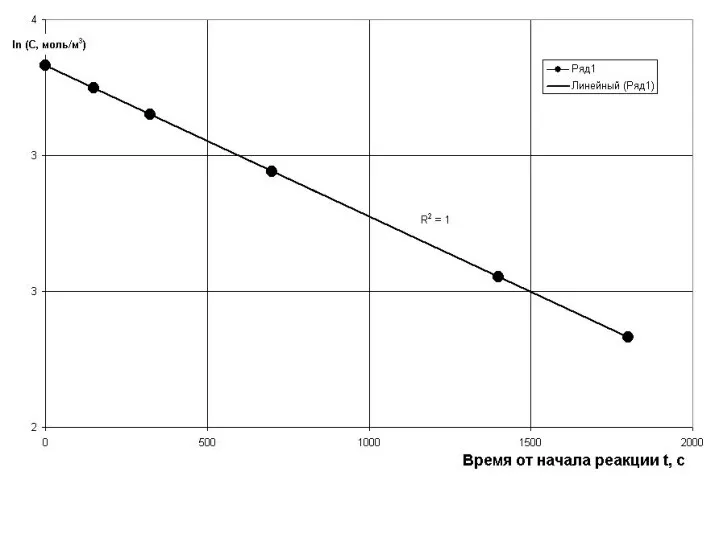
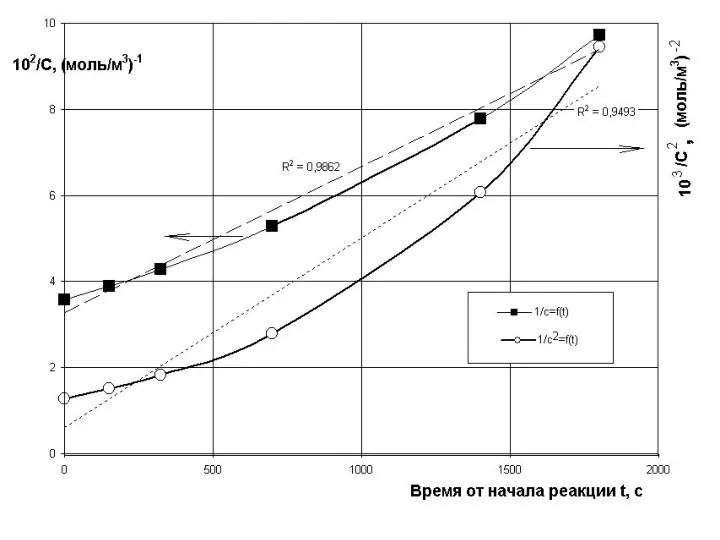
- 10. И строим графики С = f(t), lnС = f(t), 1/С = f(t), 1/С2 = f(t)
- 14. С целью проверки правильности определения порядка реакции воспользуемся методом подстановки и для определения порядка реакции данные
- 16. Из таблицы хорошо видно, что только расчет константы по уравнению для первого порядка даёт значение константы
- 17. . Тогда константа скорости химической реакции первого порядка будет равна , а период полупревращения:
- 18. Если известно, что к моменту времени t15% прореагировало 15 % исходного количество N2O5, то значит текущее
- 19. Теперь, чтобы найти концентрацию N2O5 в момент времени t1 = 12 мин от начала реакции, в
- 20. Задание 2. Определение параметров температурной зависимости скорости химической реакции В таблице приведены значения констант скоростей k1
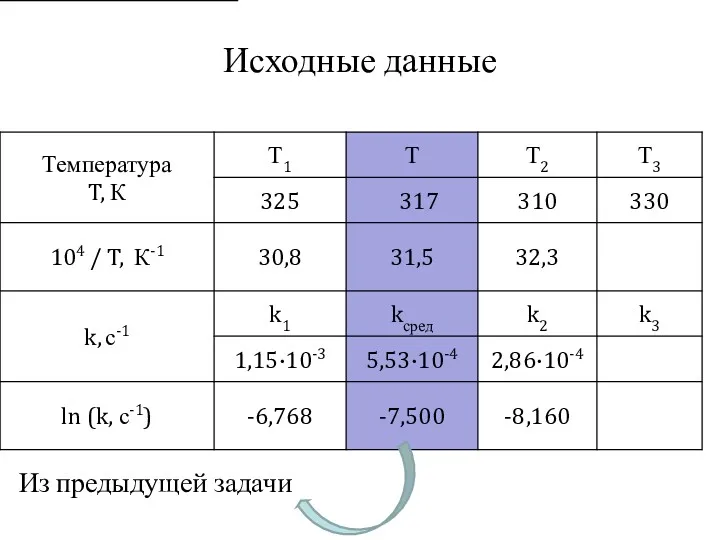
- 21. Исходные данные Из предыдущей задачи
- 22. Зависимость скорости химической реакции от температуры в дифференциальной форме имеет вид где R – универсальная газовая
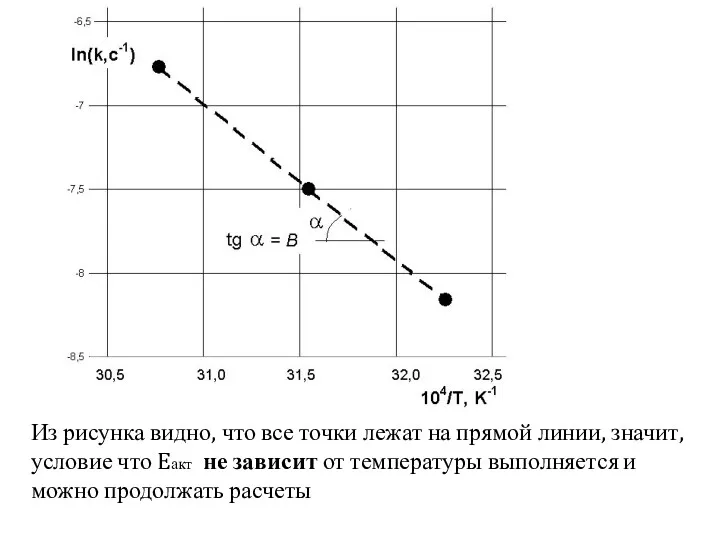
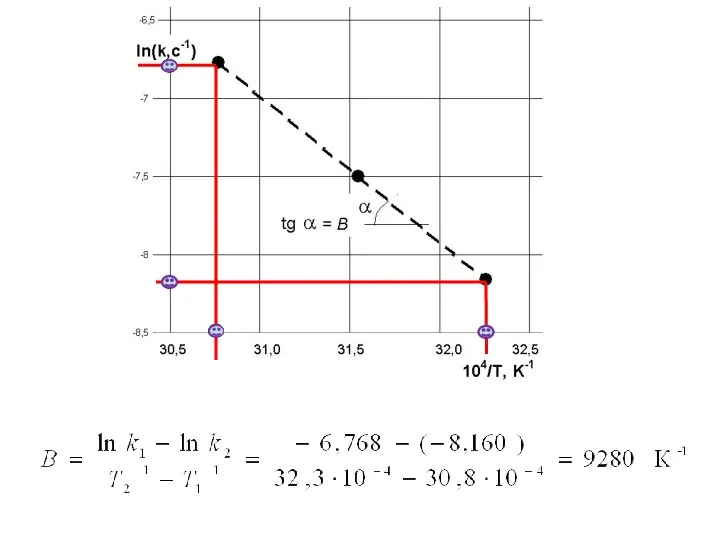
- 23. график является прямой линией в координатах ln k = f(1/T) График – прямая вида y=a±bx, т.е
- 24. Но должно выполнятся условие что Eакт не зависит от температуры в рассматриваемом интервале Чтобы убедиться в
- 25. Из рисунка видно, что все точки лежат на прямой линии, значит, условие что Eакт не зависит
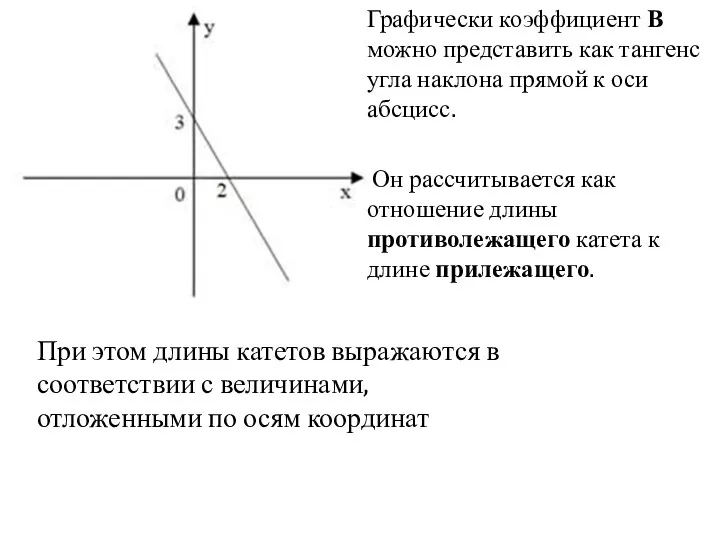
- 26. Графически коэффициент В можно представить как тангенс угла наклона прямой к оси абсцисс. Он рассчитывается как
- 28. Определим предэкспоненциальный множитель k0 в уравнении Аррениуса: и составим уравнение Аррениуса для реакции в экспоненциальной форме:
- 29. Для определения температурного коэффициента скорости реакции (γ) в интервале температур от 310 до 325 К воспользуемся
- 31. Скачать презентацию


















 Виды и свойства текстильных материалов из химических волокон. 6 класс
Виды и свойства текстильных материалов из химических волокон. 6 класс Чистые вещества и смеси
Чистые вещества и смеси Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Бензол
Бензол Полиэтилен
Полиэтилен Вирощення кристталів
Вирощення кристталів Взрывчатые вещества. Пероксид ацетона и пикриновая кислота
Взрывчатые вещества. Пероксид ацетона и пикриновая кислота Изомерия. (11 класс)
Изомерия. (11 класс) Теорія горіння та вибуху
Теорія горіння та вибуху Кристаллические решетки
Кристаллические решетки Черная металлургия
Черная металлургия Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Гидроксиды. Основания: способы получения
Гидроксиды. Основания: способы получения Гетероциклические соединения
Гетероциклические соединения Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Синтетичні волокна
Синтетичні волокна Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Аурум
Аурум Аммиак. 9 класс
Аммиак. 9 класс Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Двойной электрический слой. Теория Гельмгольца
Двойной электрический слой. Теория Гельмгольца Центрифугирование в почвоведении
Центрифугирование в почвоведении Химический состав моторных масел и присадок к ним
Химический состав моторных масел и присадок к ним Попутные нефтяные газы
Попутные нефтяные газы Соли, их классификация и свойства в свете ТЭД
Соли, их классификация и свойства в свете ТЭД Электролитическая диссоциация
Электролитическая диссоциация Геохимия изотопов стабильных элементов
Геохимия изотопов стабильных элементов Классификация химических элементов
Классификация химических элементов