Содержание
- 2. Определение Соли – сложные вещества, молекулы который состоят из атомов металла и кислотного остатка Соли –
- 3. Диссоциация Fe2 (SO4)3 =2 Fe3+ + 3 SO4 AgNO3 = Ag + + NO3– NaCl= Na
- 4. H H SO4 Na Na Na2SO4 2Na+ +SO42- средние соли - это продукты полного замещения атомов
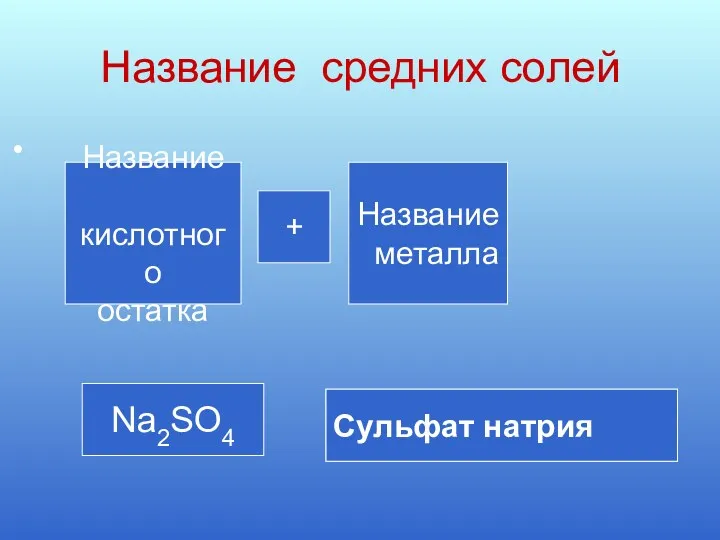
- 5. Название средних солей Название кислотного остатка Название металла + Na2SO4 Сульфат натрия Cульфат натрия
- 6. H H SO4 Na NaHSO4 Na+ + HSO4- кислые соли – это продукты неполного замещения атомов
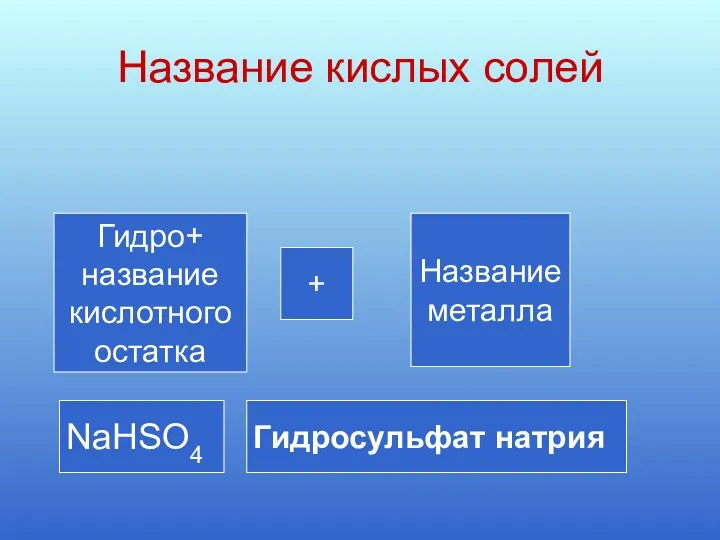
- 7. Название кислых солей Гидро+ название кислотного остатка + Название металла NaHSO4 Гидросульфат натрия Гидросульфат натрия
- 8. Ca OH OH Cl CaOHCl CaOH+ + Cl- основные соли – это продукты неполного замещения гидроксид-ионов
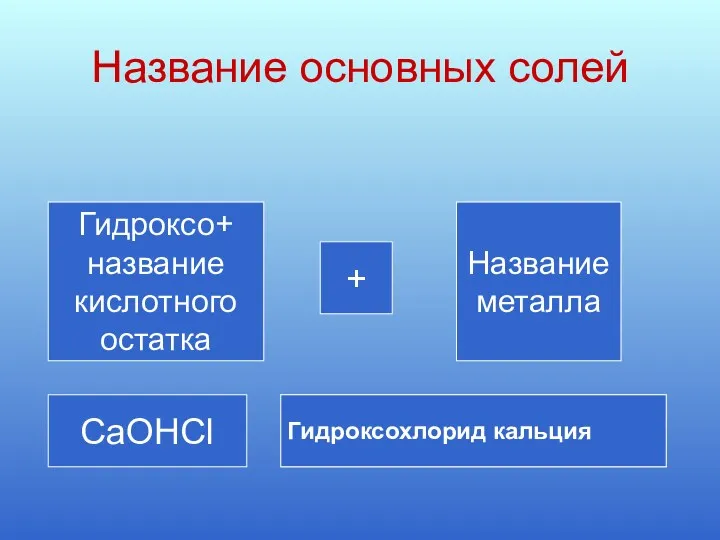
- 9. Название основных солей Гидроксо+ название кислотного остатка + Название металла CaOHCl Гидроксохлорид кальция Гидроксохлорид кальция
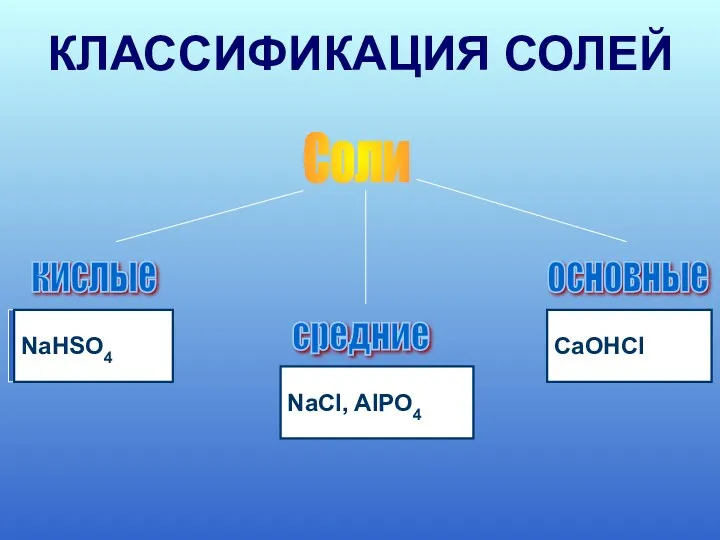
- 10. Соли кислые средние основные Na2SO4 NaHSO4 CaOHCl NaHSO4 NaCI, AIPO4 CaOHCI КЛАССИФИКАЦИЯ СОЛЕЙ
- 11. Химические свойства 1. соль1 + соль2 = соль3 + соль4 Условие протекания: А) Растворы солей можно
- 12. Химические свойства 2. соль + щелочь = другая соль + другое основание Условие протекания: А) растворы
- 13. Химические свойства 3. соль +кислота = другая соль + другая кислота Условие протекания: А) типичная реакция
- 14. Химические свойства 4. соль + металл = другая соль + другой металл Условия протекания: А) Каждый
- 15. С какими из перечисленных веществ будет реагировать хлорид железа (II): Аg, KOH, P2O5, Fe(OH)2, HCl, Na2CO3
- 16. С какими из перечисленных веществ будет реагировать хлорид железа (II): 2 KOH+ FeCl2= Fe(OH)2+ 2 KCl
- 17. Выписать из предложенных веществ формулы солей. Назвать их и для одной соли определить соответствующие им кислоты,
- 18. Практическая работа №3 Идентификация неорганических соединений. Цель: Материалы и оборудование: Ход работы:Изучение практической части и оформление
- 20. Скачать презентацию













 Липиды. Классификация липидов
Липиды. Классификация липидов Галогены. Положение в ПСХЭ Д.И. Менделеева
Галогены. Положение в ПСХЭ Д.И. Менделеева Аминокислоты – структурные единицы белков
Аминокислоты – структурные единицы белков Фосфор и его соединения. 11 класс
Фосфор и его соединения. 11 класс Строение и свойства атомов в свете квантовомеханической теории. Периодический закон – основа основ химии
Строение и свойства атомов в свете квантовомеханической теории. Периодический закон – основа основ химии Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2)
Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Ферменты в пищевой промышленности
Ферменты в пищевой промышленности Основи. Хімія
Основи. Хімія Автомобильные пластичные смазки
Автомобильные пластичные смазки Характеристика химических элементов и химических реакций
Характеристика химических элементов и химических реакций Химический состав пресных вод рыбохозяйственного назначения
Химический состав пресных вод рыбохозяйственного назначения Горение вещества и способы его прекращения
Горение вещества и способы его прекращения Лекция Атомное строение твердых тел. 1-01
Лекция Атомное строение твердых тел. 1-01 Нефть
Нефть Металлы; их классификация, строения и свойства
Металлы; их классификация, строения и свойства Химическая промышленность
Химическая промышленность Группа редкоземельных элементов
Группа редкоземельных элементов Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Электролиз водных растворов
Электролиз водных растворов Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1 Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2
Диаграмма состояния Железо – Углерод. Материаловедение. Лекция 2 Состав энергетических напитков
Состав энергетических напитков Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Качественные реакции. Анионы
Качественные реакции. Анионы 20231110_amfoternye_oksidy_i_gidroksidy
20231110_amfoternye_oksidy_i_gidroksidy Детонаційна стійкість бензину
Детонаційна стійкість бензину Азот
Азот Оксид серы (IV) и серы (VI)
Оксид серы (IV) и серы (VI)