Содержание
- 2. ПЛАН ЛЕКЦИИ: 1. Основные понятия и характеристики 2. Термодинамика процесса растворения 3. Способы выражения концентрации 4.
- 3. Основные понятия Дисперсные системы - это смеси различных веществ. Они состоят из диспергированных веществ и дисперсионной
- 4. В зависимости от размера частиц дисперсные системы подразделяются на группы: взвеси (суспензии, эмульсии) – у которых
- 5. Истинные растворы – содержат атомы и молекулы, размеры которых обычно не превышают 5·10–9 м – это
- 6. Раствором называют гомогенную систему переменного состава, состоящую из одного или нескольких компонентов. Всякий раствор состоит из
- 7. Растворитель- это тот компонент агрегатное состояние, которого не изменяется при образовании раствора. Растворимость- это способность вещества
- 8. Мера растворимости характеризуется коэффициентом растворимости – Коэффициент растворимости равен числу граммов растворенного вещества в 100 граммах
- 9. Если К Если К = 10–3 г/100 г воды – тогда вещество называется малорастворимым “м” Если
- 10. Для малорастворимых “м” и растворимых “р” веществ значение растворимости при различных температурах можно найти в справочниках.
- 11. Основные понятия Произведение растворимости (ПР) – это та часть вещества которая растворилась и диссоциирует на ионы
- 12. Пример: ПР Аl(OH)3 = 1·10-32 Al(OH)3 → Al3+ + 3OH– ПР = [Al3+]·[OH–] = 1·10–32 ПР
- 13. ТЕРМОДИНАМИКА ПРОЦЕССА РАСТВОРЕНИЯ
- 14. Основные положения Растворение – это физико-химический процесс. Физическая сторона – растворяющее вещество теряет свою структуру, разрушается.
- 15. Теплотой или энтальпией растворения – называется количество теплоты, которое выделяется или поглощается при растворении.
- 16. Что происходит при растворении? а) разрушение структуры растворенного вещества, т.е. фазовый переход ΔНфп ΔНфп > 0
- 17. б) гидратация ΔНгидр Na+ + n·H2O = [Na(H2O)n]+ Cl– + m·H2O = Cl– •m·H2O ΔH
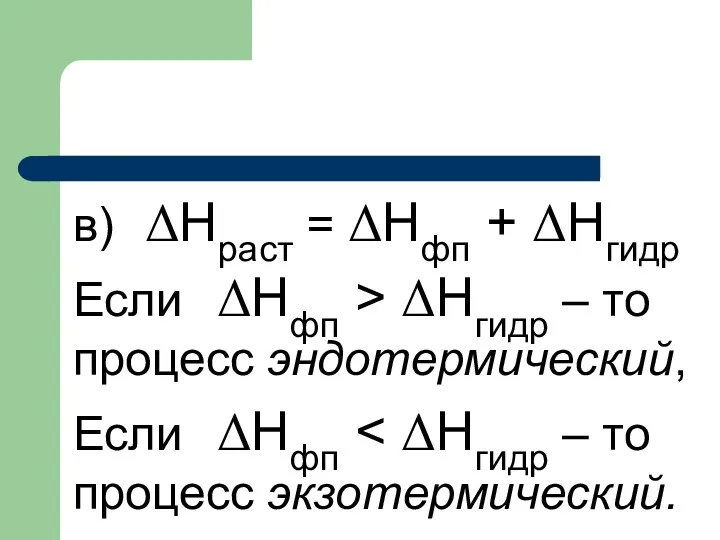
- 18. в) ΔHраст = ΔHфп + ΔНгидр Если ΔHфп > ΔНгидр – то процесс эндотермический, Если ΔHфп
- 19. Энтропия растворения Энтропия растворения твердых и жидких веществ всегда больше нуля ΔS>0 Энтропия растворения газов ΔS
- 20. Энергия Гиббса ΔGраств=ΔНраств+Т·ΔSраств ΔGраств ΔG насыщенного раствора равна нулю.
- 21. Насыщенный раствор – это раствор который находится в равновесии с растворяющимся веществом.
- 22. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ
- 23. Концентрация раствора – это количество растворенного вещества, содержащегося в единице массы и объема раствора или растворителя.
- 24. 1. Молярная концентрация Молярная концентрация – характеризует число молей растворенного вещества в одном литре раствора
- 25. m (р.в.) - масса растворенного вещества, г; М (р.в.) – молярная масса растворенного вещества, г/моль; V
- 26. 2. Молярная концентрация эквивалента или нормальность Молярная концентрация эквивалента или нормальность – выражает число моль эквивалентов
- 27. 3. Моляльная концентрация Моляльная концентрация – число моль растворенного вещества на 1 кг растворителя
- 28. 4. Мольная доля Мольная доля – характеризуется отношением числа молей компонента к общему числу молей всех
- 29. 5. Массовая доля Массовая доля – это число единиц массы растворенного вещества содержащееся в ста единицах
- 30. 6. Титр раствора Титр раствора – масса растворенного вещества в 1 мл раствора
- 31. ИДЕАЛЬНЫЕ РАСТВОРЫ. Закон Рауля
- 32. Идеальные растворы – это такие растворы, образование которых происходит без изменения объема и теплового эффекта.(ΔH=0, ΔV=0),
- 33. В идеальных растворах частицы растворенного вещества находятся на большом расстоянии друг от друга и их взаимное
- 34. Разбавленные растворы приближаются к идеальным. Из реальных растворов разбавленные растворы неэлектролитов могут по своим свойствам приближаться
- 35. Растворы не проводящие электрический ток называются неэлектролитами. Слабые электролиты в растворе не диссоциируют на ионы.
- 36. Некоторые физические свойства растворов неэлектролитов зависят только от концентрации частиц растворенного вещества и природы растворителя и
- 37. К коллигативным свойствам относятся следующие: Понижение давления паров растворителя Повышение температуры кипения, понижение температуры затвердевания Осмотическое
- 38. 1. Понижение давления паров растворителя Согласно, первому закону Рауля – относительное понижение давления насыщенного пара растворителя
- 39. Р0 – давление насыщенного пара над чистым растворителем; N – мольная доля растворенного вещества в растворе.
- 40. ПРИМЕР: Вычислить давление пара раствора содержащего 45г глюкозы C6H12O6 в 720 граммах воды при 250 С.
- 41. 2а. Повышение температуры кипения Второй закон Рауля: а) Повышение температуры кипения ΔТкип раствора пропорционально моляльной концентрации
- 42. Екип – это моляльная константа повышения температуры кипения растворителя или его эбуллиоскопическая константа, которая зависит от
- 43. ПРИМЕР: Вычислить температуру кипения 4,6% раствора глицерина в воде. Молекулярная масса глицерина С3Н8О3 равна 92, Екип
- 44. 2б. Понижение температуры затвердевания растворов Второй закон Рауля: б) Понижение температуры затвердевания растворов пропорционально моляльной концентрации
- 45. Кзатв – это моляльная константа понижения температуры затвердевания или криоскопическая константа (для растворителя).
- 46. ПРИМЕР Вычислить температуру затвердевания раствора состоящего из 100 гр этиленгликоля С2Н6О2 (М=62) и 900 граммов воды,
- 47. 3. Осмотическое давление Раствор представляет собой однородную систему. Частицы растворенного вещества и растворителя находятся в беспорядочном
- 48. Молекулы растворителя и растворенного вещества будут диффундировать преимущественно в том направлении, где их концентрация ниже. Такая
- 49. Однако диффузия бывает односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только молекулы растворителя. При этом условии,
- 50. Для количественной характеристики осмотических свойств вводится понятие осмотического давления. Осмотическое давление – это такое давление, которое
- 51. Вант –Гофф предложил, что для осмотического давления можно применять уравнение состояния идеального газа
- 52. СМ – молярная концентрация раствора. Растворы с одинаковым осмотическим давлением называются изотоническими.
- 53. ПРИМЕР: Вычислить осмотическое давление при 270 С раствора сахара С12Н22О11 (М=342) 1 литр которого содержит 91г
- 54. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
- 55. Процесс распада вещества на ионы при растворении называется электролитической диссоциацией. Количественной характеристикой этого процесса является степень
- 56. Cтепень электролитической диссоциации (α) - это количество распавшихся на ионы молекул к общему количеству растворенных молекул.
- 57. По величине α различают: а) сильные электролиты α > 0,3 б) электролиты средней силы 0,03 в)
- 58. При диссоциации в растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации –
- 59. Пример: диссоциация уксусной кислоты СН3СООН=СН3СОО– + Н+ В водном растворе устанавливается равновесие которое количественно характеризуется константой
- 60. Обозначим концентрации каждого из ионов: а концентрацию СH3COOH:
- 61. Тогда константу диссоциации запишем:
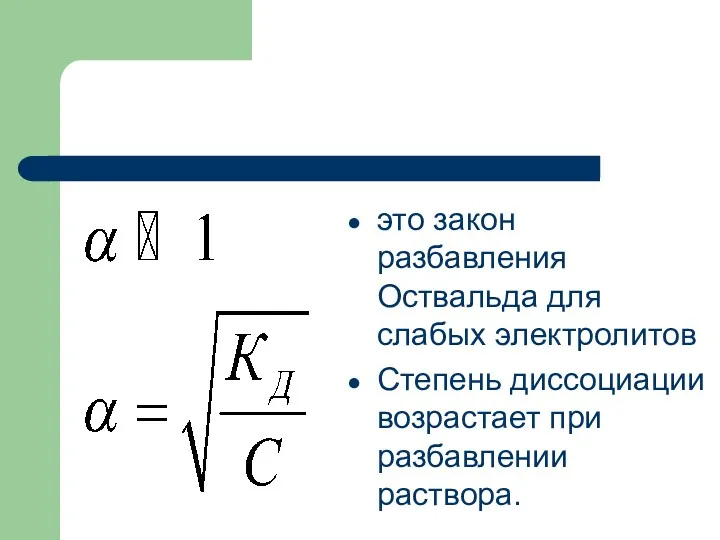
- 62. это закон разбавления Оствальда для слабых электролитов Степень диссоциации возрастает при разбавлении раствора.
- 63. Сильные электролиты в растворе диссоциируют на ионы. Рассмотрим примеры диссоциации кислот, оснований, солей.
- 64. Диссоциация H2SO4 Серная кислота диссоциирует по двум ступеням: H2SO4 = H+ + HSO4 – HSO4 –
- 65. Диссоциация NaOН NaОH = Na+ + OH–
- 66. Диссоциация солей KCI = K+ + CI– Al2(SO4)3 = 2Al3+ + 3SO4 2–
- 67. Экспериментально определяемые для сильных электролитов степени диссоциации называют кажущимися (αкаж) как правило αкаж не равно 100%
- 68. Диссоциация электролита приводит к тому, что общее число частиц растворенного вещества молекул и ионов в растворе
- 69. Изотонический коэффициент Это отношение общего числа частиц в растворе к числу растворенных молекул В растворах электролитов
- 70. Изотонический коэффициент (i) – показывает во сколько раз концентрация частиц в растворе больше числа растворенных молекул.
- 71. Изотонический коэффициент ( i ) может быть вычислен как отношение ΔР, ΔТкип, ΔТзатв, Росм, найденных на
- 72. Изотонический коэффициент ( i ) и степень электролитической диссоциации ( α ) связаны между собой соотношением:
- 73. Пример: Вычислить осмотическое давление (170С) раствора Na2SO4 в 1 литре которого содержится 7,1 грамма растворенной соли.
- 74. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
- 75. В насыщенном растворе малорастворимых соединений устанавливается равновесие между осадком и ионами электролита в растворе BaSO4 →
- 76. Произведение растворимости Произведение растворимости равно константе равновесия реакции, равно произведению молярных концентраций ионов участвующих в равновесии
- 77. Пример: Ca3(PO4)2 = 3Ca2+ + 2PO43- ПР=[Ca2+]3·[PO43-]2 =Kp
- 78. ПРИМЕР 1. Растворимость гидроксида магния при 180С равна 1,7*10–4 моль/л. Найти произведение растворимости.
- 79. ПРИМЕР 2 Произведение растворимости СаF2 =3,9·10–11. Какова растворимость СаF2 в воде( в г/литр и молях/литр).
- 80. Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его произведением растворимости.
- 81. Будет ли образовываться при смешении равных объемов нитрата свинца с концентрацией 12·10–4 моль/л и сульфата натрия
- 82. Константа диссоциации воды Вода - слабый электролит Н2О = Н+ + ОН–
- 83. Ионное произведение воды: 1 л. H2O содержит 55,5 моль H2O Kд.[H2O] = 1,86.10–16.55,5 = = [H+].[OH–]
- 84. Водородный показатель Кислотность или основность водных растворов характеризуется концентрацией [Н+] или [ОН–] ионов Удобнее использовать логарифмическое
- 86. Скачать презентацию















![б) гидратация ΔНгидр Na+ + n·H2O = [Na(H2O)n]+ Cl– + m·H2O = Cl– •m·H2O ΔH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/212515/slide-16.jpg)













































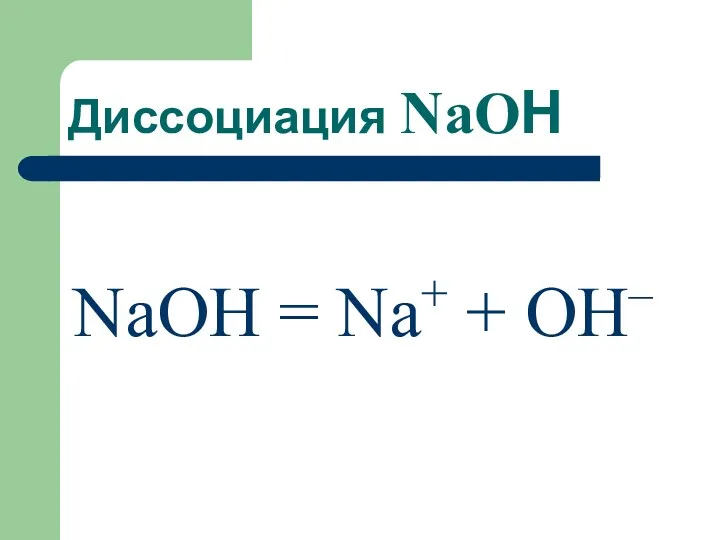











![Пример: Ca3(PO4)2 = 3Ca2+ + 2PO43- ПР=[Ca2+]3·[PO43-]2 =Kp](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/212515/slide-76.jpg)






![Водородный показатель Кислотность или основность водных растворов характеризуется концентрацией [Н+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/212515/slide-83.jpg)
 Металдардыњ механикалыќ ќасиеттері-алюминий
Металдардыњ механикалыќ ќасиеттері-алюминий Алкины. Химические свойства и способы получения алкинов
Алкины. Химические свойства и способы получения алкинов Гидролиз неорганических солей
Гидролиз неорганических солей Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Классификация химических реакций по различным основаниям. 9 класс
Классификация химических реакций по различным основаниям. 9 класс Тұндыру әдістері
Тұндыру әдістері Алюминий и его соединения
Алюминий и его соединения Валентные состояния атома углерода
Валентные состояния атома углерода Моющие средства
Моющие средства Способи очищення води
Способи очищення води Кислород как элемент
Кислород как элемент Реакционная способность твердых тел и способы ее регулирования
Реакционная способность твердых тел и способы ее регулирования Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Химия в строительстве
Химия в строительстве Муравьиная кислота
Муравьиная кислота Взаимное влияние атомов в молекулах. Шкалы электроотрицательности
Взаимное влияние атомов в молекулах. Шкалы электроотрицательности Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы Электрохимическая коррозия
Электрохимическая коррозия Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения
Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения Радиогеохимия метаморфических процессов
Радиогеохимия метаморфических процессов Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Биологически важные вещества жиры
Биологически важные вещества жиры Периодический закон и периодическая система Д.И. Менделеева. 9 класс
Периодический закон и периодическая система Д.И. Менделеева. 9 класс Коррозия и защита полимерных строительных материалов
Коррозия и защита полимерных строительных материалов